UPLC-MS/MS检测牛奶中19种β-内酰胺类药物残留的两种前处理方法对比试验
2022-09-15王淑婷李月华王玉东焉华骏王晓茵曹旭敏秦立得孙晓亮宋翠平赵思俊
王淑婷,刘 坤,刘 静,李月华,王玉东,焉华骏,王晓茵,曹旭敏,秦立得,孙晓亮,宋翠平*,赵思俊*
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛华测检测技术股份有限公司,山东青岛 266100)
β-内酰胺类抗生素(β-lactam antibiotics)是指化学结构中含有β-内酰胺环的一类抗生素,主要包括青霉素类和头孢菌素类,其作用特点是能够抑制细菌黏肽转肽酶的活性,从而阻止细菌细胞壁的合成,呈现杀菌活性[1]。β-内酰胺中四元环的存在, 使得这些化合物的理化性质与其他类的抗生素有较大不同[2]。在奶牛养殖业中, β-内酰胺类抗生素常被用于医治奶牛的乳腺炎, 由于其使用广泛,可能导致在牛奶中存在残留[3]。牛奶中的抗生素残留是乳制品生产过程中一个严重的健康和技术问题[4]。随着新药研究的不断更新,建立先进的牛奶中β-内酰胺分析方法已成为残留监控的重点问题。在药物残留分析检测的过程中,对样品的前期处理非常重要,也是整个检测过程中最可能出现误差的环节,处理得当可以提高对样品分析的准确性,所以优化前处理技术,保证多种药物的回收效果和试验结果的精密度是建立检测方法的关键[5]。在报道的方法中,Oasis HLB柱常被用于β-内酰胺类药物提取液的净化。张琦[6]等用阿莫西林、头孢氨苄、氨苄西林和青霉素V等药物的标准混合液对HLB柱、C18柱、MAX柱的净化效果进行对比,结果表明HLB柱对所测药物的保留能力和重现性最好,回收率最高,回收率为34%~93%,4种药物除了阿莫西林外,其余3种抗生素的平均回收率均高于70%。超滤(Ultrafiltration,UF) 是一种压力驱动系统[7],通过仅允许低于某个分子量截止值的小分子通过膜来实现与大分子物质分离的目的[8]。膜在食品工业中的应用主要集中在乳清、牛奶、葡萄酒、啤酒、水果和蔬菜汁等几种食品和副产品的分离、分馏、纯化、澄清和浓缩中[9-11]。张秀尧等[12]使用超滤离心法,先用乙腈对牛奶中β-内酰胺类药物进行提取,提取液经超滤管离心净化处理,通过超高效液相色谱-三重四极杆质谱快速测定牛奶中53种β-内酰胺类抗生素及其代谢产物的残留量。相关系数均优于0.9911,平均加标回收率在71%~121%之间,相对标准偏差为1.7%~19%。本试验在已建立的UPLC-MS/MS仪器检测法的基础上,分别用超滤离心浓缩管与Oasis HLB柱对牛奶样品进行净化浓缩,目的为确立一种方法简单,试剂消耗少,测定时间短,回收效果好,结果准确可靠的前处理方法。
1 材料与方法
1.1 试剂与材料
1.1.1 牛奶样品 超市购买。经实验室分析检测,购买的牛奶样品中未检出β-内酰胺类药物,可作为空白样品使用。
1.1.2 标准物质 青霉素G(PEN-G,纯度99.5%)、青霉素V(PEN-V,纯度99.0%)、氯唑西林(LZXL,纯度97.0%)、双氯西林(SLXL,纯度99.5%)、氟氯西林(FLXL,纯度91.0%)、萘夫西林(NFXL,纯度91.0%)、头孢哌酮(TBPT,纯度94.0%),上述7种标准品均购自德国Dr.Ehrenstorfer GmbH公司;苯唑西林(BZXL,纯度99.5%)、甲氧西林(JYXL,纯度91.4%)、头孢地尼(TBDN,纯度98.0%)、美罗培南(MLPN,纯度98%)、多尼培南(DNPN,纯度98%)、青霉噻唑酸V(QM-SZS-V,纯度95.0%)购自加拿大Toronto Research chemicals INC公司;美西林(MXL,纯度90.0%)、哌拉西林(PLXL,纯度94.4%)、美洛西林(MLXL,纯度95.10%)、头孢噻吩(TBSFEN,纯度94.7%)均购自USP公司;阿洛西林(ALXL,纯度93.74%)购自中国药品生物制品检定所;头孢匹林(TBPLin,纯度99.6 %)购自英国British Pharmacopeia公司。
1.1.3 试剂 乙腈,色谱纯,美国Merck公司出品。
1.1.4 主要仪器设备 AcquityTMUPLC- Xevo TQMS UPLC-MS/MS仪(美国Waters公司);固相萃取设备(Wat 200677,美国Waters公司);超滤离心浓缩管(0.2 μm Supor®, Aqua,MCPM02C67,美国PALL公司);Milli-Q超纯水仪,美国Millipore公司出品;高速冷冻离心机;数控超声波清洗仪;冰箱;漩涡混合器;N2蒸发仪。
超滤离心管:体积为6 mL,截留分子量(MWCO)为0.2 μm和0.45 μm;体积为20 mL,截留分子量(MWCO)为3、10 kD,购自美国PALL公司。新超滤管在使用前先加入超纯水,水量完全过膜,放置冰浴或冰箱里预冷几分钟,再将水倒出,加入前处理液。
1.1.5 溶液的配制
1.1.5.1 标准储备溶液配制(1000 μg/mL) 准确称取适量的β-内酰胺类药物标准品到棕色容量瓶中,分别用50%乙腈水溶解并定容至10 mL,配成1000 μg/mL的标准储备液,-20 ℃冷藏保存。
1.1.5.2 混合标准储备溶液配制(10.0 μg/mL) 从冰箱中取出β-内酰胺类药物标准储备液(1000 μg/mL)放至室温,分别准确吸取250 μL于25 mL容量瓶中,加50%乙腈水稀释至刻度,配成10.0 μg/mL的标准工作液,-20 ℃冷藏保存。
1.1.5.3 混合标准工作溶液配制(1.0 μg/mL) 从10.0 μg/mL的标准工作液中取1 mL于10 mL容量瓶中,加50%乙腈水稀释至刻度,配成1.0 μg/mL的标准工作液,即配即用。
1.1.5.4 流动相配制 流动相A:配制0.1 %甲酸(V/V)水溶液,甲酸与超纯水按体积比1∶1000混合。流动相B:乙腈;使用前将流动相A、B分别超声5 min,现用现配。
1.1.5.5 复溶液配制 乙腈与超纯水按体积比1∶5混合,现用现配。
1.1.6 灵敏度的考察 用1.1.5.5项确定的复溶液制备不同浓度的混合标准溶液,用实验室已建立的UPLC-MS/MS仪器检测法进行分析,重复6次。以信噪比S/N=3时为检测限(LOD),信噪比S/N=10时为定量限(LOQ)。
1.1.7 标准曲线的绘制 依照10、20、50、100 μg/kg的浓度分别准确吸取19种药物的混合标准工作液,氮气吹干,用水-乙腈(80/20,V/V)水复溶,制备系列标准溶液,进行UPLC-MS/MS分析,以定量离子的峰面积为纵坐标(y),标准品添加浓度为横坐标(x)绘制标准曲线,并求回归方程和相关系数。
1.1.8 精密度的考察 取50 ng/mL的标准混合溶液置于1 mL的进样瓶中,3个平行,重复3次,测定各药物的峰面积积分值,通过回归方程计算各物质浓度,计算各药物浓度的RSD(n=3),以RSD来考察方法的精密度。
1.2 方法
1.2.1 UPLC-MS/MS检测法
1.2.1.1 色谱条件 色谱柱:Waters Acquity UPLCTMBEH C18柱(100 mm×2.1 mm,1.7 μm);流动相:A为 0.1 %甲酸溶液,B为乙腈溶液,采用梯度洗脱,条件如表1。进样量:5 μL;柱温:35 ℃;流速:0.3 mL/min。
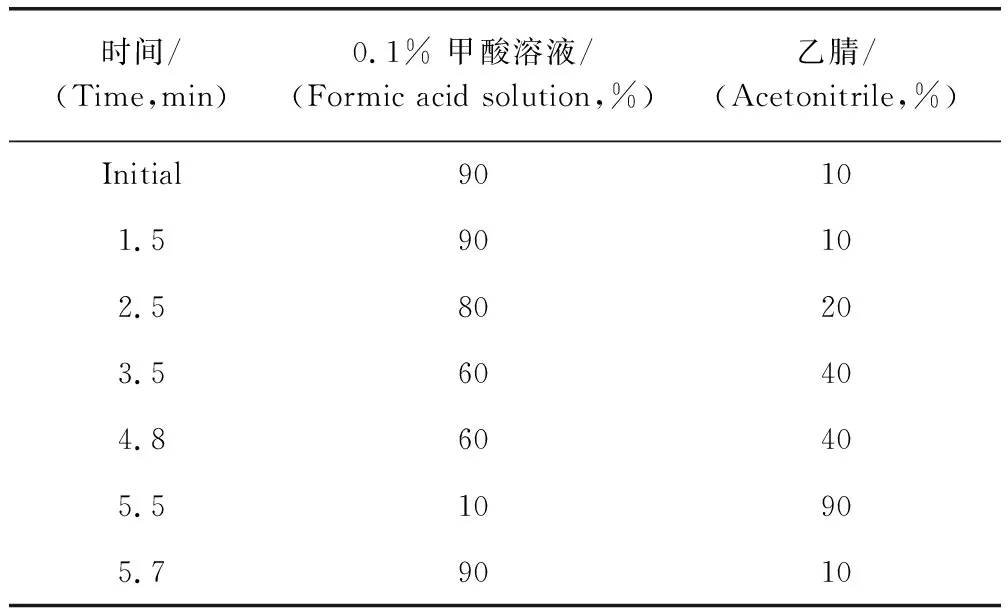
表1 梯度洗脱条件Tab 1 Gradient elution conditions
1.2.1.2 质谱条件 电喷雾离子源(ESI+),正离子扫描,多反应监测(MRM)模式,毛细管电压:2.5 kV;离子源温度150 ℃,雾化气流1000 L/h,锥孔气流50 L/h,雾化室温度450 ℃。质谱条件如表2。
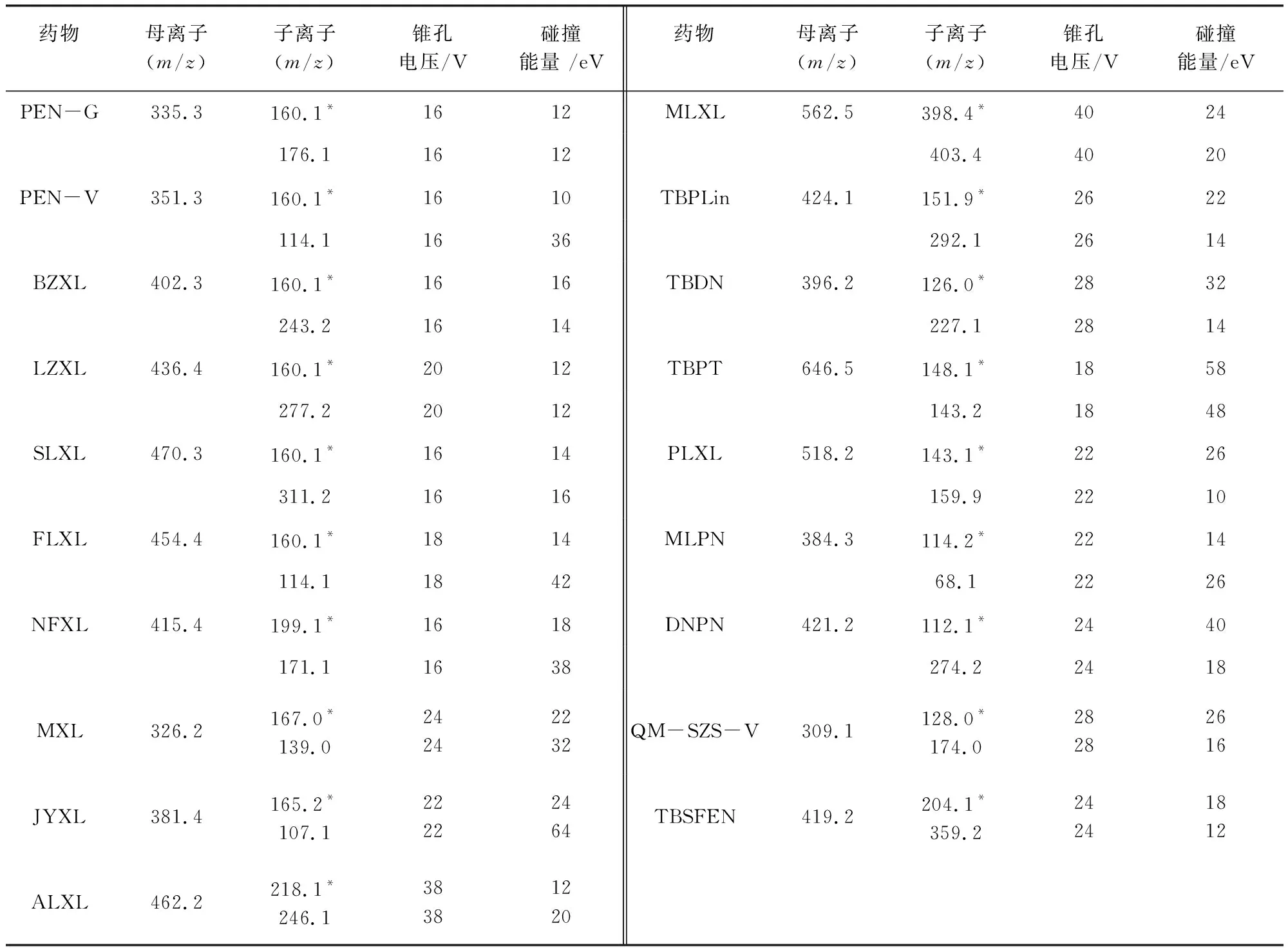
表2 质谱MRM方式检测参数Tab 2 Mass spectrum of MRM detection parameter
1.2.2 两种前处理方法对比试验
1.2.2.1 HLB-SPE柱法的样品提取 分别取空白牛奶样品(经1.1.1项中确认可作为空白样品使用)1个、回收(添加浓度为50 ng/mL)3个牛奶样品各2 mL于50 mL离心管中,加6 mL乙腈,涡旋混匀,超声提取20 min,4 ℃条件下10000 r/min离心10 min,上清液转移至洁净试管内,再加4 mL乙腈重复提取一次,合并上清。分别转移5 mL上清液于另一新管中,均于45 ℃氮气吹干,用3 mL 20%乙腈溶解,分别作样液备用。
1.2.2.2 HLB-SPE柱法的净化与浓缩 依次用3 mL乙腈活化,3 mL水平衡,3 mL样液上样,依次用3 mL水淋洗,3 mL 乙腈洗脱后,收集洗脱液,45 ℃下N2吹干,加1 mL水-乙腈(80/20,V/V)复溶,过0.2 μm滤膜,供UPLC-MS/MS分析。
1.2.2.3 超滤离心管法的样品提取 分别取空白(经1.1.1项中确认可作为空白样品使用)1个、回收(添加浓度为50 ng/mL)3个牛奶样品各2 mL于50 mL离心管中,加6 mL乙腈,涡旋混匀,超声提取10 min,4 ℃条件下10000 r/min离心10 min,上清液转移至洁净试管内,再加4 mL乙腈重复提取一次,合并上清。分别于45 ℃氮气吹干,用1 mL 20%乙腈溶解,分别作样液备用。
1.2.2.4 超滤离心管法的净化与浓缩 将样液倒入超滤离心浓缩管中,4 ℃条件下10000 r/min离心10 min,取滤液装瓶,供UPLC-MS/MS分析。
2 结果与分析
2.1 线性关系和灵敏度 19种β-内酰胺类药物的线性关系和灵敏度结果见表3。结果表明,19种药物的灵敏度好,在线性范围内相关系数均大于0.99,线性关系良好,能够满足定性和定量分析的要求。
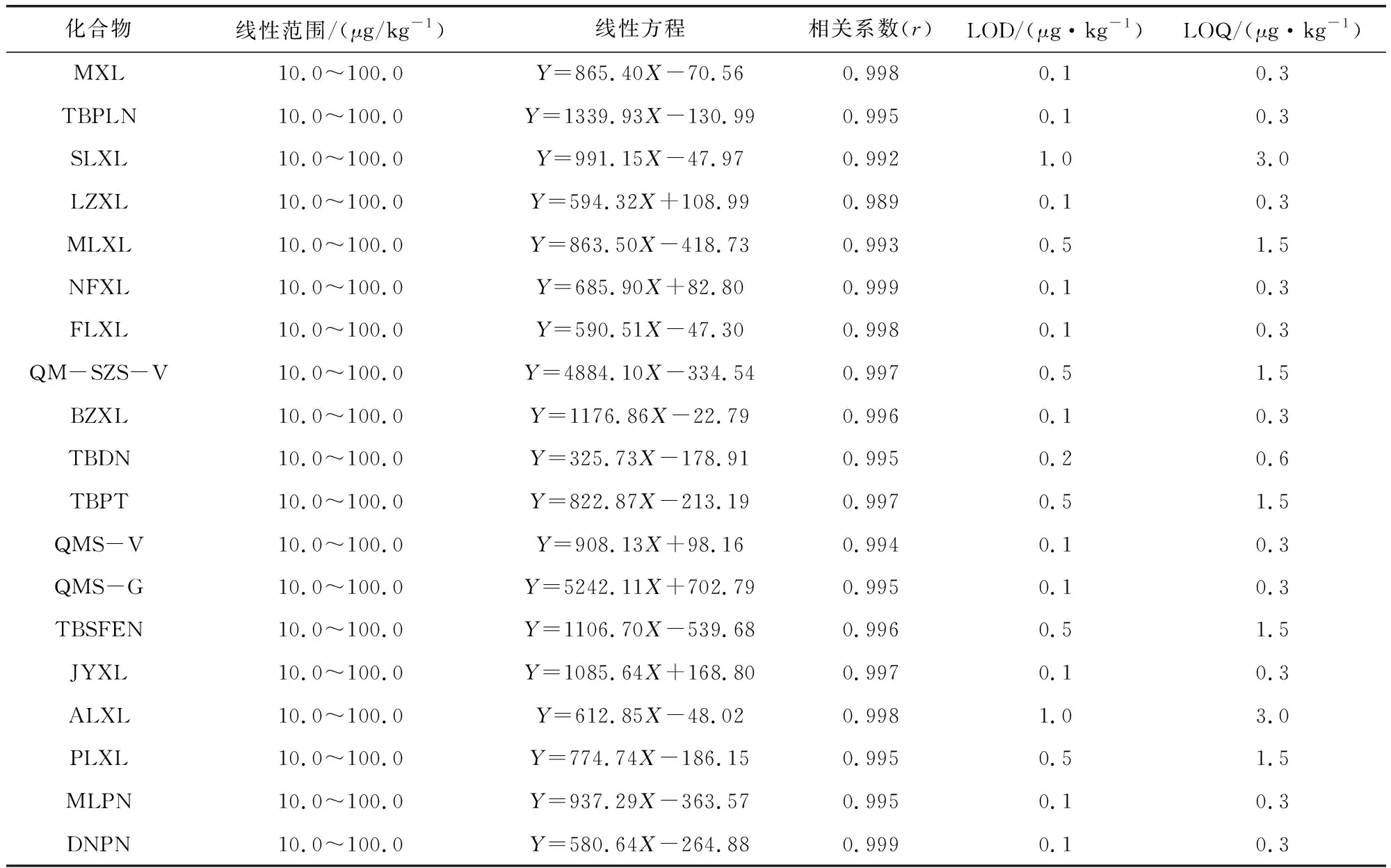
表3 19种β-内酰胺类药物的线性范围、线性方程、相关系数、检测限和定量限Tab 3 Linear ranges, Regression equations,Correlation coefficient,LOD and LOQ of 19 β-lactams
2.2 精密度 测得的β-内酰胺类药物的浓度及计算的标准偏差见表4,结果表明,19种分析药物的日内相对标准偏差(RSD)为0.68%~3.47%,日间的相对标准偏差(RSD)为0.89%~4.11%,说明试验19种药物的测定精密度良好。
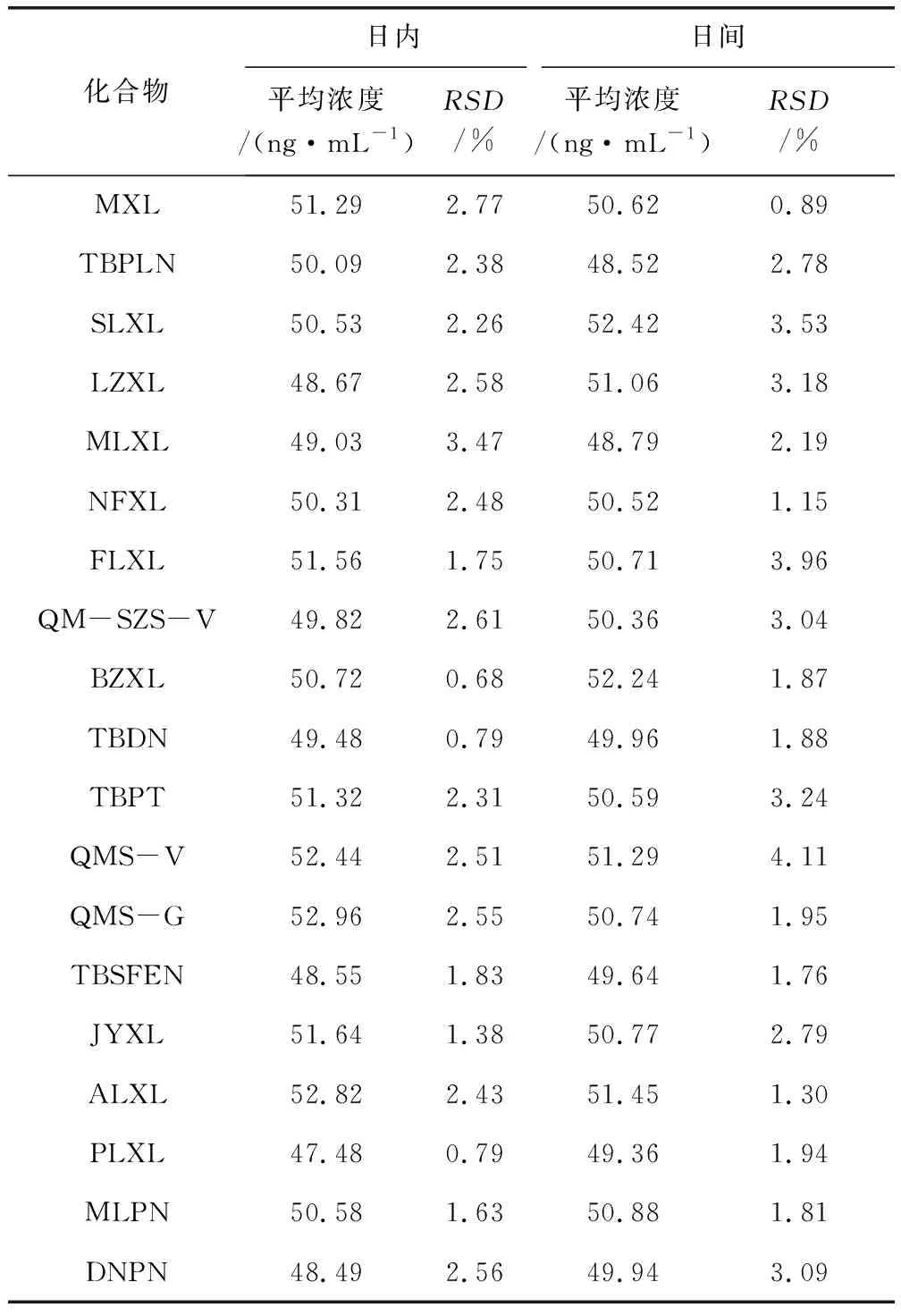
表4 标准方程计算的19种β-内酰胺类药物浓度及相对标准偏差Tab 4 concentrations of 19 β-lactams calculated by standard curve equations and RSD
2.3 两种前处理方法的结果回收率比较 由图1可知,HLB-SPE柱法整体回收效果不如超滤离心浓缩管法回收效果理想,回收率在4.2%~104.1%,超滤离心浓缩管的回收率均在60.7%~96.6%范围内,回收效果更好。

图1 两种前处理方法对牛奶中19种β-内酰胺类药物的回收率的影响Fig 1 Effects of the recoveries of 19 β-lactams in milk by two pretreatment methods
3 讨论与小结
3.1 复溶液的优化 分别采用水-乙腈(90/10、80/20、70/30、60/40,V/V)体系和0.1%甲酸水-乙腈(90/10、80/20、70/30、60/40,V/V)体系作为复溶液对19 种β-内酰胺类药物混标(加标水平10.0 μg/kg)在用N2吹干后进行回收复溶试验。试验结果发现水相中添加甲酸明显对苯唑西林、氯唑西林、双氯西林等青霉素类药物的回收率产生不利影响,可能是加入甲酸后pH降低,对药物保留和稳定性产生了影响[13]。在水-乙腈体系中,多种药物随乙腈含量的增加而响应增高,但乙腈含量过高会出现峰形差的问题。所以综合考虑峰形、回收率等因素,选择水-乙腈(80/20,V/V)作为样品的复溶液,既能保证各组分峰形良好,又能保证药物的回收率,从而达到理想的检测效果。
3.2 超滤膜分子量的选择 通常情况下选择合适的超滤管,主要考虑 MWCO和浓缩体积,而本实验是需要离心透析出的液体,因此在选用超滤管时不但要考虑能否透析出目标化合物,还要考虑被截留的大分子物质在离心时是否会损坏超滤膜[14]。19种β-内酰胺类药物的分子量均在 300~700之间,根据现有的6 mL和20 mL超滤管的型号规格 (0.2 μm,0.45 μm,3 kD,10 kD) 进行试验。
先加入1 mL 20%乙腈离心 10 min,0.2 μm,0.45 μm,3、10 kD超滤管均能全部滤出; 选用牛奶样品,按1.2.2.3项方法进行样品处理后,取 1 mL上清液加入超滤管中,10000 r/min 离心 10 min,0.2 μm、0.45 μm和3 kD超滤膜均能够离心彻底,且未见破损,滤液澄清,而10 kD超滤管存在透滤现象,滤液浑浊;选用空白样品进行加标回收(加标水平 50.0 μg/kg)试验,按1.2.2.3项和1.2.2.4项方法进行检测,结果显示采用0.2 μm超滤管的回收效果较好。为了更好地截留生物大分子物质,达到最佳回收效果,本试验选用截留分子量为 0.2 μm的超滤管。
3.3 离心条件的选择 由于离心力垂直于膜,通常会发生强烈的浓差极化,如此一来,过滤速度可能迅速减慢,甚至堵塞膜,从而对滤液的回收率和体积产生影响[8]。因此,需要选择适当的离心速率。该超滤管推荐的离心速率约为10000 r/min,按1.2.2.3项方法进行样品处理后,分别对不同离心速率(6000,8000,10000,12000 r/min) 和离心时间(5,10,15,20 min) 进行比较,上机检测后计算19种目标物的回收率。实验结果显示,离心速率对回收率无明显影响,与离心出的液体快慢有关,即离心速率越大,达到相同净化效果所需的离心时间越短,但离心速率过快,会损坏超滤膜,离心速率太低则会使滤液体积过少,故在实际使用中采用10000 r/min 离心 10 min,其离心出的液体量满足实验要求且滤膜无破损。
3.4 超滤管的净化效果 在空白牛奶样品中添加19种β-内酰胺类药物混标(加标水平为50.0 μg/kg),加入 10 mL 乙腈分两次提取,N2吹干后,将用1 mL 20%乙腈复溶后的上清液加入超滤管中,进行净化处理,上机检测;另取 1 mL上清液直接上机检测。经超滤管净化处理和未处理的牛奶样品的检测结果可以看出,经超滤管净化处理的样品干扰减少,降低了基质效应,达到了净化目的。
本试验对牛奶样品分别用固相萃取HLB柱和超滤离心管进行净化、浓缩处理,比较了两种方法对牛奶中19种β-内酰胺类药物的回收效果。其中,HLB柱对双氯西林、氯唑西林、美洛西林、萘夫西林、氟氯西林和苯唑西林等6种药物进行净化浓缩处理的回收率和用超滤离心管处理的回收率相当,两者回收率均在69.1%~104.1%,而美西林、青霉素-V、青霉素-G、甲氧西林、阿洛西林、哌拉西林、青霉噻唑酸V、头孢匹林、头孢地尼、头孢哌酮、头孢噻吩、美罗培南和多尼培南等13种药物的回收率结果表明,用超滤离心管进行净化浓缩处理远远高于用HLB柱处理的回收率,且均在60.7%~95.4%。综合以上试验结果,用超滤离心管对牛奶进行净化浓缩处理比HLB柱的回收效果好。使用超滤离心管的前处理方法简单,试剂消耗少,测定时间短,结果准确可靠,可以获得良好的测定效果,故本试验选择超滤离心管作为检测牛奶中β-内酰胺类药物残留的前处理方法。
