子宫内膜癌患者血清诱导型一氧化氮合酶、可溶性肿瘤坏死因子受体水平及临床意义
2022-09-15买卫红吴宁张晓慧
买卫红,吴宁,张晓慧
周口市人民医院妇产科,河南 周口 466000
子宫内膜癌(endometrial cancer,EC)是常见的生殖系统恶性肿瘤之一,最常见的病理类型为内膜样腺癌,约70%以上发生于绝经老年女性,近年来EC发病趋于年轻化[1-2]。目前EC的诊断无特异性肿瘤标志物,越来越多的学者致力于探索对EC诊断及严重程度预判等价值较高的血清学指标,以期及早诊断疾病并及时予以相应治疗,进而改善患者预后。一氧化氮是人体内重要的细胞间信号传递因子,具有诱导肿瘤细胞凋亡的作用,其由一氧化氮合酶(nitricoxide synthase,NOS)催化合成[3]。其中,诱导型一氧化氮合酶(inducible NOS,iNOS)在正常组织中很少表达,在肿瘤组织或参与病理过程的炎性细胞中表达,已有研究表明其与淋巴瘤、肺癌、肝癌等发生发展密切相关[4-6]。可溶性肿瘤坏死因子受体(soluble tumor necrosis factor receptor,sTNFR)分为sTNF-RⅠ、sTNF-RⅡ两种,分别来源于肿瘤坏死因子受体p55和p75的膜外段[7]。sTNFR与肿瘤坏死因子(tumor necrosis factor,TNF)结合后阻断了TNF与膜受体的结合,进而抑制TNF功能,保护机体抵抗TNF的病理损伤,已有研究发现sTNFR水平变化在喉癌、宫颈癌等临床诊疗中具有重要意义[8-9]。然而,针对iNOS及sTNFR与EC发生发展的相关研究较为少见。本研究探讨EC患者血清iNOS、sTNFR的水平及临床意义,现报道如下。
1 对象与方法
1.1 研究对象
选取2017年1月至2020年1月周口市人民医院收治的55例首诊为EC的患者作为EC组。纳入标准:①符合《2015年NCCN子宫内膜癌临床实践指南解读》[10]中EC诊断标准;②病理检查结果为EC;③初诊EC;④术前未行放化疗、生物免疫治疗等抗肿瘤治疗。排除标准:①有其他部位肿瘤未治愈;②有严重的心脑肝肾或其他疾病;③合并自身免疫性疾病。55例EC患者,年龄24~65岁,平均(48.66±10.32)岁;子宫内膜样腺癌51例,其他4例;淋巴结转移10例;Ⅰ~Ⅱ期26例,Ⅲ~Ⅳ期29例。选取55例同期子宫良性病变患者作为子宫良性病变组。纳入标准:①因子宫肌瘤等良性病变行子宫全切术;②病理检查结果为良性;③术前未接受生物免疫疗法。排除标准:①有其他部位肿瘤未治愈;②有严重的心脑肝肾或其他疾病;③合并自身免疫性疾病。55例子宫良性病变患者,年龄31~64岁,平均(49.31±11.46)岁;子宫肌瘤33例,子宫内膜息肉12例,子宫肥大症6例,子宫腺肌病4例。另选取55例同期同年龄段健康体检的女性作为健康组,年龄 29~65岁,平均(49.14±10.58)岁。EC组、子宫良性病变组及健康组研究对象的年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 检测方法
取3组研究对象晨起空腹静脉血3 ml,离心(3000 r/min,10 min,离心半径12 cm)分离出血清后置于-20℃冰箱中保存待检。
iNOS检测[11]:采取双抗体酶联免疫吸附法,采用抗人iNOS抗体包被微孔板,制成固相抗体,包被单抗的微孔中依次加入iNOS,再与辣根过氧化物酶(horse radish peroxidase,HRP)标记的iNOS抗体相结合,形成抗体-抗原-酶标抗体复合物,加入酶底物四甲基联苯胺(tetramethylbenzidine,TMB),出现黄色时加入硫酸终止,用酶标仪在450 nm波长下测定吸光度(optical density,OD)值,以空白孔调零,450 nm波长依序测量各孔OD值,通过标准曲线计算样品中iNOS浓度。
sTNFR检测[12]:包括sTNF-R Ⅰ、sTNF-R Ⅱ,采取双抗体夹心酶联免疫吸附法,采用抗人sTNF-R Ⅰ、sTNF-R Ⅱ单抗包被于酶标板上,标准品与样品中的sTNF-R Ⅰ、sTNF-R Ⅱ和单抗结合,加入生物素化的sTNF-R Ⅰ、sTNF-R Ⅱ抗体,形成免疫复合物,HRP标记的链霉抗生素蛋白与生物素相结合,加入酶底物邻苯二胺(o-phenylenediamine,OPD),出现黄色时加入硫酸终止,在492 nm处测得OD值,sTNF-R Ⅰ、sTNF-R Ⅱ值与OD值呈正比,通过绘制标准曲线计算标本中的sTNF-R Ⅰ、sTNF-R Ⅱ浓度。
1.3 观察指标
比较EC组、子宫良性病变组及健康组研究对象血清iNOS及sTNF-R Ⅰ、sTNF-R Ⅱ水平,比较Ⅰ~Ⅱ期与Ⅲ~Ⅳ期EC患者血清iNOS及sTNF-R Ⅰ、sTNF-R Ⅱ水平。对手术切除的子宫内膜标本进行免疫组化检测,分析EC患者血清iNOS及sTNFR异常表达与临床特征的关系及影响因素。以iNOS≥1.23 U/ml、sTNF-R Ⅰ≥1.18 ng/ml、sTNF-R Ⅱ≥3.93 ng/ml为高表达[13]。
1.4 统计学方法
采用SPSS 20.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,两组比较采用t检验,多组比较采用单因素方差分析;计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher确切概率法;影响因素分析采用多因素Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 血清iNOS及sTNFR水平的比较
EC组患者血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平均高于子宫良性病变组及健康组,差异均有统计学意义(P<0.05);子宫良性病变组与健康组血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平比较,差异均无统计学意义(P>0.05)。(表1)
表1 EC组、子宫良性病变组及健康组研究对象血清iNOS及sTNFR水平的比较(±s)

表1 EC组、子宫良性病变组及健康组研究对象血清iNOS及sTNFR水平的比较(±s)
注:a与健康组比较,P<0.05;b与子宫良性病变组比较,P<0.05
组别EC组(n=55)子宫良性病变组(n=55)健康组(n=55)F值P值1.33±0.38a b 0.86±0.25 0.81±0.21 54.102 0.000 1.54±0.41a b 0.84±0.26 0.78±0.20 106.848 0.000 4.36±0.71a b 2.79±0.64 2.71±0.61 111.082 0.000 iNOS(U/ml)sTNFR(ng/ml)sTNF-RⅠsTNF-RⅡ
2.2 不同病理分期EC患者血清iNOS及sTNFR水平的比较
Ⅰ~Ⅱ期EC患者血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平均低于Ⅲ~Ⅳ期患者,差异均有统计学意义(P<0.05)。(表2)
表2 不同病理分期EC患者血清iNOS及sTNFR水平的比较(±s)

表2 不同病理分期EC患者血清iNOS及sTNFR水平的比较(±s)
病理分期Ⅰ~Ⅱ(n=26)Ⅲ~Ⅳ(n=29)t值P值1.12±0.29 1.52±0.43 3.996 0.000 1.40±0.36 1.67±0.52 2.213 0.031 4.12±0.66 4.58±0.74 2.421 0.019 iNOS(U/ml)sTNFR(ng/ml)sTNF-RⅠsTNF-RⅡ
2.3 不同临床特征EC患者血清iNOS及sTNFR高表达情况的比较
不同病理分期、分化程度及子宫肌层浸润深度EC患者iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达情况比较,差异均有统计学意义(P<0.05);不同年龄、病理类型及淋巴结转移情况EC患者iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达情况比较,差异均无统计学意义(P>0.05)。(表3)
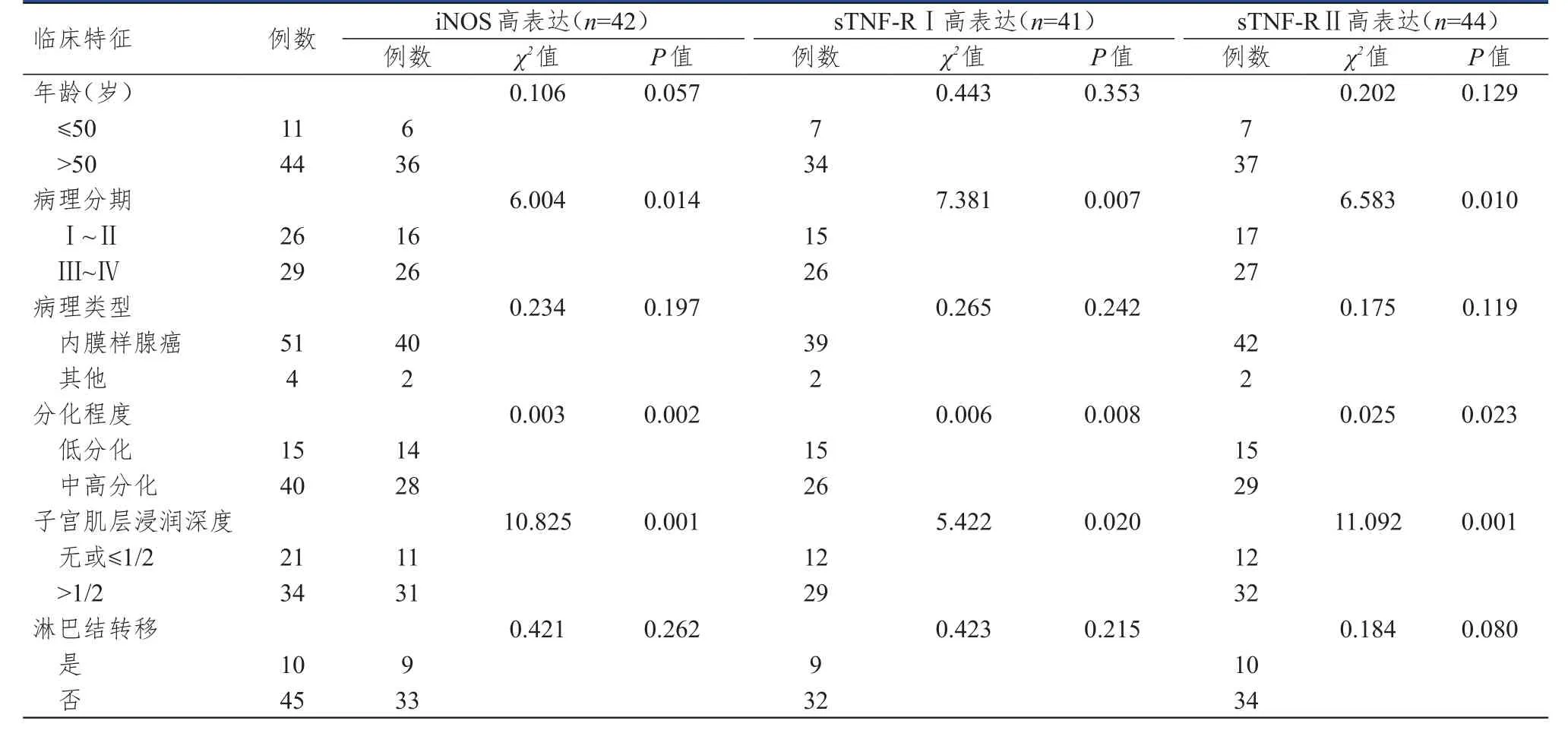
表3 不同临床特征EC患者血清iNOS及sTNFR高表达情况的比较(n=55)
2.4 EC患者血清iNOS及sTNFR高表达影响因素的多因素分析
病理分期为Ⅲ~Ⅳ期、低分化、子宫肌层浸润深度>1/2均为EC患者血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达的独立危险因素(P<0.05)。(表4)
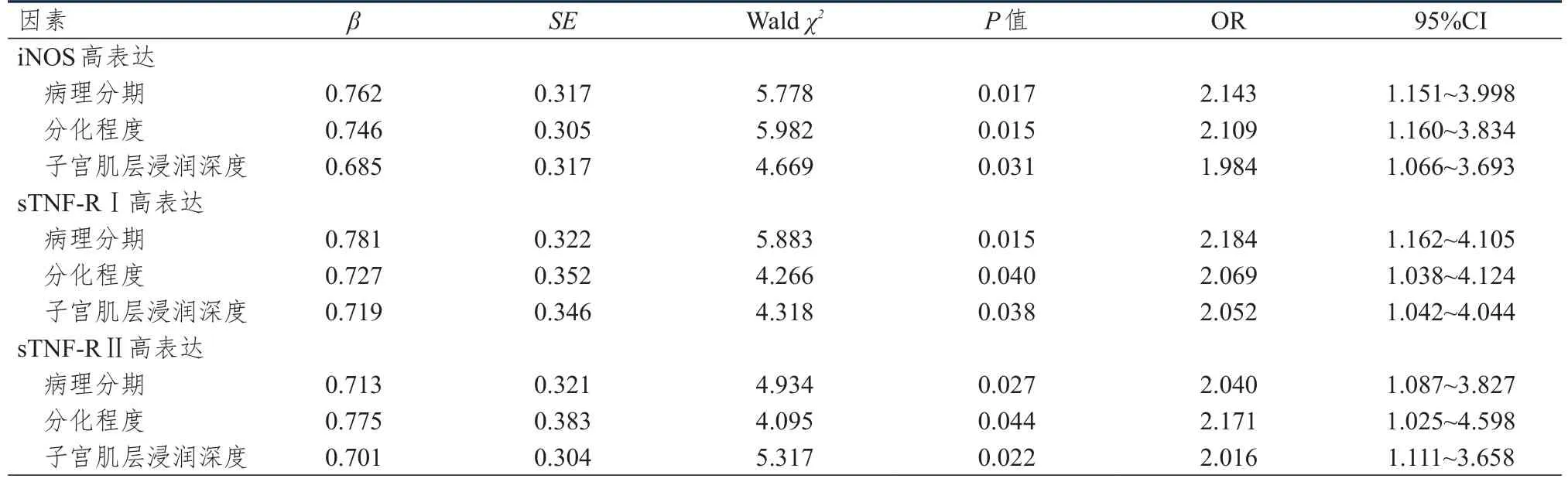
表4 EC患者血清iNOS及sTNFR高表达影响因素的多因素分析
3 讨论
EC是危害女性生命安全的常见恶性肿瘤之一,主要发生于子宫内膜腺体,以腺癌最常见[14]。EC好发于绝经老年女性,恶性程度较高,由于早期症状不足以引起重视,大多数患者就诊时已至中晚期,预后相对较差[15]。因此,将EC早期筛查与诊断、有助于治疗方案制订的分子标志物寻找出来,并探索其中的关系具有重要的临床价值。
本研究发现,EC组患者血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平均高于子宫良性病变组及健康组,子宫良性病变组患者血清iNOS、sTNF-R Ⅰ、sTNFR Ⅱ水平与健康组无明显差异,这一结果与姜腊元和谢晖[16]、陆林和陆志刚[17]研究结果具有一定相似性,提示iNOS与sTNFR在EC的发生中起到一定促进作用。国外也早有研究报道与本研究结果相似,Li等[18]证实iNOS与EC的发生发展密切相关,Gadducci等[19]发现sTNFR在EC患者血清中水平显著升高。iNOS主要存在于白细胞等炎性细胞的细胞质中,正常情况下不表达,在病理条件下大量表达,而iNOS催化产生的高浓度NO则参与肿瘤的形成[20]。机体内NO的半衰期较短,因此可通过检测iNOS水平间接反映NO的生成情况。另一方面,正常人体内的TNF和sTNFR处于平衡状态,低浓度sTNFR具有运载TNF的作用,协助抑制肿瘤细胞增殖和破坏细胞,高浓度sTNFR则与TNF结合后阻止TNF与TNFR的结合,进而抑制TNF的多种生理功能。当EC发生后,肿瘤组织刺激机体产生TNF以阻止肿瘤的发展,与此同时肿瘤本身也在刺激作用下产生膜TNFR,其中部分脱落至细胞间质,形成了可溶形式,即sTNFR,与TNFR竞争性结合TNF,降低TNF的抗肿瘤作用,进而发挥肿瘤免疫逃逸的作用[21]。本研究中Ⅰ~Ⅱ期EC患者血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平均低于Ⅲ~Ⅳ期患者,这一结果提示iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平与病理分期有一定联系,各指标水平越高,肿瘤恶性程度越高。
本研究表明,不同病理分期、分化程度及子宫肌层浸润深度EC患者iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达情况比较,差异均有统计学意义(P<0.05);不同年龄、病理类型及淋巴结转移情况EC患者iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达情况比较,差异均无统计学意义(P>0.05)。病理分期为Ⅲ~Ⅳ期、低分化、子宫肌层浸润深度>1/2均为EC患者血清iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达的独立危险因素(P<0.05)。这说明iNOS、sTNFR的高表达与EC严重程度密切相关,提示肿瘤恶性程度较高,也意味着预后可能相对不佳。这对EC的治疗也有一定的提示意义,iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ高表达表明肿瘤恶性程度高,术后需进一步行放化疗,反之肿瘤恶性程度低,考虑术后辅助内分泌治疗即可[22]。淋巴结转移也是评判EC严重程度的指标之一,本研究中iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ的高表达与是否存在淋巴结转移无明显关系,这一结果可能受研究纳入病例数较少等因素影响而存在偏倚。
综上所述,EC患者血清中iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平均升高,且晚期患者iNOS、sTNF-R Ⅰ、sTNF-R Ⅱ水平均高于早期患者,各指标高表达与病理分期、分化程度、子宫肌层浸润深度密切相关,这提示iNOS与sTNFR等分子的检测对早期诊断EC、制订合理的治疗方案、判断疾病严重程度及预后具有重要的临床意义,未来还需更多的临床研究和数据加以探索证实。
