超声造影引导下经皮胃肠道黏膜下肿瘤穿刺活检的应用
2022-09-14马丽园席海银姜韬马乾凤米成嵘杨光飞
马丽园,席海银,姜韬,马乾凤,米成嵘,杨光飞*
1.宁夏医科大学总医院超声科,宁夏 银川 750004;2.宁夏回族自治区中医医院功能科B 超室,宁夏 银川 750004;3.宁夏医科大学总医院结直肠外科,宁夏 银川 750004;*通信作者 杨光飞 375763141@qq.com
消化道黏膜下肿瘤(submucosal tumor,SMT)泛指一类起源于消化道黏膜层以下各层(主要包括黏膜肌层、黏膜下层和固有肌层)的隆起性病变[1],包括间质瘤、平滑肌瘤、脂肪瘤、神经源性肿瘤等。SMT多数为良性病变,仅不足15%存在恶性可能[2]。早期精准诊断肿瘤的良恶性以及组织分型,对患者临床治疗及预后判断等有重要意义[3]。SMT普通内镜下表现为黏膜下局部球状或梭形隆起,边界清晰,多数表面光整,因此普通内镜检出率极低[4]。超声引导下穿刺活检术可直视穿刺获取肿瘤组织条,但常规超声难以辨别肿瘤内液化坏死区和非坏死区,易造成活检假阴性[5]。超声造影(CEUS)能实时动态观察肿瘤内微血管灌注情况,辨别液化坏死区域的位置及大小,精准引导穿刺活检,提高取材满意率和穿刺成功率,广泛地应用于实质脏器和浅表器官的穿刺活检[6-7],但有关胃肠道SMT的穿刺活检鲜有报道。因此,本研究旨在探讨CEUS引导下经皮胃肠道SMT穿刺活检的应用价值。
1 资料与方法
1.1 研究对象 回顾性分析2018年1月—2021年1月在宁夏医科大学总医院超声科接受超声引导下经皮胃肠道肿瘤穿刺活检术的患者79例,男49例,女30例,年龄24~77岁,平均(55.2±14.4)岁,肿物最长径25.57~235.63 mm,平均(117.2±55.5)mm。按照引导穿刺方式不同分为常规超声组22例和CEUS组57例。纳入标准:①腹部影像学检查提示胃肠道占位性病变直径≥20.00 mm;②普通胃肠镜检查无明显异常;③既往有胃肠道肿瘤病史,影像学检查怀疑复发或转移者;④病变经手术切除或内科治疗至少随访半年。排除标准:①胃肠镜证实起源于胃肠道黏膜层的肿瘤;②中途退出或失访者。本研究经本院伦理委员会审查同意(2019-015),所有患者术前均签署知情同意书。
1.2 仪器与方法
1.2.1 仪器 采用佳能Aplio500超声诊断仪,配备凸阵探头6C1(频率2~6 MHz)和线阵探头14L5(频率5~14 MHz),仪器内置造影条件,机械指数0.06~0.08;BARD公司生产的一次性全自动穿刺活检枪(16G或18G);2%利多卡因注射液;造影剂使用SonoVue(Bracco公司),使用前注入5 ml生理盐水充分振荡混匀。
1.2.2 方法 ①穿刺术前准备:检查常规心电图、血常规、凝血功能等;术前禁食8~12 h,必要时行清洁灌肠,并签署CEUS检查和穿刺活检知情同意书。②CEUS:常规超声扫查并记录肿瘤的二维声像图特征及周边血流情况。开启仪器造影模式,经肘静脉快速注入SonoVue混悬液约2 ml,立即用生理盐水5 ml冲管,即刻实时动态双幅造影界面记录并观察肿瘤造影增强过程、增强模式及瘤体内造影剂灌注情况。根据造影声像图特征设计穿刺方案。首先,选择距体表最短的安全路径,且瘤体前方无肠管、血管、膀胱等重要组织;其次,选择瘤体内造影剂灌注增强的实性区域且该区域无粗大血管通过;最后,确定穿刺路径、测量穿刺针弹射的安全距离,穿刺点做体表标记。③穿刺活检:患者取仰卧位,充分暴露腹部,必要时训练患者呼吸幅度以保证穿刺安全。于超声引导下行局部浸润麻醉,在二维超声模式下引导一次性穿刺活检枪自穿刺点进针后,根据前期CEUS或常规超声预设的穿刺路径进针至肿瘤内,迅速取材并出针。每例患者常规取材2~3次,观察组织条的外观及长度,组织条放入福尔马林溶液中固定后送病理检查。穿刺结束局部用纱布包扎。④穿刺活检术后注意事项:嘱患者静卧按压穿刺部位15~20 min,超声探查穿刺部位无明显出血者,嘱患者24 h内进流食并卧床休息,如有不适及时告知主管医师。
1.3 评价标准 取材成功率:每例患者常规取材2~3条组织条,每条组织获得明确病理结果,即取材成功。取材成功率=穿刺获得明确病理结果的组织条数/取材的总条数。
病理诊断符合率:穿刺的病理结果与术后病理诊断吻合或内科治疗后出院诊断证明一致者为符合病例,相反者为不符合病例;首次穿刺组织条未获取明确病理结果需要再次穿刺或直接手术的病例视为不符合病例。病理诊断符合率=诊断符合病例数/总病例数。
将常规超声所示的无回声区且彩色多普勒未见血流信号的区域认定为液化坏死区,CEUS检查造影剂未灌注的区域认定为液化坏死区,比较其显示率。
1.4 统计学方法 采用SPSS 22.0软件,计量资料采用±s表示;计数资料以例数或百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 取材成功率和病理诊断符合率 常规超声组22例穿刺病理结果:间质瘤8例、淋巴瘤3例、脂肪瘤2例、平滑肌瘤1例、异位胰腺1例。7例穿刺标本无法作出病理诊断,经手术病理证实:间质瘤4例、淋巴瘤1例、转移瘤1例、脂肪肉瘤1例。CEUS组57例穿刺活检后病理结果:间质瘤24例、淋巴瘤18例、转移瘤7例、子宫内膜异位症3例、神经内分泌肿瘤1例、脂肪肉瘤1例、平滑肌瘤1例、直肠癌术后复发1例、恶性黑色素瘤1例。CEUS组共取材120条,取材成功率、病理诊断符合率分别为93.3%(112/120)、100%(57/57),显著高于常规超声组[共取材56条,取材成功率69.6%(39/56)、病理诊断符合率68.2%(15/22)],差异均有统计学意义(χ2=17.58、19.90,P均<0.001)。
2.2 常规超声和CEUS表现
2.2.1 液化坏死区显示情况 常规超声检查液化坏死区显示率:常规超声组22.7%(5/22),CEUS组19.3%(11/57)。注射造影剂后肿瘤内显示未灌注区域提示该部位为液化坏死区域(图1),CEUS组CEUS检查液化坏死区显示率为57.9%(33/57),高于常规超声检查显示率,差异有统计学意义(χ2=17.91,P<0.001)。胃肠间质瘤瘤体内液化坏死(87.5%,21/24)的比例高于淋巴瘤(33.3%,6/18)和转移瘤(42.9%,3/7),差异有统计学意义(χ2=13.14,P=0.001;χ2=6.18,P=0.029)。CEUS坏死区显示范围较常规超声增大,且灌注区与坏死区的边界更清晰。瘤体内出现液化坏死时CEUS指导穿刺活检具有较高的应用价值。

图1 男,52岁,小肠神经内分泌肿瘤。CEUS可见未灌注的液化坏死区(箭),二维超声未见明确显示(A);超声引导下对肿瘤边缘造影增强区域穿刺取材(B);病理诊断为神经内分泌肿瘤(HE,×200,C)
2.2.2 造影增强模式 CEUS组胃肠道SMT的CEUS增强表现见表1,间质瘤表现为非均匀性、向心性强化,多见未灌注区;淋巴瘤为均匀性、弥漫性强化,少见未灌注区(图2);转移瘤为非均匀性、向心性强化,部分可见未灌注区。

表1 胃肠道SMT的CEUS增强表现(例)
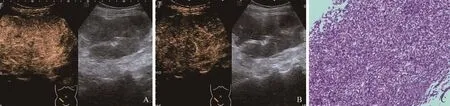
图2 女,63岁,升结肠淋巴瘤。CEUS动脉早期呈均匀性、弥漫性增强、未见液化坏死区(A);延迟期逐渐消退呈“网格样”改变(B);病理诊断为弥漫性大B细胞淋巴瘤(HE,×200,C)
2.3 穿刺术后并发症 本组79例患者穿刺活检术后未发现大量出血、感染、黑便及针道转移等严重并发症。8例患者在穿刺过程中及术后轻微腹痛;常规超声组1例患者术后即刻穿刺部位周围探及液性回声区,平卧穿刺部位加压0.5 h后,静脉注射超声造影剂2 ml后观察未探及活动性出血,术后2 h及24 h连续观察未见增多,未采取特殊处理,1周后随访无异常。
2.4 治疗方案 79例穿刺活检患者经手术治疗53例,手术辅助化疗16例,单纯化疗5例,药物治疗3例,手术辅助放化疗2例。
3 讨论
3.1 CEUS较常规超声液化坏死区显示更清晰 胃肠道SMT是一组少见的消化道疾病,由于起源不同,导致组织类型复杂多样[8]。本组病例中以胃肠间质瘤多见,为间质来源的富血供肿瘤,具有一定的恶性潜能,瘤体较大时,内部肿瘤浸润、增殖、慢性炎症等造成瘤体内血供不稳定而出现坏死区;常规超声表现为瘤体内回声不均匀,部分可见液性无回声区,CEUS液化坏死区未见造影剂灌注[9]。本研究中,CEUS后胃肠间质瘤87.5%出现液性坏死区显著高于常规超声检查(22.7%)。CEUS能更好地显示肿块轮廓边界、内部血流灌注情况,清晰识别肿块内坏死未灌注区域[10]。而胃肠道淋巴瘤以单一细胞为主堆积,其内细胞密集程度高,富含液体的间质成分少,因而肿瘤组织紧密,坏死及囊变少见。本研究CEUS淋巴瘤33.3%存在液化坏死区,与文献[11]报道一致。但既往报道多针对颈部和腹膜后淋巴瘤CEUS表现,对结外淋巴瘤的研究较少。本研究发现部分病灶CEUS显示为液化坏死区而常规超声为等回声区,更有部分病灶CEUS液化坏死区显示范围较常规超声明显增大,且灌注区与坏死区的分界更清晰。Kessner等[12]研究发现CEUS对坏死区的显示率显著高于常规超声,而且能清晰显示病灶边界,界定活性区与坏死区,与本研究结果一致。
3.2 CEUS较常规超声引导穿刺活检更具优势 胃肠道SMT的最终诊断主要依靠病理学,超声引导下穿刺活检术具有实时动态、精准安全、无辐射等优点,已成为穿刺活检的重要方法,也常应用于胃肠道疾病的穿刺活检诊断中。穿刺活检的取材成功率和病理诊断符合率与穿刺针获取的组织是否满意且具有代表性密切相关。本研究常规超声组避开液化坏死区引导穿刺病理诊断符合率68.2%,7例穿刺标本无法明确病理诊断,6例为坏死组织,1例因组织太少。分析原因:常规超声判定瘤体内液化坏死区的位置和范围存在困难,引导穿刺活检常导致取材不满意[13]。Pesenti等[14]研究表明CEUS指导食管和胃肿瘤活检,能获得比二维超声引导更准确的组织学结果。本研究CEUS组避开造影剂未灌注区,对造影增强区域穿刺活检,取材成功率和病理诊断符合率较常规超声组均显著提高,与付静等[10]的研究结果一致。
3.3 胃肠道SMT的CEUS增强模式分析 CEUS通过观察肿瘤内造影增强模式,初步判断肿瘤的性质,精准引导靶向穿刺,获得的病理学结果与手术病理学结果更加吻合[15]。本研究间质瘤CEUS增强模式表现为以非均匀性、向心性强化、多见未灌注区,部分研究认为该增强模式提示间质瘤为高危的敏感度较高、特异度低[16],而均匀性、弥漫性增强、少见未灌注区则提示为低危的敏感度和特异度均较高[17]。本组淋巴瘤CEUS增强模式呈均匀性、弥漫性强化,未灌注区少见,与Cui等[18]的报道一致。王妍洁等[19]研究腹膜后淋巴瘤CEUS出现“暴风雪样”表现,即弥漫性分布的均匀增强,推测与淋巴瘤组织新生小动脉的过度灌注有关。本研究中7例经病理学证实为弥漫性大B细胞性淋巴瘤的造影延迟期呈“网格样”改变,该表现是CEUS诊断此类淋巴瘤的重要依据。胃肠道转移瘤由于其原发肿瘤起源不同,导致CEUS增强模式不尽相同,卵巢转移瘤表现为离心性增强,而睾丸转移瘤为向心性增强、可见未灌注区。本组其余病例数较少,造影增强模式有待进一步研究。联合CEUS增强模式与穿刺病理学结果综合判断肿瘤的分期及危险度,对需内科放化疗治疗的胃肠道SMT显得尤为重要。
3.4 穿刺活检的并发症和经验总结 本研究中1例术后穿刺部位少量出血,局部加压0.5 h,注射造影剂未探及活动性出血。CEUS不但能指导穿刺,还能有效辨别术后活动性出血,以便及时对症治疗。针道种植转移罕见报道,谭雷等[20]研究认为利用同轴套管针配合活检针穿刺取材,避免了重复穿刺,且降低了针道转移及组织损伤的风险。本研究总结了CEUS引导下胃肠道SMT穿刺活检的经验:①选择CEUS瘤体内高增强且无粗大血管部位穿刺;②瘤体较小时尽量沿胃肠腔壁长轴取材,必要时选用半自动活检枪,避免穿入胃肠腔或切割胃肠壁;③进针时加压可固定病灶,且推挤周围肠管避免肠气干扰;④术中及术后24 h保留静脉通道,必要时通过CEUS寻找活动性出血点。本研究的局限性在于总样本量偏少,且以间质瘤和淋巴瘤多见,因此,造影增强模式分析有待进一步研究。
总之,CEUS能清晰地显示胃肠道SMT内液化坏死区范围及其位置,动态引导对增强区域进行精准化穿刺提高了穿刺取材的成功率和病理诊断符合率,对术前定性诊断、指导治疗方案的选择具有一定的临床应用价值。
