应用超声心动图应变分析鉴别心脏淀粉样变与高血压左心室肥厚
2022-09-14王智杨颖孟令超杜康范芳芳龚艳君马为袁云丁文惠
王智,杨颖,孟令超,杜康,范芳芳,龚艳君,马为*,袁云,丁文惠
1.北京大学第一医院心血管内科,北京 100034;2.北京大学第一医院心血管疾病研究所超声心动图中心实验室,北京 100034;3.北京大学第一医院神经内科,北京 100034;*通信作者 马为 kmmawei@sina.com
心脏淀粉样变(cardiac amyloidosis,CA)是一种浸润性心肌病,分为轻链型(amyloidosis light chain,AL)、转甲状腺素蛋白型(amyloidosis transthyretin,ATTR)及其他类型[1-3]。本病发病率低、症状多样,早期误诊率高[4]。近年来,ATTR型和AL型CA的治疗有新进展,对诊断提出了更高要求[5-7]。超声心动图是发现CA的重要手段,但传统参数鉴别CA与其他拟态疾病(如高血压左心室肥厚、肥厚型心肌病等)存在不足[8-10]。应变指心肌纤维随心动周期的形变程度,可以更早地发现心脏受损并进行定量分析[11]。既往研究发现CA患者左心室长轴应变减低,且心尖相对保留,左心房和右心室应变减低[12-13]。目前国内对ATTR型CA的认识尚处于初步阶段,仅有少数研究涉及其临床表现与影像特征[14-16],尚缺乏对我国ATTR型CA患者超声应变的分析。本研究拟比较CA与高血压左心室肥厚患者传统超声心动图参数和应变的区别,建立联合两种参数的鉴别模型。
1 资料与方法
1.1 研究对象 回顾性选取2014年8月—2021年8月于北京大学第一医院就诊的CA患者40例,其中AL型20例,ATTR型20例。纳入标准:①年龄≥18岁;②经临床、活检和影像诊断为CA,超声心动图提示左心室壁增厚(室间隔或左心室后壁≥12 mm);③心肌肥厚无法用CA以外的病因解释。排除标准:①合并其他浸润性心肌病,如结节病等;②图像质量差,无法分析。所有AL型和17例ATTR型CA患者具备阳性组织活检(包括神经肌肉、骨髓、肾脏等)。其余3例ATTR型患者心脏外组织活检阴性,拒绝行心内膜活检,诊断依据为99Tcm-PYP显像3级阳性,并除外AL(血尿免疫固定电泳、血游离轻链未见异常)。所有ATTR患者均有甲状腺素转运蛋白基因突变。另选取同时期就诊的20例高血压左心室肥厚患者作为对照组,男15例,女5例,平均年龄(59.8±18.3)岁,年龄、性别与研究组匹配。高血压左心室肥厚患者定义为存在超过1年未良好控制的高血压病史,超声心动图提示左心室壁增厚,同时没有主动脉瓣狭窄、肥厚型心肌病以及浸润性心肌病的表现。典型CA与高血压左心室肥厚患者的超声心动图见图1、2。本研究通过北京大学第一医院伦理委员会批准(批件号2022-研001)。

图1 CA超声心动图图像
图2 高血压左心室肥厚超声心动图图像
1.2 临床资料 通过病案系统记录患者年龄、性别、有无冠心病、就诊时的身高、体重,计算体重指数,并通过Stevenson公式[17]计算体表面积。记录就诊时血压、肌酐和生物标志物(钠尿肽、心肌肌钙蛋白I和肌酸激酶同工酶)水平,并通过CKD-EPI公式估测肾小球滤过率[18]。
1.3 超声心动图 超声心动图从常规临床诊疗的数据库中获取,由不同操作者通过商业可及的超声心动图系统(GE Vivid E95 &E9,Philips IE33 &EPIQ7C)留取图像,探头为M5S(Vivid E9)、M5Sc-D(Vivid E95)、X5-1和S5-1(IE33和EPIQ7C),图像帧频≥50 FPS,导出Dicom文件统一分析。所有房室内径、左心室收缩与舒张功能评价、多普勒测量均按照行业协会最新指南进行。将左心房容积、左心房容积指数、左心室质量指数(Deiereux公式)、室间隔厚度和左心室后壁厚度、左心室收缩末期内径和舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室射血分数(left ventricular ejection fraction,LVEF,Teich法)、二尖瓣口E峰、A峰、E峰减速时间、间隔组织多普勒E',通过三尖瓣反流估测肺动脉收缩压,是否存在心肌颗粒样回声增强及右心室壁增厚(剑下切面测量右心室游离壁>0.5 mm)等传统超声心动图参数进行测量和统计。
1.4 应变分析 由2位经验丰富的超声医师应用speckle-tracking方法和Tomtec软件进行分析,2位测量者采用盲法独立测量。左心室整体长轴应变(global longitudinal strain,GLS)由心尖两腔心、三腔心和四腔心切面分别测量后取平均值。GLS的相对心尖保留(relative apical sparing pattern,RASP)由心尖GLS平均值/[(中段GLS+基底段GLS)/2]计算得出。左心房应变由心尖四腔心切面分析得出,并根据时相分为左心房储存期(left atrial reservoir,LASr)、左心房管道期(left atrial conduit,LAScd)和左心房辅泵期应变(left atrial contractile,LASct)。右心室应变亦由心尖四腔心切面分析得出,根据部位分为右心室四腔应变(right ventricular 4 chamber,RV4C)和右心室游离壁应变(right ventricular free wall,RVFW)。应变测量见图3、4。

图3 左心室应变测量

图4 左心房及右心室应变测量。A:左心房应变测量;B:右心室应变测量
1.5 可重复性评价 为评估观察者内和观察者间的差异,2位医师随机选取10例患者进行应变分析,变异率通过组内相关系数(ICC)呈现。
1.6 统计学分析 采用易侕软件(X&Y Solutions,Inc.Boston,MA)和R 3.4.3(http://www.R-project.org)进行统计分析。符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布者以M(Q1,Q3)表示,组间比较采用Mann-Whitney检验。计数资料组间比较采用χ2检验;观察者间和观察者内测量的一致性采用ICC进行评价。应用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归建立两种疾病鉴别诊断模型,通过受试者工作特征(ROC)曲线下面积(AUC)评价模型。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 对照组基线体重指数、体表面积和血压显著高于CA患者,而CA患者心脏生物标志物(钠尿肽、心肌肌钙蛋白I和肌酸激酶同工酶)显著高于高血压左心室肥厚患者(P均<0.001),见表1。

表1 CA患者与高血压左心室肥厚患者的基线情况比较
2.2 传统超声心动图参数 对照组LVEDD和LVEF高于CA组,但两组均在正常范围。CA组室间隔厚度和左心室后壁厚度、左心室质量指数显著高于对照组(P均<0.01),两组左心房容积指数、E峰和肺动脉收缩压差异无统计学意义(P均>0.05),CA组的A峰和E'更低,相应的E/A和E/E'更高。传统CA特异性指标中,CA组出现颗粒样回声增强和右心室肥厚的比例远高于对照组(P均<0.001),见表2。

表2 CA患者与高血压左心室肥厚患者的传统超声心动图参数比较
2.3 超声心动图应变参数 通过计算左心室不同节段GLS的比值判断是否存在心尖保留模式,结果发现CA患者左心室GLS、LASr和LASct均较对照组显著减低(P均<0.01),两组LAScd、右心室应变(RVFW、RV4C)差异无统计学意义(P均>0.05),见表3。
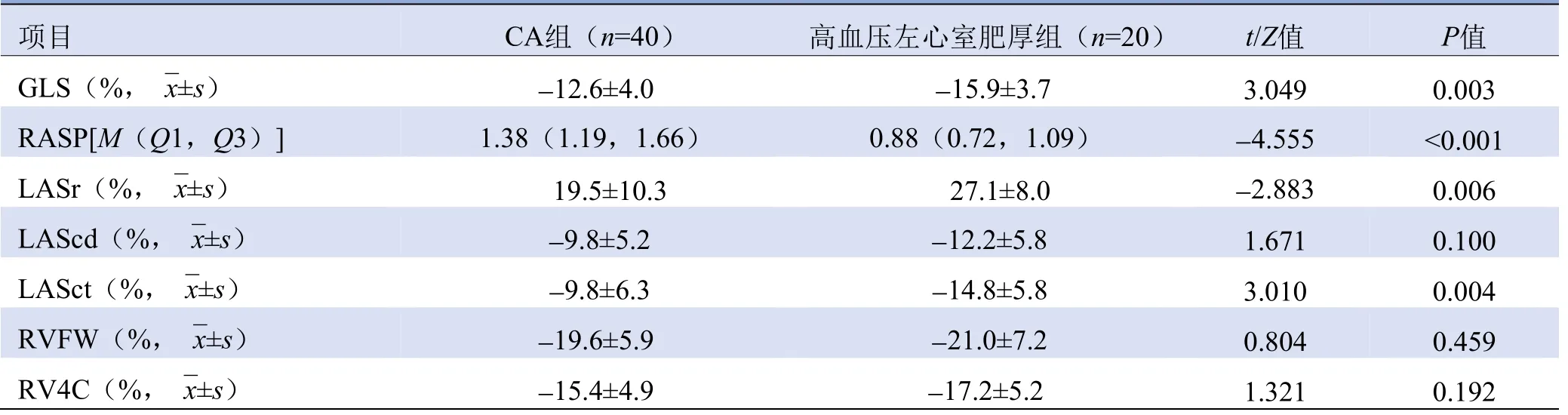
表3 两组患者的超声心动图应变参数比较
2.4 可重复性评价 本研究中所有应变评价一致性较好(ICC均>0.9)。
2.5 LASSO回归 本研究通过LASSO回归筛选出包括LVEDD、LVEF、A峰、心肌颗粒样回声增强、右心室壁增厚在内的传统参数,并建立鉴别诊断模型1。通过LASSO回归筛选出GLS和RASP两个应变参数,并与模型1一起建立鉴别诊断模型2。LASSO回归得到以下模型公式:模型1=12.810 09-0.134 71×LVEDD-0.076 50×LVEF-0.024 91×A峰+17.268 92×(心肌颗粒样回声增强=是)+18.707 51×(右心室壁增厚=是);模型2=5.756 42-0.122 96×LVEDD+0.034 67×LVEF-0.024 09×A 峰+17.878 01×(心肌颗粒样回声增强=是)+18.308 81×(右心室壁增厚=是)+0.341 24×GLS +3.767 68×RASP。本研究应用AUC评价鉴别诊断模型的有效性,得出传统超声参数模型的AUC为0.933,应变联合传统超声参数模型的AUC为0.957,应变联合模型较传统模型具有更高的敏感度(0.918 9比0.837 8)和准确度(0.928 6比0.875 0),两者的特异度均为0.947 4,见图5。
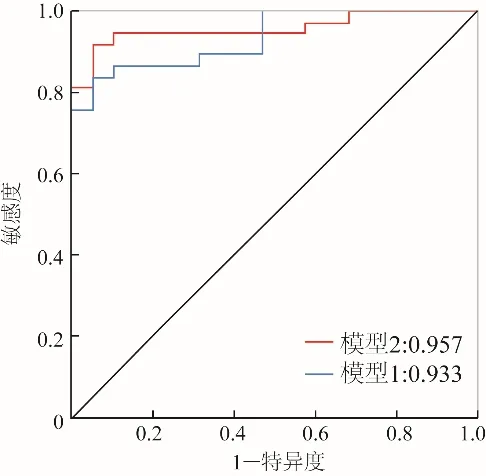
图5 超声心动图传统参数和应变参数诊断CA的ROC曲线。模型1:应用传统超声心动图参数LVEDD、LVEF、A峰、心肌颗粒样回声增强、右心室壁增厚建立的回归模型。模型2:应用模型1的传统超声心动图参数联合应变参数(GLS、RASP)建立的回归模型
3 讨论
CA是一种多系统受累罕见病,临床表现隐匿,早期易误诊。一旦心脏受累,预后急转直下[19]。超声心动图作为无创筛查,具有简便快捷等优势。传统超声心动图参数诊断CA的敏感度和特异度均有不足,超声应变为病因鉴别提供了新手段。本研究比较CA与高血压左心室肥厚患者的临床资料与超声心动图指标,纳入20例ATTR型CA患者,对我国该人群的超声应变进行分析。
3.1 两组患者基线特征与超声心动图传统指标的差异 本研究发现,CA组的心脏生物标志物(钠尿肽、心肌肌钙蛋白I和肌酸激酶同工酶)明显升高,提示该组人群心肌受累较为显著。CA患者室间隔厚度、左心室后壁厚度和左心室质量指数显著升高,对照组LVEDD和LVEF显著高于CA组,与既往研究报道CA室壁增厚但心腔正常或缩小一致[10]。在舒张功能评价中发现,两组左心房容积指数>34 ml/m2,E/A 0.8~2.0,CA组的E/E'超过14,E/A更高,A峰更低,提示舒张功能更差[20-21]。传统CA特异性指标如心肌颗粒样回声增强、右心室壁增厚在CA人群中更加突出。但是判断心肌颗粒样回声增强依赖经验,而且很难量化,右心室壁增厚在区分CA和其他右心室受累心肌病中也受限[22]。
3.2 两组患者超声心动图应变指标的差异 CA患者的左心室GLS较高血压左心室肥厚组显著减低,与前述生物标志物的趋势一致,提示心脏受累更加明显,两组LVEF均正常,因此左心室GLS比射血分数更敏感[23]。未来针对CA患者,尤其是一些仍未发病的高危人群(如基因突变携带者),能否通过GLS测量早期发现心脏受累进而干预治疗,是值得探讨的课题。
左心室GLS心尖相对保留模式在鉴别CA和高血压左心室肥厚中有重要意义[12]。尽管两组总GLS均低于正常范围,但CA患者的心尖应变相对保留,中段和基底段应变显著减低,导致RASP数值超过1,而对照组不存在这个现象。这种现象从节段分布的角度揭示了淀粉样物质在心脏沉积的规律,也为鉴别病因提供了重要依据[24-26]。本研究发现,我国包括ATTR型在内的CA患者左心室应变减低,也符合心尖保留、中段和基底减低这一重要特点,为该疾病与其他拟表型疾病的精准鉴别提供了重要依据。
CA患者的心房容易被淀粉样物质浸润,临床表现为心力衰竭、心律失常等,靠超声心动图直接发现心房壁增厚的敏感性低。心脏增强MRI检查可以发现心房壁延迟强化,但肾脏受累患者往往无法行增强MRI。心房应变为评估CA心房受累提供了新手段。既往研究发现心房应变在CA患者中显著减低,而且与不良预后相关[27]。本研究发现CA患者心房LASr和LASct减低,而LAScd与对照组差异不大,提示在淀粉样物质沉积心房的过程中,心房储存和辅泵功能更易受损,而管道功能则作为一种代偿机制存在[28]。这一现象的发现,首先为无法行心脏MRI检查的患者提供了早期发现心房受累的可能,并且提示在舒张功能不全发展过程中,心房本身存在代偿机制并通过管道功能实现。
本研究中CA患者右心室增厚的比例增加,右心室应变减低,但两组无显著差异,可能原因是右心室肌肉组织相对较少,少量淀粉样物质沉积即可导致心肌增厚;而右心室由于代偿能力强,在室壁增厚过程中,仍可保留一定的收缩和通过功能,从而使其室壁增厚和应变下降不成比例[29]。本研究右心室应变测量仅采用超声心动图四腔心切面,未来通过测定右心室三维应变及做功,能够更精准地评估右心功能[30-31]。
3.3 鉴别模型的提出 本研究应用LASSO回归建立鉴别诊断模型。联合应用传统超声心动图和应变参数的诊断效能均超过单独应用包括CA“特异性表现”在内的传统指标,提示应变分析可以更好地鉴别两种疾病[9]。本研究表明应变变化,尤其是GLS减低和心尖保留模式,是CA与其他拟心肌肥厚疾病鉴别的重要依据,如果临床无法判明病因,应考虑进行左心室GLS总体和节段应变测量,并判断是否存在心尖相对保留。
3.4 本研究的局限性 ①本研究是单中心回顾性研究,样本量小,在人群选择上可能存在偏倚;②尽管本研究纳入最易累及心脏的两种CA,但是ATTR组均为突变型患者,尚缺乏野生型ATTR人群的数据;③本研究采用心尖四腔心切面分析右心室应变,可能会影响右心室应变的测量。同时对右心室功能的评价指标较为单一,未来应考虑加入更多右心评价指标。
总之,CA患者的超声心动图GLS和心房应变(LASr、LASct)较高血压左心室肥厚患者均显著降低,CA患者的GLS减低呈现出独特的心尖相对保留模式。联合传统超声心动图参数与应变参数可以更好地鉴别CA和高血压左心室肥厚。
利益冲突 所有作者均声明不存在利益冲突
