乳腺癌肿块弹性特征及免疫组化指标预测腋窝淋巴结转移的价值
2022-09-14桑田康燕飞曹玉文董建杜婷婷李军
桑田,康燕飞,曹玉文,董建,杜婷婷,李军,3*
1.石河子大学医学院第一附属医院超声科,新疆 石河子 832008;2.石河子大学医学院病理教研室,新疆 石河子 832008;3.国家卫健委中亚高发病防治重点实验室,新疆 石河子 832008;*通信作者 李军 1287424798@qq.com
乳腺癌腋窝淋巴结状态是影响预后的重要指标,常规腋窝淋巴结清扫及前哨淋巴结活检均具有侵袭性,易引起淋巴水肿、慢性疼痛等并发症[1]。腋窝淋巴结常规超声和超声造影是筛查淋巴结良恶性的重要方法,但其结果会受医师经验的影响,且无法准确检测小的或位置较深的淋巴结[2]。超声弹性成像可以提供组织硬度的定性和定量信息,既往研究认为乳腺癌原发灶弹性评分、应变比和剪切波速度(shear wave velocity,SWV)可以作为腋窝淋巴结转移的预测参数,但目前尚存在争议[3-4]。目前对乳腺癌免疫组化指标与影像学之间关系的研究逐渐增多[5-6]。本研究拟通过单因素及多因素分析,筛选出与腋窝淋巴结转移相关的弹性超声特征及免疫组化指标,并建立联合预测模型,探讨其预测腋窝淋巴结转移的价值,以期在术前帮助超声及临床医师更好地评估及预测乳腺癌的腋窝淋巴结状态。
1 资料与方法
1.1 研究对象 回顾性收集2020年5月—2021年4月于石河子大学医学院第一附属医院行乳腺癌手术及腋窝淋巴结清扫的121例患者共134个肿块,术后获得病理结果,纳入标准:①女性;②术前行常规超声及剪切波弹性成像检查,乳腺影像报告和数据系统4类及以上;③行乳腺肿块切除术及腋窝淋巴结清扫术,获得完整的免疫组化指标;④超声检查前乳腺肿块未接受任何治疗。排除标准:①声触诊组织量化成像检查中质量模式显示中或低肿块;②术前已行放化疗或内分泌治疗的乳腺肿块;③免疫组化数据缺失;④恶病质、合并其他肿瘤或乳腺癌复发。患者年龄27~76岁,平均(52.6±9.0)岁;病灶最大直径0.6~7.5 cm,平均(2.2±1.0)cm。腋窝淋巴结转移组40个,未转移组94个。134个肿块的病理类型及腋窝淋巴结转移情况见表1。本研究经本院医学伦理委员会批准(编号:KJ2020-059-01),所有患者均签署知情同意书。

表1 乳腺癌肿块病理类型及腋窝淋巴结转移情况(个)
1.2 超声弹性成像检查 应用Siemens ACUSON S3000超声诊断仪(9L4线阵探头,频率4~9 MHz)。患者取仰卧位、侧卧位等适当体位,充分暴露双乳及腋窝,先按顺序对乳腺及腋窝区域进行常规扫查,记录病灶部位和大小,然后进行弹性检查。
首先获得肿块弹性成像图像进行弹性评分,范围从红色(最软的成分)、绿色(中间成分)到蓝色(最硬的成分)。整个肿块呈绿色为1分,肿块被绿色和蓝色的马赛克图案填充为2分,肿块周边部分绿色、中心部分蓝色为3分,整个肿块呈蓝色、但周围区域未被覆盖为4分,整个肿块及其周围区域呈蓝色为5分[7]。
然后进行声触诊组织量化成像检查,获得绿色高质量模式图像后测量SWV,取样框大小1 mm×1 mm,SWV可调节范围0.5~10.0 m/s,速度分布显示的颜色范围从高SWV(红色)、中等SWV(黄色或绿色)到低SWV(蓝色)[5]。依据取样框放置位置,记录肿块SWV最大值(SWVmax)、最小值(SWVmin)、中间值(SWVcentre)、肿块周边SWV 平均值( SWVmean )、SWVmax 与SWVmin 的比值(SWVratio1)及SWVmax与其同等深度腺体SWV的比值(SWVratio2)。收集肿块大小、部位、弹性成像评分及声触诊组织量化成像测量的速度(图1、2)。

图1 女,28岁,左侧乳腺浸润性导管癌转移。超声示肿块位于外上象限,最大径2.7 cm(A);弹性成像评分5分(B);声触诊组织量化成像示SWVmax 10.00 m/s、SWVmin 6.63 m/s、SWVcentre 8.39 m/s、SWVmean 8.38 m/s、SWVratio1 1.51、SWVratio2 3.86(C);免疫组化示ER(-)、PR(-)、HER-2(-)、Ki-67(85%+)(D~G,HE,×100)
1.3 免疫组化检查 采用罗氏全自动免疫组化仪,细胞核出现棕黄色颗粒的着色细胞数≥1%判断为雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)表达阳性[8]。以肿瘤细胞膜中出现棕色颗粒作为阳性细胞,HER-2表达分为0、+、++、+++,0和+为阴性,+++为阳性,若++则进一步行荧光原位杂交技术双探针检测,存在HER-2基因扩增为阳性,无扩增为阴性[9]。细胞核出现棕黄色颗粒的着色细胞数≥14%为Ki-67高表达,<14%为低表达[10]。
1.4 统计学方法 采用SPSS 22.0软件,符合正态分布的计量资料以±s表示,组间比较采用成组资料t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验;计数资料以例数或百分比(%)表示,组间比较采用χ2检验;采用多因素Logistic回归分析腋窝淋巴结转移的独立危险因素。应用MedCalc 15.2.0软件计算受试者工作特征(ROC)曲线下面积(AUC),采用Z检验比较单一参数与联合预测模型AUC的差异。P<0.05为差异有统计学意义。
2 结果
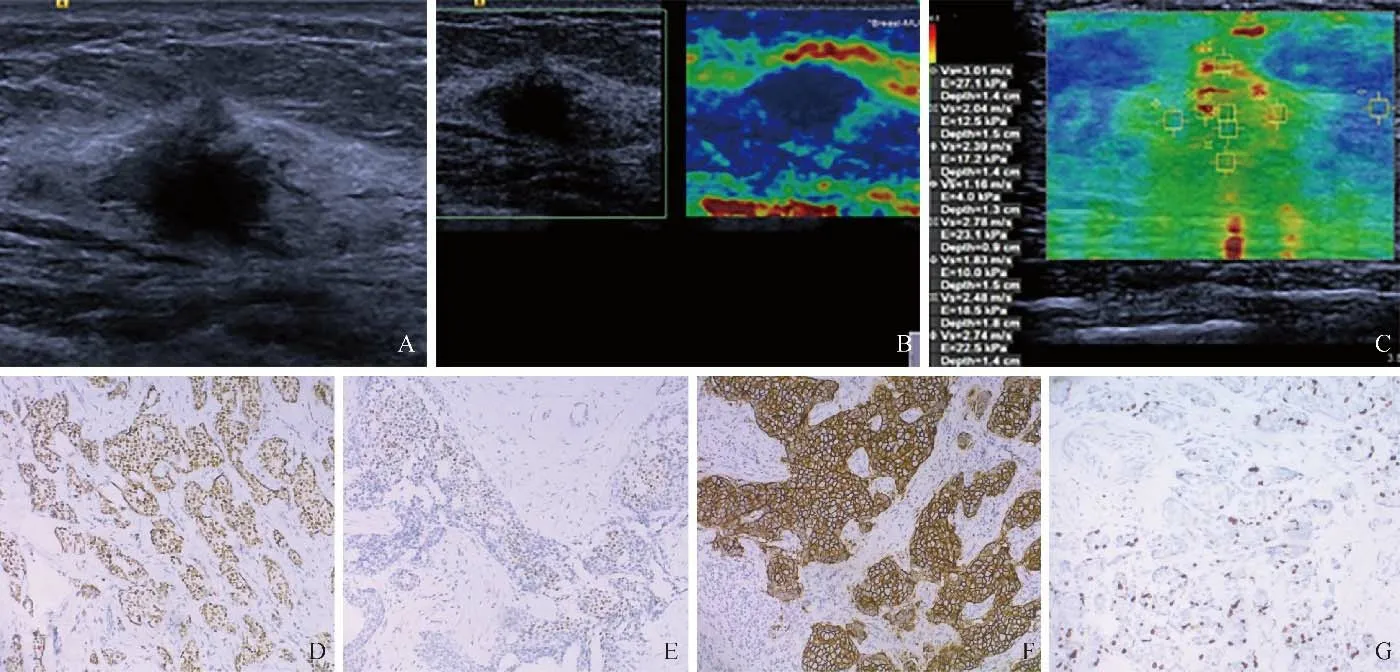
图2 女,56岁,左侧乳腺浸润性导管癌未转移。超声示肿块位于外上象限,肿块最大径2.5 cm(A);弹性成像评分4分(B);声触诊组织量化成像示SWVmax 3.01 m/s、SWVmin 2.04 m/s、SWVcentre 2.39 m/s、SWVmean 2.46 m/s、SWVratio1 1.48、SWVratio2 2.59(C);免疫组化示ER(+)、PR(+)、HER-2(+)、Ki-67(-)(D~G,HE,×100)
2.1 乳腺癌肿块超声弹性特征预测腋窝淋巴结转移的单因素分析 肿块最大径、SWVmax、SWVmean、SWVratio1及HER-2、Ki-67表达与腋窝淋巴结转移有关,差异有统计学意义(P均<0.05);年龄、SWVmin、SWVcentre、SWVratio2、肿块部位、弹性成像评分及ER、PR表达与腋窝淋巴结转移无关,差异无统计学意义(P均>0.05),见表2。
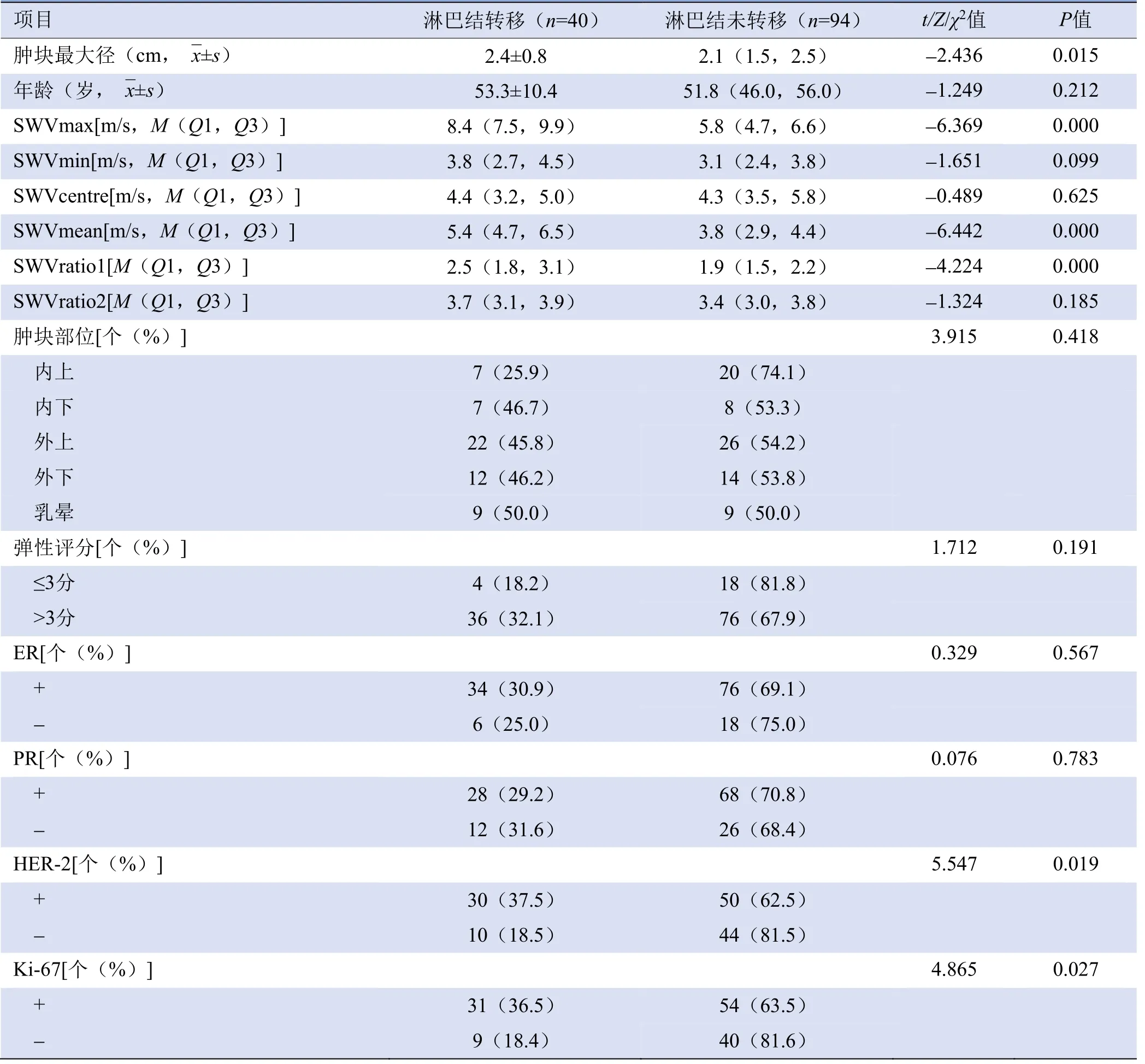
表2 乳腺癌肿块特征预测腋窝淋巴结转移的单因素分析
2.2 乳腺癌肿块超声弹性特征预测腋窝淋巴结转移的多因素分析 以单因素分析中有统计学意义的因素为自变量,腋窝淋巴结状态为因变量行二元Logistic回归分析,结果显示SWVmean、SWVratio1是预测腋窝淋巴结转移的独立危险因素(P<0.05),见表3。各肿块特征的AUC比较见表4。
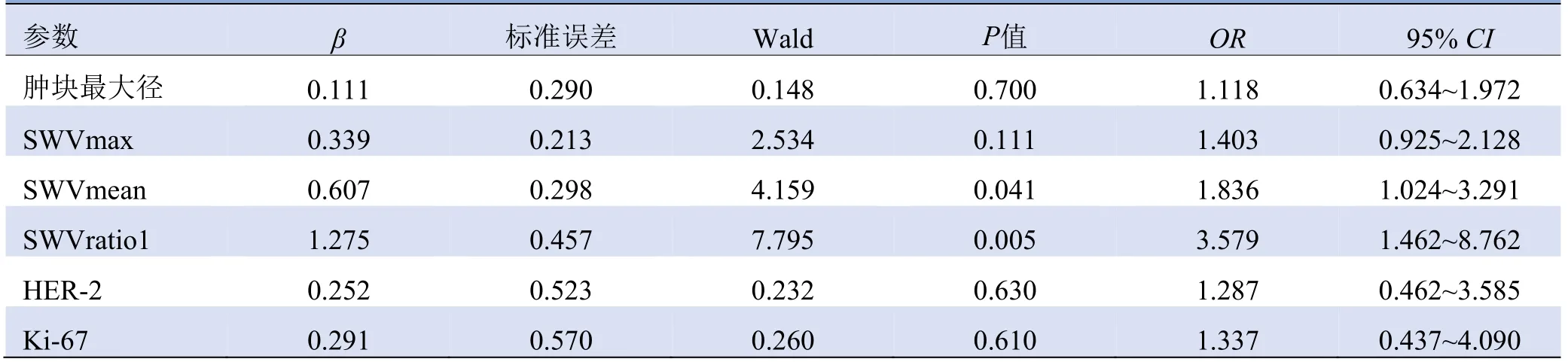
表3 乳腺癌肿块特征预测腋窝淋巴结转移的多因素分析
2.3 Logistic回归预测模型的建立及评价 建立回归方程:Logit(P)=-9.528+0.607×SWVmean+1.275×SWVratio1。ROC曲线(图3)显示预测模型的AUC均大于独立因素的AUC(Z=7.502、2.138,P<0.05),该预测模型具有较高的诊断价值,见表4。

表4 预测模型及不同参数预测乳腺癌腋窝淋巴结转移的诊断效能

图3 各指标预测乳腺癌腋窝淋巴结转移的ROC曲线
3 讨论
术前准确预测乳腺癌腋窝淋巴结状态是亟须解决的问题,越来越多的学者试图通过肿块的超声特征进行预测分析[11-12]。乳腺癌肿瘤进展伴随基质密度增加,且肿瘤发生浸润与细胞外基质重塑及硬度增加相关[4]。超声弹性技术实现了声波上的“触诊”,能够客观评价组织硬度,并通过计算机转化成更加直观的彩色图像以便观察。同时,ER、PR、HER-2及Ki-67等免疫组化指标是影响肿块恶性生物学行为及预后的重要因素,其表达情况对诊断乳腺癌及评估预后具有重要参考意义。
3.1 乳腺癌肿块弹性特征与腋窝淋巴结转移的相关性 Evans等[13]研究发现,当肿块弹性硬度值由50 kPa增加至150 kPa时,淋巴结转移率由7%升高到41%,且Emax随着乳腺癌病理组织学分级升高而增大,推测肿块的杨氏模量是预测腋窝淋巴结转移的重要指标。本研究单因素分析结果显示,乳腺肿块的SWVmax是预测腋窝淋巴结转移的有效指标,当截断值为6.56 m/s时,预测腋窝淋巴结转移的敏感度及特异度分别为87.50%、76.60%,与Zhao等[4]的研究结果相似,该研究以SWVmax 6.42 m/s为截断值,预测腋窝淋巴结转移的敏感度及特异度分别为85.7%、54.7%。体外研究表明,乳腺癌肿块侵袭和转移的发病机制与肿瘤细胞堆积和基质硬度增加有关[14],基质硬度是调节细胞生长、运动和分化的重要微环境信号,因此超声弹性图像上表现为发生腋窝淋巴结转移的肿块其SWV更大。
乳腺癌肿块边缘区域是肿块向周围组织浸润的前沿,也是乳腺癌生物学行为特征最典型的部分。本研究中SWVmean定义为肿块周边平均硬度值,单因素及多因素分析均显示肿块SWVmean在转移与未转移组间有显著差异,并最终进入预测模型。既往研究发现肿块平均整体硬度值对预测腋窝淋巴结转移具有重要意义[4]。然而整体均数易受最大值和最小值的影响,可能出现误差,因此选取周边平均硬度值进行分析可以提高准确率。乳腺肿瘤细胞向外侵袭时会引起促结缔组织反应,导致胶原蛋白交联增加和异常链接,以致周围组织硬度值增加,表现为肿块周边SWV较大。因此肿块SWVmean对预测腋窝淋巴结转移具有较高的参考价值,当截断值为4.43 m/s时,其预测转移的敏感度及特异度分别为87.50%、78.72%。臧丽等[15]应用剪切波弹性成像测量肿块硬度,并预测腋窝淋巴结转移,结果显示乳腺原发灶周边表现为高硬度彩色图像(即“硬环征”)时,肿块更容易发生腋窝淋巴结转移,进一步为肿块硬度预测淋巴结状态提供了可靠依据。
SWVratio1在本研究中定义为肿块硬度最大值与硬度最小值的比值,表现肿块内部硬度值的分布情况。结果显示,SWVratio1在预测腋窝淋巴结转移的单因素及多因素回归分析中均有统计学意义,且最终进入预测模型。SWVratio1越大,越反映出乳腺癌肿块发展的不均匀性,恶性肿瘤的微环境发生改变后,乳腺肿瘤细胞和大量活跃的间质细胞(成纤维细胞及巨噬细胞等)可分泌生长因子,既可以促进肿瘤细胞的持续增殖,又可以刺激纤维组织增生,同时也影响新生血管的生长[5]。恶性肿瘤的新陈代谢往往较旺盛,肿瘤中央多出现纤维化及硬化,表现为硬度值较高,SWV也较大;若肿块进展较快或扫查时已为晚期,则肿块内部会出现液化坏死,而硬度值与内部结构坏死呈负相关,因此表现为相关区域SWV较小。由此可见,SWVratio1比值大小能够反映恶性肿瘤的进展情况及内部结构组成,可以为预测腋窝淋巴结状态提供参考。
3.2 乳腺癌肿块大小与腋窝淋巴结转移的相关性既往研究[5,16]表明,乳腺癌肿块越大,其恶性程度及淋巴结转移的概率也越大,肿块直径大小可在一定程度上决定肿瘤的侵袭能力,肿块体积增大导致腺体受侵犯的区域扩大,腋窝淋巴结发生转移的概率随之增加。Evans等[17]研究发现,乳腺癌肿块浸润程度与肿块硬度值相关,不同大小肿瘤(10 mm、10~20 mm、20 mm)硬度值及SWV随肿块直径增大而发生较大变化,表明肿瘤内在的生物学因素可以导致肿瘤硬度变化。本研究结果认为肿块最大径>1.9 cm时更容易发生转移,与既往研究结果基本一致。
3.3 乳腺癌免疫组化指标表达与腋窝淋巴结转移的相关性 乳腺癌肿块的分子生物学表达决定其病理形态,病理形态是肿块声像图的基础,推测癌肿的分子生物学指标与超声征象存在相关性。HER-2具有酪氨酸活性,是调控细胞分裂分化的重要分子,可以促进肿瘤细胞分裂及蛋白酶水解,从而增强细胞运动能力,其高表达与乳腺癌发生、发展及腋窝淋巴结转移呈正相关[18]。Ki-67是反映乳腺肿瘤细胞增殖活性的核抗原,高表达提示肿瘤增殖速度较快,具有较强的侵袭能力。Liu等[19]认为声触诊组织量化成像检查获得的肿块平均硬度值与Ki-67表达显著相关,可以无创评估乳腺肿瘤增殖及转移。既往研究[20]表明HER-2与血管内皮生长因子呈正相关,而后者参与乳腺癌的血管生成及血管通透性调节,与肿块发生侵袭及转移有关。本研究中单因素分析发现,HER-2阳性及Ki-67高表达的肿块更容易发生淋巴结转移,尽管两者均未进入最终预测模型,但研究结果为后续进一步探讨肿块分子生物学特征与弹性特征及淋巴结转移情况奠定了基础。
3.4 研究局限性及前景 本研究为单中心研究,且样本量不够大,后续可以扩大样本量并增加超声造影相关参数进行综合分析。
总之,声触诊组织量化成像检查对预测乳腺癌肿块腋窝淋巴结转移具有良好的辅助效果,乳腺癌肿块的SWVmean、SWVratio1是预测腋窝淋巴结转移的独立危险因素,两者构建的预测模型具有较高的诊断价值。
