原发性肺黏液腺癌的CT和MRI表现
2022-09-14谢青任彤邹珏赵瑞芬
谢青,任彤,邹珏,赵瑞芬*
1.南京市胸科医院放射科,江苏 南京 210036;2.南京市胸科医院病理科,江苏 南京 210036;*通信作者 赵瑞芬 qingqing4243@sina.com
根据2015年WHO肺肿瘤分类[1],原发性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)是浸润性肺腺癌中相对独立的一种变异型,仅占肺腺癌的2%~5%,临床少见。PPMA的临床、病理及遗传特征在近年研究中有所揭示[2-5]。既往研究表明其CT表现有一定特征[6],但在临床中患者常缺乏典型临床表现,且CT表现病灶边界模糊不清而误诊为肺部感染。PET/CT显像病灶对18F-FDG摄取程度也不一致[7-8],给鉴别诊断带来困难,甚至延误治疗、发生晚期气道播散致患者预后不佳[9]。本研究回顾性分析PPMA的CT及MRI表现,提高对本病的认识。
1 资料与方法
1.1 研究对象 回顾性分析南京市胸科医院2018年1月—2020年12月经手术或肺活检病理证实的PPMA患者30例,其中男8例,女22例,年龄39~80岁,平均(60.5±13.1)岁。18例无症状;12例临床表现为咳嗽、咳痰、胸闷、胸痛,其中2例咳大量白色泡沫痰,3例痰中带血,1例伴发热。病程1周~3个月。12例初诊为肺部感染,行抗炎治疗无效后手术。30例中,28例手术切除病理确诊,1例经皮肺穿刺活检病理确诊,1例经纤维支气管镜下活检病理确诊。纳入标准:①所有患者临床均无肠黏液腺癌等肺外黏液腺癌病史;②胸部CT及MRI检查前未行抗肿瘤治疗;③CT、MRI检查间隔时间<2周。排除标准:①临床资料不完整(包括性别、年龄、既往史、CT及MRI资料);②CT、MRI图像质量差,病灶显示不清晰。本研究经本院伦理审查委员会批准(2021-KL018-01),所有患者均签署知情同意书。
1.2 检查方法
1.2.1 CT 30例患者均行胸部CT平扫,其中12例行胸部增强扫描。使用Siemens 64层螺旋CT或Philips 256层螺旋CT机。扫描参数:采用曝光剂量自动调控模式,管电压80~120 kV,管电流自动调节。螺距1.1~1.4,层厚1 mm,重建最大密度投影、多平面重建。增强扫描采用自动跟踪触发技术,使用高压注射器经肘正中静脉注入非离子型造影剂(300 mgI/ml)1.2~1.5 ml/kg,注射速度2.5 ml/s。
1.2.2 MRI 15例病灶直径>2 cm者行胸部MRI平扫,使用西门子Verio 3.0T MRI扫描仪,8通道相控阵体线圈。对所有患者行呼吸训练。扫描参数:①T1-Vibe序列:三维容积内插体部检查序列,TR 3.73 ms,TE 1.26 ms,激励次数1,层厚2 mm,视野380 mm;②T2-HASTE序列:半傅里叶采集单次激发快速自旋回波序列,TR 1 400 ms,TE 93 ms,激励次数2,层厚5 mm,视野350 mm,矩阵225×320,轴位及冠状位扫描;③T2-space-iso序列:变角激发的高分辨率三维快速自旋回波序列,TR 2 400 ms,TE 707 ms,加速因子61,层厚1.1 mm,视野350 mm,矩阵318×320,采用自由呼吸/膈肌导航技术,经最大密度投影后处理获得三维图像。
1.3 图像分析 由2名高年资主治医师采用双盲法对所有CT和MRI图像进行回顾性分析。CT图像评价病灶形态(结节/肿块、实变)、大小、边缘情况(分叶、毛刺、血管集束征及胸膜改变),内部情况(有无空泡、支气管充气征)以及密度、强化程度;MRI图像评价病灶的T1WI、T2WI及水敏感序列的信号特征。
1.4 病理和免疫组化检查 由1名病理科副主任医师分析病理结果,观察大体标本、HE染色玻片及酶标法免疫组化玻片,包括TTF-1、CK7、CK20等。
2 结果
2.1 CT表现 30例中,26例表现为结节/肿块型(86.7%)。结节/肿块型病灶直径0.7~5.8 cm,平均(2.4±1.1)cm。16例结节/肿块与胸膜相邻,其中9例见胸膜凹陷征,2例胸膜膨隆,5例胸膜平直。8例空泡/假空洞征中5例为大空腔(空腔体积占比>50%);11例混合密度结节的磨玻璃影均位于病灶周边。26例结节/肿块的实性区平扫CT值6~63 Hu,平均(35.3±4.1)Hu,其中10例行CT增强扫描呈轻、中度强化。结节/肿块的具体特征见表1和图1、2。
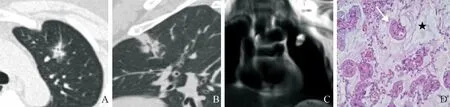
图1 女,46岁,中分化黏液腺癌。A.CT肺窗示左上叶前段结节,边缘模糊,内见空泡征,灶周见磨玻璃影;B.结节内见细支气管充气征;C.MRI冠状位结节T2WI呈明显高信号;D.病理镜下示黏液湖(星号)内见漂浮的肿瘤细胞巢(箭,HE,×100)

表1 结节/肿块型黏液腺癌的CT特征
30例中,4例(13.3%)为实变型,其中段性实变3 例,大叶性实变1 例。4 例实变病灶平均CT值(38.2±2.4)Hu。4例实变周围均可见多发斑片状磨玻璃影,边缘模糊,3例实变内见支气管充气征。CT增强扫描的2例均可见血管造影征,见图3。

图2 男,69岁,中低分化黏液腺癌。A.CT肺窗示左下叶前基底段肿块边缘较光整;B.CT增强扫描冠状位肿块上方实性区见血管造影征,下方黏液区(星号)密度低,边缘膨隆;C.MRI冠状位示T2WI肿块实性区呈等信号,下方黏液区(星号)呈均匀高信号,与CT冠状位对应;D.病理镜下示肿瘤细胞增殖呈腺管样结构(星号),分泌大量黏液(HE,×100)

图3 女,66岁,中分化黏液腺癌。A.CT增强扫描示左下叶实变见支气管充气征及血管造影征;B.MRI示实变T2WI呈明显高信号,支气管内充满高信号黏液(箭);C.T2-space序列实变高信号(星号)与脑脊液信号一致;D.大体病理示组织呈胶冻样;E.病理镜下肿瘤细胞呈高柱状,沿肺泡壁贴壁状生长为主,肺泡腔内充满黏液(HE,×100)
2.2 MRI表现 由于肺部缺乏氢质子,为避免小病灶成像质量不佳对其信号特征的影响,本组仅对病灶直径>2 cm的15例患者行MRI扫描,图像质量均满足诊断要求。11例为结节/肿块型,4例为实变型。
11例结节/肿块型病灶呈圆形、类圆形或不规则形,边界较光整,轮廓清晰。11例T1WI均呈等信号(与同层胸壁肌肉信号相似)。4例T2WI呈均匀高信号(与同层脑脊液信号相似),4例呈均匀稍高信号,3例呈等高混杂信号、以高信号为主,局部轮廓膨隆,见图1、2。
4例实变型病灶呈段性实变3例,大叶性实变1例,轮廓清晰,体积均无明显缩小,可见支气管腔内黏液或气体潴留,近端支气管无阻塞,相邻叶间胸膜无明显收缩。T1WI呈较均匀等信号,T2WI呈大片高信号(与同层脑脊液信号相似),内见散在分布的小灶性等信号区。T2-space呈大片高信号,与脑脊液信号一致,见图3。
2.3 病理结果 本组病例单纯黏液腺癌23例,混合黏液腺癌7例(黏液腺癌成分>50%)。大体标本肉眼所见:肿瘤组织呈灰白色,4例呈胶冻样改变。病理镜下见肿瘤细胞呈高柱状或杯状,沿肺泡壁贴壁状生长为主,瘤细胞小,胞质丰富透亮,细胞异型性不明显。肺泡间隔不增宽或较为一致的轻度增宽。细胞内外黏液丰富,有时可见黏液湖中完全分离的岛状或扇贝状瘤灶。免疫组化结果:10例TTF-1表达阳性,21例CK-7表达阳性。
3 讨论
PPMA可能起源于II型肺泡上皮或Clara细胞,向支气管纤毛柱状细胞化生,再向黏液柱状细胞转化,进一步发生不典型增生和癌变。PPMA以浸润性黏液腺癌较多,黏液型原位腺癌和黏液型微浸润性腺癌临床罕见。国内尚缺少PPMA大样本临床研究。本组结节/肿块型PPMA常无症状或仅有咳嗽等非典型症状。本组中12例初诊为肺部感染,与对PPMA的影像特征缺乏足够的认识有关。
3.1 PPMA的CT表现与病理分析 根据CT形态学改变,本组病例分为结节/肿块型和实变型。结节/肿块型占比高,推测可能由于肺结节筛查广泛开展,本组病例多来源于手术患者。
结节/肿块型PPMA的CT特征:①结节/肿块可见分叶征、毛刺征、胸膜凹陷征等周围型腺癌的典型特征。PPMA毛刺细软,胸膜凹陷程度轻微,推测是由于肿瘤细胞分化相对较好,上皮间质转化少,肿瘤内黏液有一定张力,病灶收缩力较弱,与文献报道相似[10-11]。当大量黏液聚集时,甚至肿块体积增大膨隆,本组2例可见叶间胸膜膨隆下坠。②结节/肿块周围常可见磨玻璃影,本组病例中占42.3%(11/26),边界多模糊,与王康等[12]报道较一致。病理上,是由于丰富的黏液沿细支气管或肺泡间隔、肺泡孔流动漂移而形成,临床极易误诊为感染。因此定期随访若磨玻璃影不吸收,需警惕黏液腺癌。Watanabe等[13]报道结节型PPMA患者的5年总生存率和无复发生存率分别为83.3%和88.8%,早期诊断、早期手术,患者预后好。③结节/肿块可见空泡/假空洞征及细支气管充气征,与黏液腺癌的破坏力较弱有关,与解丙坤等[14]报道一致,认为空泡/假空洞征是肿瘤沿细支气管管壁浸润性生长或分泌黏液阻塞细支气管,导致远端肺泡过度充气破裂,相互融合而形成。④结节/肿块密度常低于肌肉软组织密度,本组平均CT值为(35.3±4.1)Hu,CT增强扫描可见血管造影征,与肿瘤破坏力较弱、对血管破坏较少的病理特征相吻合。
实变型PPMA的CT表现多为密度偏低的段性或大叶性实变,边界模糊不清,内见支气管充气征和血管造影征,结合既往文献[15],认为支气管充气征及血管造影征是肿瘤破坏力较低的表现,是实变型PPMA的典型CT表现,但仍需与肺黏膜相关淋巴组织淋巴瘤和肺炎相鉴别。实变周围多见磨玻璃播散灶,是由于肿瘤的大量黏液破入细胞间隙、肺泡、细支气管所致,甚至播散到对侧肺,CT表现为多灶性实变和结节,提示发生肿瘤气道播散。国外文献报道[16-17],由于肺内气道播散,与结节肿块型相比,实变型黏液腺癌生存预后更差。
3.2 PPMA的MRI表现与病理分析 “白肺征”由Gaeta等[18]于2000年首次提出。支气管内的黏液由95%~98%的水和2%~5%的糖蛋白组成,在T1WI和T2WI上有较长的弛豫时间,其信号类似于人体静态水信号(如脑脊液),在重T2水敏感序列上表现为高信号。T2-space序列为MRI水成像序列,采用可变翻转角的三维快速自旋回波序列扫描,对相对静止或缓慢流动的水有较高的敏感性。本组4例实变型病例采用T2-space序列扫描,显示4例实变信号均与脑脊液信号相同,呈典型“白肺征”,与术后肿瘤标本中含大量胶冻样黏液成分的病理特征相吻合,与文献[19]报道一致。此外,本组4例T2WI高信号实变内无明显等信号结节肿块,且近端无支气管阻塞,有助于与肺黏膜相关淋巴瘤或阻塞性肺炎鉴别。
结合相关文献[20],T2WI高信号可用于判断直肠黏液腺癌肿瘤组织的黏液成分。本研究发现结节/肿块型PPMA的T2WI多呈高或稍高信号,推测是肿瘤内黏液成分所致。本组中3例肿块内高信号黏液因重力坠积于病灶下缘且局部膨隆,与鳞癌等周围型肺癌坏死液化的高信号区往往位于瘤体中心不同。结节/肿块型黏液腺癌的MRI表现国内鲜有相关文献报道,本组病例为笔者初步尝试,有待扩大样本量,做进一步对照研究。
总之,PPMA的影像学表现有一定特征:由于肿瘤分泌大量黏液,CT呈密度偏低的结节/肿块或大片实变;由于肿瘤收缩力较差、破坏力较弱,CT表现为毛刺细软及胸膜凹陷轻微,空泡/假空洞征及支气管充气征、血管造影征多见。CT征象结合MRI“白肺征”及T2WI高信号,对早期诊断PPMA有一定的临床价值。
