光照强度和氮添加对刨花楠苗木生长与叶性状关系的影响
2022-09-14李宝银钟全林程栋梁徐朝斌邹宇星
安 凡,李宝银, 2, 3,钟全林, 2, 3,程栋梁, 2, 3,徐朝斌,邹宇星,张 雪
(1.福建师范大学地理科学学院、碳中和未来技术学院,福建 福州 350007;2.湿润亚热带山地生态国家重点实验室培育基地,福建 福州 350007;3.福建师范大学福建省植物生理生态重点实验室,福建 福州 350007)
光照与养分对植物生长具有重要影响.光是植物生长的能量来源[1],光可用性是决定森林林下苗木和幼树生长最重要的限制因素之一[2],并影响植物的形态、解剖结构和生理特征[3].植物体通常可以改变生物量分配和形态可塑性来适应光照环境的变化[4].光照强度不仅影响植物可溶性物质、光合能力,还影响固氮相关酶(如硝酸还原酶)的活性,进而影响植物N、P含量[5-6].研究表明,植物通过调整叶片形态适应不同光环境的变化,以维持其生长所需的最大光合能力[7].在弱光环境下,植物通过增加株高,增大比叶面积(SLA)、提高叶片N、P含量等形态和生理生化特征,尽可能提高对光的利用效率[8].氮(N)是植物生长发育过程中必不可少的营养物质元素[9],是植物蛋白质、核酸、叶绿素和次生代谢产物中的重要成分[10],影响着植物生长、光合生理以及能量物质的贮存等[5].当养分有效性发生变化时,植物会通过调整地上、地下生物量分配及叶片功能性状来适应外部养分环境的变化[4].有研究表明,施氮会提高叶片N含量、增大比叶面积,降低干物质含量[11],适量的氮添加会增加土壤中有效氮含量,提高植物光合及碳汇能力,促进植物生长[12],但较高的氮输入可能导致养分失衡,甚至引起土壤酸化,最终不利于植物生长[13].叶片形态和生理特征在调节植物生长发育、能量交换和营养循环中起着关键作用[14],其形态结构及养分含量均随土壤有效性养分的改变而发生适应性变化[15],叶片N和P的化学计量特征(即叶片N和P含量或N/P)部分代表了土壤中N和P的相对有效性[16].因此,研究不同光照强度和氮添加对植物生长与叶功能性状的影响,有助于认识异质生境条件及生态系统结构发生变化时植物的生存策略[17],对明确植物在不同光照环境、氮添加及其交互作用的适应机制等也具有重要的理论意义.
刨花楠(Machiluspauhoi)为我国亚热带地区优良的常绿阔叶乔木树种,生长迅速,并且树干通直,是珍贵的用材树种[18].目前对刨花楠的研究内容主要体现在其生长特性、光合生理特性、人工林培育、养分和水分调控对其生长的影响、细根及土壤微生物对苗木生长的影响等方面[19-21],但缺乏光照与氮添加复合处理对刨花楠叶片功能性状和生长的研究成果.因此,本文计划以2年生刨花楠苗木为研究对象,通过遮阴与氮添加复合处理试验,分析二者对刨花楠苗木叶性状及其生长的影响,探讨刨花楠苗期对光照强度及异质氮素环境变化的响应规律,并提出以下科学问题:(1)光照强度和氮添加如何影响刨花楠苗木生长及叶片主要功能性状?(2)光照强度和氮添加是否会影响其苗木生长性状与叶片主要功能性状间关系?研究结果可为刨花楠苗木高效培育、造林立地环境选择及人工幼林的环境调控等提供理论依据.
1 材料与方法
1.1 试验地概况
试验地位于福建省南平市顺昌县林业科技中心苗圃地(26°43′ N,117°38′ E),属中亚热带海洋性季风气候,年日照时数1 740.7 h,年平均气温为18.9 ℃,年平均降水量为1 500~1 700 mm.实验用土为顺昌县造林地的底层山地红壤,土壤全氮与全磷含量分别为0.72 mg·g-1与0.11 mg·g-1,土壤pH值为4.97.
1.2 试验材料和设计
供试苗种子来源于浙江建德(29°25′N,119°07′E),其种源地年均温为17.4 ℃,年平均降水量为1 712 mm.于2016年3月15日选取个体大小基本接近的刨花楠苗木,将其移植于装有相同质量土壤的圆形花盆进行盆栽试验.试验盆为PVC材料,其规格上口径、下口径和高度分别为32、28、30 cm.试验用土为顺昌县造林地的底层山地红壤土,每盆装土8 kg,每盆栽植1株.
在对入盆近2个月生长适应的苗木进行基径、株高和叶片及等基础数据调查后,于2016年5月20日-2016年11月20日进行光照与施氮处理实验.共设置4个处理,分别为CK(不遮阴不施氮,简称对照)、UF(不遮阴仅施氮,简称施氮)、SF(遮阴且施氮)与SU(仅遮阴不施氮,简称遮阴).每个处理设置3个重复,每个重复9盆.根据费玲[22]前期有关刨花楠最适施氮量研究结果,确定氮添加量为100 kgN·hm-2·a-1,施用的氮肥为NH4NO3,按盆内直径30 cm计算表面土层面积及其纯氮添加量,并换算成NH4NO3量(2.02 g·盆-1);用天平称取每盆将所需添加的NH4NO3量,将其溶解于10 mL蒸馏水中,并用移液枪吸取,在距盆内侧1 cm处沿盆均匀滴注1圈.遮荫处理为30%透光度,在苗木上方搭建长12 m、宽5 m、高2.5 m的金属框架结构棚,上方加盖30%透光度的遮阳网,四周不封闭,用于通风,对供试苗木进行常规水分与病虫害预防管理[23].
1.3 生长指标的测量
从2016年5月开始,每月定期测量苗木基径、株高.基径测量利用数显游标卡尺(精度0.01 mm),精确到0.01 mm;株高用卷尺进行测量,读数精确到0.01 cm,2016年11月中旬对各刨花楠苗木进行最后一次测定[23].在试验结束后,每个重复选取3株生长中等的样木,采用全株破坏取样法取样,分为叶、茎、根三部分,并放入70 ℃恒温箱中烘干至恒质量,实测其生物量,并计算各处理条件下刨花楠苗木的地下生物量/地上生物量的比例(根冠比)和叶/茎生物量比例.利用各苗木生物量与基径、苗高数据,构建苗木生物量与基径、苗高关系模型,应用该模型计算各月份基径与苗高对应的生物量,以此数据来计算刨花楠苗木生物量相对生长速率,经生物量拟合,其生物量模型为:lgM=0.706(lgD2H)-1.218 5,式中:M为刨花楠整株总生物量(g),D、H分别为基径(mm)与株高(cm)[23].
生物量相对生长速率计算公式:RGR=(lnM2-lnM1)/(t2-t1),
树高相对生长速率计算公式:RGR-H=(lnH2-lnH1)/(t2-t1),
基径相对生长速率计算公式:RGR-B=(lnB2-lnB1)/(t2-t1),
式中M1、H1、B1分别为刨花楠苗木5月(初始)测量的的生物量、株高和基径,M2、H2、B2分别为刨花楠苗木11月中旬(终期)测量的生物量、株高和基径,t1和t2分别为初始测量和最终测量的时间间隔.
根冠比= (茎生物量+叶生物量)/根生物量,
叶茎比=叶生物量/茎生物量.
1.4 叶功能性状的测定
于2016年非生长季11月中旬采样,选择长势良好,无病虫害的完整新鲜叶,每株苗木取一片新鲜叶,每个重复(共9片)混合为1个样本.将新鲜叶片放入自封袋中带回实验室,利用电子天平秤量叶片鲜质量(g),在测量叶片厚度时避开叶脉,利用数显游标卡尺(精度0.01 mm),精确到0.01 mm,在每个叶片不同位置重复测量3次,取其平均值;使用便携式叶面积仪(li-3 000c,美国)测量叶片的叶面积 、叶长和叶宽,每片测3次重复,最后将叶片放入烘箱105 ℃杀青30 min,之后调整温度至70 ℃烘干至恒质量[18].叶片C、N含量采用CHNOS元素分析仪(Elemental Analyzer Vario EL Ⅲ,德国)进行测定,P含量测定采用(H2SO4-H2O2消煮)钼锑抗比色法[19].
叶干物质含量=叶片干质量/叶片饱和鲜质量,
比叶面积=叶片面积/叶片干质量.
1.5 数据处理
在Excel中对生长和叶功能性状数据进行整理,在SPSS 22.0中对数据进行前处理,并通过正态分布检验,采用单因素方差分析(One-way ANOVA)和LSD多重比较法分析生长和叶功能性状在不同光照和养分环境下的差异(α=0.05).最后,利用Canoco 5.0对生长和功能性状进行冗余分析.利用Origin 2020软件绘图.图中数据为平均值±标准差.
2 结果
2.1 对相对生长速率的影响
与CK(不遮阴不施氮)相比,施氮显著提高了刨花楠苗木的株高、生物量和基径相对生长速率,分别增加了2.3%、10.5%和8.3%(P<0.05,图1a、b、c).遮阴显著促进了刨花楠苗木的株高、生物量和基径相对生长速率,分别增加了1.9%、9.6%和7.7%(P<0.05,图1a、b、c).在遮阴施氮处理下,刨花楠苗木的株高、生物量和基径相对生长速率分别增加了6.1%、21.1%和15%(P<0.05,图1a、b、c).
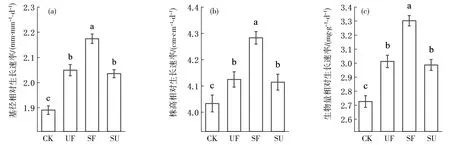
注:CK:不遮阴不施氮;UF:不遮阴仅施氮;SF:遮阴且施氮;SU:仅遮阴不施氮;不同小写字母表示不同处理间存在明显差异(P<0.05)下同图1 光氮处理对刨花楠苗木生长的影响Fig.1 Effect of light and nitrogen treatments on the growth of M.pauhoi seedlings
2.2 对生物量分配的影响
在施氮处理下,刨花楠苗木的叶茎比(LBR)显著高于CK(P<0.05,图2a).而在遮阴及遮阴施氮处理下无显著差异.与CK相比,刨花楠苗木根冠比(RBR)在施氮处理下无显著差异,而在遮阴施氮和遮阴处理下显著降低(P<0.05,图2b).
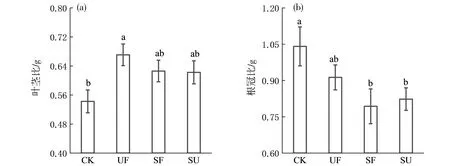
图2 光氮处理对刨花楠苗木生物量分配的影响Fig.2 Effect of light and nitrogen treatments on the biomass allocation of M.pauhoi seedlings
2.3 对叶功能性状的影响
2.3.1 对叶片氮磷化学计量特征的影响
从图3可以看出,与CK相比,施氮提高了刨花楠苗木叶片P含量(P>0.05,图3b),但无显著差异.在遮阴及遮阴施氮处理下,刨花楠苗木叶片P含量均低于CK,在遮阴施氮处理下差异显著(P<0.05,图3b),且在遮阴施氮处理下最低.刨花楠苗木叶片N含量在各处理间无显著差异(P>0.05,图3a).刨花楠苗木在遮阴及遮阴施氮处理下,叶片氮磷比显著高于CK,且在遮阴施氮处理下最大(P<0.05,图3c).施氮对刨花楠苗木叶片氮磷比无显著影响(P>0.05,图3c).
2.3.2 对叶片表型性状的影响
图4结果表明,光照和氮添加对刨花楠苗木叶片形态有不同程度的影响.在施氮处理下,刨花楠苗木的比叶面积显著低于CK(P<0.05,图4a),而在遮阴及遮阴施氮处理下无显著影响(P>0.05,图4a).与CK相比,刨花楠苗木LDMC在施氮处理下显著增加(P<0.05,图4b),在遮阴及遮阴施氮处理下无显著影响(P>0.05,图4b).在遮阴施氮和遮阴处理下,与CK相比,刨花楠苗木的叶面积显著增加(P<0.05,图4c),但在仅施氮处理下无显著影响(P>0.05,图4c).刨花楠苗木叶厚在施氮、遮阴施氮及遮阴处理下均显著高于CK,且在遮阴施氮处理下最大(P<0.05,图4d).

图3 光氮处理对刨花楠苗木叶片氮磷化学计量特征的影响Fig.3 Effect of light and nitrogen treatments on the stoichiometric characteristics of nitrogen and phosphorus in leaves of M.pauhoi seedlings

图4 光氮处理对刨花楠苗木叶性状的影响Fig.4 Effect of light and nitrogen treatments on leaf traits of M.pauhoi seedlings
2.4 对刨花楠生长与叶性状关系的影响
以刨花楠生长指标为响应变量,以叶功能性状和生物量分配为解释变量,对刨花楠苗木生长进行冗余分析.RDA(Redundancy analysis)分析中选取的变量在不遮阴不施氮、施氮、遮阴施氮和遮阴不施氮4个处理下解释度分别为43.2%、38.5%、54.4%和52.4%,前两轴的累计解释度都在99%以上,表明选取的变量可有效解释刨花楠苗木的生长.在不遮阴不施氮(对照)处理下,LA是最主要的解释变量,解释率为12.4%;根冠比是施氮处理下最主要的解释变量,解释率为13.3%;在遮阴施氮处理下,P和N和是其主要解释变量,解释率分别为23.1%、21.8%;而在遮阴处理下,P是其主要解释变量,解释率为16.57%(只选择贡献率达到显著水平的解释变量).由图5可知,在施氮处理下,RSR与RGR-H(株高相对生长速率)呈显著负相关(P<0.05);在遮阴施氮处理下,RGR(生物量相对生长速率)与N和P呈显著负相关(P<0.05);在遮阴处理下,叶片P与RGR呈显著正相关(P<0.05).
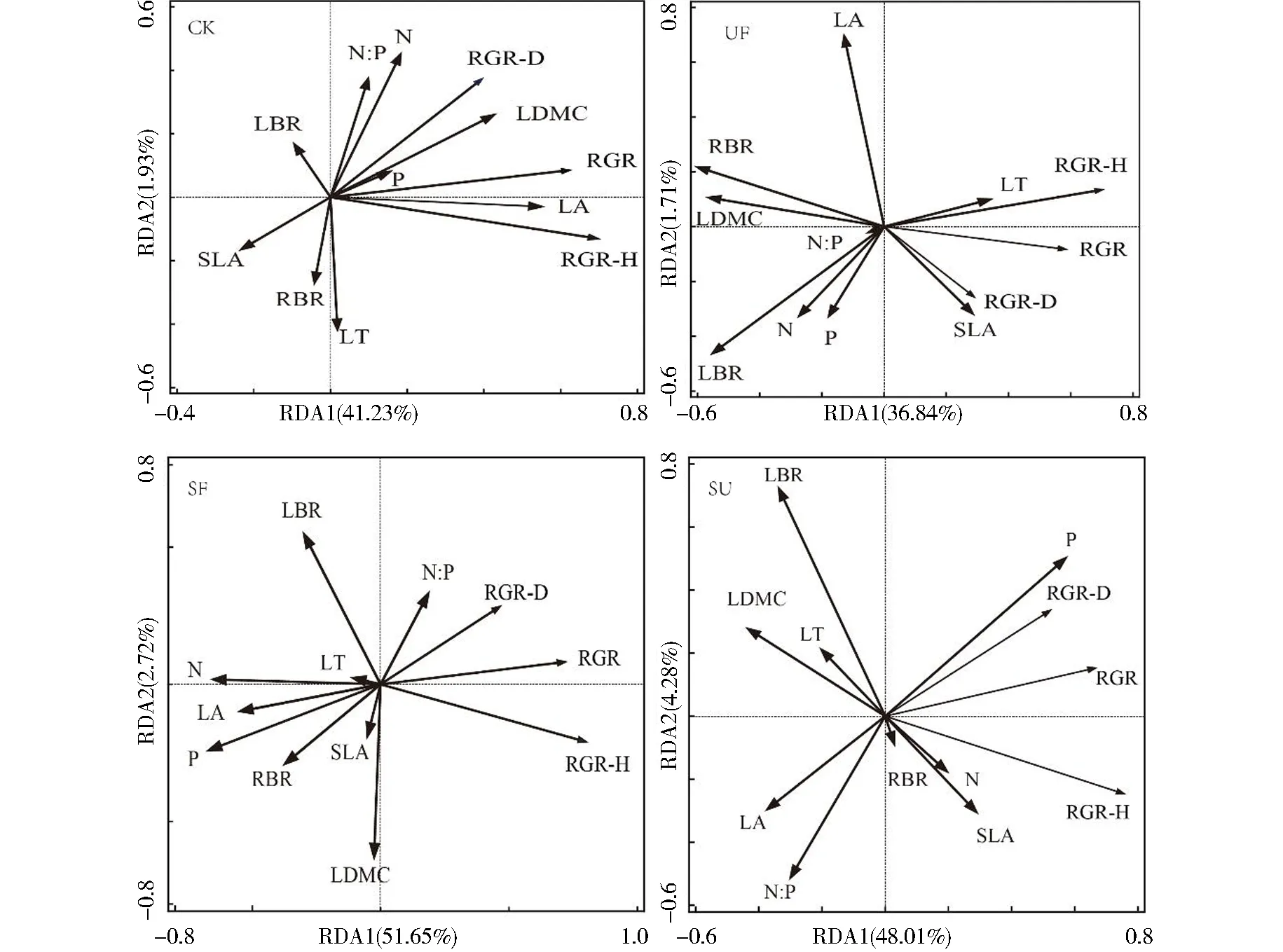
注:RGR-H:株高相对生长速率,RGR-D:基径相对生长速率,RGR-B:生物量相对生长速率,LSR:叶茎比,RSR:根冠比,SLA:比叶面积,LA:叶面积,LDMC:叶干物质含量,LT:叶厚,N:叶片氮含量,P:叶片磷含量,N∶P:叶片氮磷比图5 光氮处理对刨花楠苗木生长性状与叶性状的冗余分析Fig.5 Redundancy analysis(RDA) of light and nitrogen treatments on growth traits and leaf traits of M.pauhoiseedings
3 讨论
3.1 光照强度和氮添加对刨花楠苗木生长的影响
光照和氮素是植物生长发育的重要因子.合理调控光照和氮素在一定程度上可改善植物碳代谢,从而促进植物生长[24].氮是植物生长过程中最重要的养分限制元素[9],通过影响植物体内叶绿素、核酸和可溶性蛋白含量以及光合作用过程中的酶活性[10],使植物生长发育和形态构建发生改变[25].本研究表明,施氮显著促进刨花楠苗木的生长,其株高、基径和生物量相对生长速率均显著增加,这与林婉奇等[25]对樟树(Cinnamomumcamphora) 幼苗生长的研究结果一致.适量的氮添加可通过降低硝化菌、反硝化菌和植物对矿质氮的竞争[26],增加土壤氮素有效性,缓解森林生态系统中植物潜在的氮素限制,提高植物对土壤养分的利用效率、光合作用和碳水化合物的累积[27],从而促进植物生长.同时,氮(N)可用性是调节不同环境条件下植物生物量分配的关键因素,植物必须平衡叶、茎和根的生物量分配,以维持必要的生理活动并实现正常生长[28],本研究发现,施氮显著增加了刨花楠苗木的叶茎比,根冠比降低,但无显著差异.这与Encarna等[29]的研究结果相似,其原因可能是在氮充足的条件下,营养物质不再是植物生长的限制因子,植物通常会降低对地下部分根系的投入,增加对地上叶茎的投入,采取降低地下生物量而提高地上生物量的生态策略,这是其对不同养分条件的一种适应机制[30].
光的可获得性对植物生长发育有很大影响[31],植物捕获和利用光的能力是决定植物生长潜力的重要因素.通常在强光环境下,植物倾向于将更多的生物量分配到地下部分,以增加水分和养分的吸收;而在弱光环境下,更多生物量分配到地上部分,其特征是叶生物量增加[32],以此来增强光能捕获能力.本研究发现刨花楠苗木生物量相对生长速率随光照强度的降低显著增加,说明在低光环境下有利于刨花楠苗木生物量的累积.随着光强减弱,刨花楠苗木减少对根生物量投入,根冠比显著降低,株高增长量得到显著增加.这一现象的产生,可能是因为刨花楠苗木在弱光条件下,通过增加叶和茎生物量分配、增加株高向高空发展的生态适应策略以截获更多光能[33],增强其光合作用,最终实现生长速率、光竞争能力和生存适合度的提高[34].
在遮阴处理下,氮添加对刨花楠苗木生长和生物量积累影响极显著,且刨花楠苗木株高和生物量积累最大,光照和养分的交互作用显著影响刨花楠苗木的生长,原因可能是光照影响植物体内氮的分配和利用,氮素反过来促进叶片生长而捕获更多光能,导致光和氮协同互作对植物生长发育产生影响[35].
3.2 光照强度和氮添加对刨花楠苗木叶片性状的影响
植物叶片形态、生理和发育性状的可塑性可反映其对各种环境变化的适应能力[36].相关研究表明,氮添加导致叶片SLA显著增大,因为氮添加促进植物生物量的积累,从而增强叶片光合作用[27].然而,也有与之相反的结论,Tatarko等[37]对草原51个物种水平叶片功能性状的影响研究发现,氮添加显著影响群落加权性状,群落内物种的SLA显著减少,而LDMC显著增大;肖迪等[38]研究也表明,在氮添加处理下,茶条枫(Acerginnala)和玉竹(Polygonatumodoratum)的SLA呈显著减小趋势,油松(Pinustabuliformis)和玉竹LDMC显著增大.SLA和LDMA作为植物叶片功能性状的两个重要指标[4],是反映植物获取和利用资源能力的关键性状[39].资源获取方面,Jager等[40]认为低SLA和高LDMA的植物采取保守的资源利用策略.本研究结果表明,施氮显著降低了刨花楠苗木叶片的SLA,LDMC显著增大,这与上述肖迪等研究结果一致.低SLA、高LDMC表明刨花楠在其生长过程中采取较为保守生长策略.有研究表明,具有资源节约策略物种的SLA相对较低,其原因可能是减少的比叶面积投资了水分利用效率,也可能是因为对土壤环境的剧烈波动具有较高的抵抗力,随着环境变得更有利于生长,它们表现出的变化很小[41].此外,刨花楠苗木LT(叶片厚度)在施氮处理下显著增加,LT在植物生长过程中起着重要作用,并且与植物获取和利用资源的策略有着密切关系,LT增加不仅提高其对光资源的利用效率,而且增强叶片对强光的保护作用[42].刨花楠苗木在施氮处理下,增大其叶片厚度,降低刨花楠苗木体内水分流失,从而促进其生长.同时,施氮提高了刨花楠苗木的叶片N、P含量,N/P降低,但在统计学上无显著差异.
光照是植物进行光合作用和生长发育的最基本条件.叶片作为植物光合作用及最具可塑性的器官,其功能性状变化对光照的响应最为敏感.Petrita等研究表明,在低光环境下,山毛榉(Fagus)的LA和SLA显著增加[43].这与本研究结果一致,遮阴显著提高了刨花楠苗木的LA.一般强光下叶面积减少是植物为避免损伤而采取的生存策略[44],而在弱光环境下,植物通过增大叶面积和比叶面积,扩大受光面积来增强叶片细胞对弱光辐射的捕获能力,提高光能利用效率[6-7],补偿较低光量子通量密度造成的光合速率下降,尽可能保证一定的光合能力[34],促进植物生长.同时,刨花楠叶片N含量增加,叶片P含量减少,但无显著差异,叶片N/P在遮阴处理下显著升高.这可能是因为光照强度的降低使枝条快速生长,更多光线被叶子吸收,植物通过增加叶片氮含量,增强净光合速率[31],同时植物体生长相对减缓,叶片内限制磷含量的核糖体特别是对磷的需求降低,因此叶片P含量降低,造成N/P比升高.
在光、氮交互作用下,刨花楠苗木叶片P含量显著低于对照,叶片N/P显著高于对照.有研究表明植物中的营养元素受植物大小和生物量的增加会引起稀释效应[45],叶片中的元素含量会随植物个体的发育而降低[46].在本研究中,稀释效应对叶片P含量有显著影响,在遮阴氮添加处理下刨花楠苗木生物量增长速率较高,生物量“稀释效应”明显[47],刨花楠苗木叶片磷浓度显著降低,N/P升高.同时,刨花楠苗木LA显著增加,当养分利用率高时,LA会相应地增加,以响应低光照,这与Freschet等[48]研究结果一致,表明在低光条件下,适量施用氮肥在一定程度上有助于缓解低光胁迫,促进刨花楠苗木生长.
3.3 光照强度与氮添加对刨花楠苗木生长与叶性状间关系的影响
叶片生理和形态性状反映了资源吸收和资源利用效率的策略[49],叶片对养分和光照变化的响应影响着植物生长.本研究表明,在施氮处理下,RBR与RGR-H呈显著正相关.根据最优分配理论,植物会将更多的生物量分配给能够捕获有限资源来优化植物性能的器官以响应环境变化[50],在土壤养分较低的环境中,植物分配给根部的生物量多于地上部分[48],而在养分充足的条件下,植物通常有较高的叶、茎质量分数,但有较低的根质量分数和根冠比[28].因此,根冠比会随土壤养分增加而增加,以此来促进植物的生长.在遮阴处理下,叶片P含量与RGR呈显著正相关,这与Thompson等[51]研究结果一致,一般来说有机体较高的生长速率需要大量核糖体和蛋白质合成来维持, 因此其细胞具有较多的核糖体核糖核酸(rRNA),也相应地具有较高的P含量和较低的N/P;反之,生长较慢的有机体,其P含量相对较低, N/P较高[52].本研究表明,在遮阴施氮处理下,RGR与叶片N、P呈显著负相关,本研究表明,在遮阴施氮处理下刨花楠苗木RGR-H、RGR和RGR-B(基径相对生长速率)最高,这可能是因为在养分充足及光照适宜的环境中,刨花楠苗木吸收到更多的养分以用来促进自身的生长,而不是储存在叶片中,导致其叶片P含量和N含量降低[43-44].同时,研究表明,刨花楠苗木叶功能性状的调整在应对外界环境条件发生变化时发挥重要作用,相比生物量分配, 叶片性状的调整是刨花楠苗木适应光照强度变化的主要生存策略,而生物量分配则对有效性养分变化更敏感.
4 结论
遮阴和施氮及其交互作用对刨花楠苗木生长与叶功能性状间关系具有一定的影响.遮阴和氮添加会显著影响刨花楠比叶面积、叶干物质含量及叶片N、P化学计量,遮阴后的苗木叶片磷含量与个体生物量相对生长速率呈显著正相关,但遮阴与氮添加复合处理后的苗木叶片氮磷含量则均与个体生物量相对生长速率呈显著负相关.研究表明刨花楠苗木主要通过调整根冠比、叶片P含量、SLA以及LDMC等叶功能性状来适应光照和有效性养分的变化,以维持其稳定生长.因此,今后在刨花楠苗木繁育、人工林造林地选择及低效林改造、林下补植时,应适当考虑光照强度(如通过林分结构优化等)和施肥,以提高刨花楠的生存竞争力和生产力.由于本研究为大棚模拟光强的盆栽实验,与野外林地真实自然环境可能会存在差异,因此今后还需在这方面作进一步的跟踪研究.
