感染引发急性肺损伤患者临床预后的影响因素分析
2022-09-13郝玉花唐潇潇张晓青
郝玉花 唐潇潇 张晓青
急性肺损伤(ALI)属于临床上常见的一种危急重症,具有发病率高及预后不良等特点,严重威胁患者的身心健康[1]。ALI 主要是因一系列肺内或肺外因素共同作用引发肺毛细血管内皮细胞及肺泡上皮细胞损伤,继而引起的弥漫性肺间质及肺泡水肿,其主要临床表现特征以进行性低氧血症和呼吸窘迫综合征为主[2-3]。相关研究数据显示,严重感染引发ALI 发病率在16/10 万~28/10 万,病死率高达30%~60%[4]。迄今为止,关于ALI 的具体发病机制尚未彻底阐明,血管紧张素转换酶(ACE)可直接作用于肾素-血管紧张素系统(RAS),可催化血管紧张素Ⅰ朝缩血管物质方向转化,进一步刺激血管收缩,提高血管渗透性及血管紧张素水平[5]。ACE 可能直接作用于肺RAS,进一步影响肺纤维化,最终影响ALI 发生、发展及转归[6]。然而,有关ACE 基因多态性和感染引发ALI 的预后关系研究鲜有报道。鉴于此,本文通过研究感染引发ALI 患者的临床预后与其ACE 基因多态性的相关性,旨在为临床治疗提供数据支持,现报道如下。
1 资料与方法
1.1 一般资料 选取2017 年10 月-2021 年5 月大连大学附属中山医院收治的120 例感染引发ALI 患者。纳入标准:(1)所有入组人员均符合感染引发ALI 相关诊断标准[7];(2)均为急性发病,胸片结果证实双肺斑片影;(3)病原菌培养确诊;(4)年龄>20 岁;(5)存活时间>24 h。排除标准:(1)合并心、肝、肾等脏器功能严重不全;(2)伴有严重脑血管疾病和/或血液系统疾病;(3)合并恶性肿瘤;(4)研究期间因故退出或失访;(5)伴有精神或心理障碍。男70 例,女50 例;年龄34~82 岁,平均(58.83±4.01)岁;体重指数19~32 kg/m2,平均(23.22±2.10)kg/m2;合并基础疾病:高血压27 例,糖尿病14 例,冠心病12 例。本研究经医院伦理委员会核准,患者均已签知情同意书。
1.2 方法(1)基线资料的采集。通过医院病历系统完成所有受试者基线资料的统计、记录,主要内容涵盖下述几项:①性别;②年龄;③体重指数;④合并基础疾病;⑤心率;⑥收缩压;⑦舒张压;⑧急性生理与慢性健康评分系统Ⅱ(APACHEⅡ)。(2)分组方式。对所有受试者均进行为期6 个月的随访观察,随访方式为电话随访及上门随访等,随访频率为1 次/月,随访终止事件为死亡。将其按照预后的差异分作死亡组(n=32)及存活组(n=88)。(3)ACE 基因多态性。首先采用全血基因组DNA 提取试剂盒完成全血基因组DNA 的提取,以限制性长度片段多态性聚合酶链反应(PCR)实现ACE 基因多态性(相关试剂购自美国ABI 公司)的测定。其中ACE 引物设计及合成均完成于上海生工生物工程有限公司。ACE 上游引物序列:5’-CTGGACACCACTCCCATCCTTTCT-3’;下游引物序列5’-GATGTGGCATCACATTCGTCAGAT-3’。PCR 反应体系共50 μL,包括10×PCR buffer 5 μL,BSA 2 μL,dNTP 3 μL,DNA 模板1 μL,上下游引物各1 μL,Taq 酶0.25 μL,剩余以双蒸水补足。PCR 反应条件如下:95 ℃预变性5 min,95 ℃变性45 s,59 ℃退火60 s,72 ℃延伸60 s,共35 个循环,72 ℃终末延伸10 min。扩增产物实施凝胶电泳,以溴化乙锭实施荧光染色,100 V 电压条件下电泳0.5 h,凝胶成像拍照。将DNA Marker 视为参照,选取反应条带亮度明显且无特异性扩增引物组,实施基因型分型。(4)检测血清白细胞介素-17(IL-17)及白细胞介素-33(IL-33)水平。抽取患者入院后翌日清晨空腹静脉血3 mL,离心处理获取血清,采用酶联免疫吸附法完成上述两项指标水平的检测,具体操作遵循试剂盒说明书完成。相关试剂盒选用深圳晶美生物科技有限公司产品。比较死亡组和存活组的IL-17、IL-33 水平。
1.3 统计学处理 以SPSS 22.0 软件实现对本研究数据的分析,计量资料用()表示,分析前予以正态性与方差齐性检验,呈正态分布采用t 检验;计数资料用率(%)表示,进行χ2检验。以多因素logistic 回归分析明确ALI 患者预后和相关影响因素的关系。P<0.05 为差异有统计学意义。
2 结果
2.1 两组ACE 基因多态性情况对比 死亡组ACE基因型为D/D 人数占比为68.75%,高于存活组的38.64%,而基因型为I/I 型人数占比为9.38%,低于存活组的40.91%,差异均有统计学意义(P<0.05),见表1。

表1 两组ACE基因多态性情况对比[例(%)]
2.2 两组一般资料比较 死亡组年龄及APACHEⅡ评分均高于存活组,差异均有统计学意义(P<0.05)。两组性别、体重指数、高血压、糖尿病、冠心病、心率、收缩压、舒张压比较,差异均无统计学意义(P>0.05)。见表2。

表2 两组一般资料比较
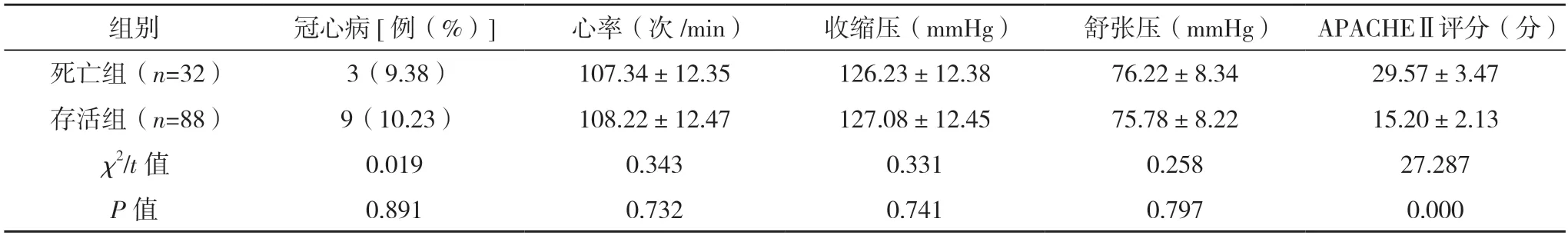
表2(续)
2.3 感染引发ALI 患者预后不良影响因素的多因素logistic 回归分析 以感染引发ALI 患者预后为应变量,赋值如下:存活=0,死亡=1。以ACE 基因多态性、年龄及APACHEⅡ评分为自变量,赋值如下:ACE 基因型为D/D 型=1,非D/D 型=0;年龄及APACHEⅡ评分均为原值输入。经多因素logistic 回归分析可得:ACE 基因型为D/D 型、年龄及APACHEⅡ评分均是感染引发ALI 患者预后不良的危险因素(P<0.05),见表3。

表3 感染引发ALI患者预后不良影响因素的多因素logistic回归分析
2.4 两组血清IL-17 及IL-33 水平比较 死亡组血清IL-17 以及IL-33 水平均高于存活组,差异均有统计学意义(P<0.05),见表4。
表4 两组血清IL-17及IL-33水平比较[ng/L,()]

表4 两组血清IL-17及IL-33水平比较[ng/L,()]
3 讨论
有研究表明,RAS 系统可通过促进血管通透性的增加,继而诱导ALI 的发生[8-9]。ACE 是一种将无效血管紧张素Ⅰ转化成血管紧张素Ⅱ,并刺激其代谢和产生生物活性肽的重要酶,广泛表达于肺上皮细胞和内皮细胞[10-11]。其中血管紧张素Ⅱ主要是通过诱导肺上皮细胞和内皮细胞的凋亡等途径,在ALI 的发生、发展过程中起着至关重要的作用[12]。ACE 可能通过调控血管紧张素Ⅱ的生成,间接参与了ALI 发病过程中的免疫机制[13]。由此推测,决定ACE 表达的相关基因多态性可能在ALI 的发生、发展、治疗效果及预后转归中扮演着至关重要的角色。人ACE 基因定位于17 号染色体上,有插入/缺失多态性特点,在不同种族人群中该基因多态性有着一定的差异[14]。目前,已有研究报道发现,ACE 基因多态性可能与食管癌术后ALI 的发生有关[15],但关于ACE 基因多态性和感染引发ALI 的转归关系罕有报道。
本研究发现,死亡组ACE 基因型为D/D 人数占比高于存活组,而基因型为I/I 型人数占比低于存活组(P<0.05)。表明经感染引发ALI 患者的临床预后和ACE 基因多态性密切相关,且经多因素logistic 回归分析可得:ACE 基因型为D/D 型是感染引发ALI 患者预后不良的危险因素(P<0.05)。这提示了感染引发ALI 患者的临床预后和ACE 基因多态性密切相关,且ACE 基因型为D/D 型患者的预后较差。原因是ACE 基因插入或缺失状态可通过影响组织或血ACE 活性,进一步对肺RAS 系统起到调控作用,实现对肺血管通透性的改变,激活凝血纤溶系统,对肺纤维化具有积极促进作用,进一步加剧了感染引起的肺损伤,最终影响ALI 患者预后转归。此外,死亡组年龄及APACHEⅡ评分均高于存活组(P<0.05)。且经多因素logistic 回归分析可得:年龄及APACHEⅡ评分均是感染引发ALI 患者预后不良的危险因素(P<0.05)。即随着年龄的增长及APACHEⅡ评分提高,感染引发ALI 患者预后越差。分析原因,随着患者年龄的不断增长,其机体免疫力和抵抗力不断下降,加之其往往合并一种或多种基础疾病,继而导致预后不良[16-17]。APACHEⅡ评分的增加往往预示患者病情加重及身体状况不佳,从而增加了临床治疗的难度,势必对预后造成负面影响。因此,在临床实际工作中应重点关注年龄较大及APACHEⅡ评分较高的患者,通过实施针对性干预,以达到改善患者预后的目的[18]。另外,死亡组血清IL-17 及IL-33 水平均高于存活组(P<0.05)。这反映了感染引发ALI 死亡患者的上述两项血清学指标水平高于存活患者。究其原因,IL-17 可通过刺激多种促炎细胞因子的产生,从而降解肺血管内皮细胞基底膜及肺间质的成分,促进炎症因子浸润及组织损害,加剧肺损伤程度[19]。IL-33 是一种促炎调控因子,可通过刺激多种非Th2 细胞因子表达,介导肺损伤的发生、发展过程[20]。
综上所述,感染引发ALI 患者的临床预后在一定程度上受ACE 基因多态性的影响,尤其是ACE基因型为D/D 型患者的预后较差。
