玉郎伞多糖通过调控Caveolin-1表达对脂多糖诱导的甲状腺滤泡上皮细胞炎症损伤和凋亡的影响
2022-09-13辛思源杨志新柳金英刘慧郭建恩
辛思源 杨志新 柳金英 刘慧 郭建恩
承德医学院(河北承德 067000)
桥本甲状腺炎又被称为慢性淋巴细胞性甲状腺炎,甲状腺滤泡上皮细胞凋亡在桥本甲状腺炎的发病机制中起重要作用[1-2]。玉郎伞多糖(Yulangsan polysaccharide,YLSPS)是玉郎伞提取物的主要活性成分之一,主要由葡萄糖和阿拉伯糖组成。研究显示,YLSPS 可保护布洛芬引起的小鼠肝损伤,其可能通过抗氧自由基损伤、抗脂质过氧化损伤以及减少炎症因子的释放发挥作用[3];YLSPS 可抑制Aβ25-35诱导神经元细胞PC12 凋亡[4]。Caveolin-1(Cav-1)位于甲状腺细胞的顶端,是甲状腺毒素多蛋白复合物的一部分,在甲状腺激素的合成和调节氧化应激中发挥重要作用,可避免细胞损伤和凋亡[5]。研究显示,Caveolin-1 在桥本甲状腺炎组织中表达降低,其可能通过抑制甲状腺滤泡细胞的自噬活性参与桥本甲状腺炎的发病过程[6];Caveolin-1 表达的降低通过促进细胞内氧化应激水平和细胞凋亡介导甲状腺上皮细胞损伤[7]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要成分,可诱发多种炎症反应和细胞凋亡,LPS 可破坏T、B 淋巴细胞对鼠甲状腺免疫蛋白的耐受,促进桥本甲状腺炎的发生[8]。本研究以人甲状腺滤泡上皮细胞Nthy-ori3-1 为研究对象,并以Caveolin-1 为切入点,探究YLSPS 对LPS 诱导的Nthy-ori3-1 细胞炎症损伤和凋亡的影响和其分子机制,以期为桥本甲状腺炎治疗药物的研发提供新途径。
1 材料与方法
1.1 细胞和试剂人甲状腺滤泡上皮细胞Nthyori3-1 购自中国科学院上海细胞库,玉郎伞饮片购自购于南宁医药公司,细胞凋亡试剂盒试剂盒均购自北京索莱宝科技有限公司,白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和单核细胞趋化蛋白1(MCP-1)试剂盒购自南京建成生物工程研究所逆转录试剂盒和PCR 试剂盒购自深圳晶美生物工程有限公司,Trizol 试剂和LipofectamineTM2000试剂盒购自美国Invitrogen 公司,Caveolin-1 过表达载体(pcDNA-Caveolin-1)、空载体(pcDNA)、Caveolin-1 小干扰RNA(si-Caveolin-1)、乱序无意义阴性序列(si-NC)及PCR 引物均购自广州锐博生物科技有限公司,兔抗人Caveolin1、B 淋巴细胞瘤-2(Bcl-2)、B 淋巴细胞瘤-2 相关蛋白(Bax)和甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体均购自美国Santa Cruz 公司。
1.2 方法
1.2.1 YLSPS的制备参照文献方法提取YLSPS[9]。
1.2.2 细胞培养和转染复苏Nthy-ori3-1 细胞,用含10 % FBS 的RPMI 1640 培养基培养,培养条件为温度37 ℃,CO2体积分数5%,湿度97%。每2~3 d 更换1 次新鲜培养基。当细胞生长密度至80%~90%时,预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞,0.25 %胰蛋白酶消化,按照1∶3 比例进行传代培养。对数生长期的Nthy-ori3-1 细胞调整浓度为2.5 × 104个/mL,每孔2.5 mL 以每孔1 × 105个细胞。当细胞生长密度至60%时,参照LipofectamineTM2000 试剂盒说明书进行细胞转染。转染6 h 后,换为含10%FBS 的培养基。继续培养24 h 后,胰蛋白酶消化,收集细胞用于后续实验。
1.2.3 细胞分组处理细胞调整浓度为2.5 × 104个/mL,每孔1.0 mL 接种于24 孔板中。未转染的Nthy-ori3-1 细胞分为对照组(Con 组)、LPS 组、LPS+YLSPS-L 组、LPS+YLSPS-M 组和LPS+YLSPS-H 组。Con 组细胞常规培养;LPS 组细胞用含10 ng/mL LPS 的培养基培养24 h;LPS+YLSPS-L 组、LPS+YLSPS-M 组和LPS+YLSPS-H 组细胞分别用含0.01、0.1、1.0 μg/mL YLSPS 与10 ng/mL LPS 的培养基共同培养24 h。转染pcDNA、pcDNA-Caveolin-1 的细胞用含10 ng/mL LPS 的培养基培养24 h,记为LPS+pcDNA 组和LPS+pcDNA-Caveolin-1 组。转染si-NC、si-Caveolin-1 的细胞用含1.0 μg/mL YLSPS 与10 ng/mL LPS 的培养基共同培养24 h,记为LPS+YLSPS+si-NC 组 和LPS+YLSPS+si-Caveolin-1 组。每组均设置3 个复孔。实验重复3 次。培养结束后,收集细胞进行检测。
1.2.4 MTT 法检测YLSPS 对Nthy-ori3-1 细胞活性的影响收集Con 组、YLSPS-L 组、YLSPS-M 组、YLSPS-H 组Nthy-ori3-1 细胞,0.25%胰蛋白酶消化,加入培养基制备单细胞悬液接种于96 孔板(150 μL/孔),每组设置3个复孔,各组转染48 h时,每孔加入质量浓度为5 mg/mL 的MTT 溶液20 μL,置于37 ℃、体积分数5%CO2培养箱继续培养4 h,室温条件下经1 300 r/min 转速离心5 min,弃上清,每孔加入150 μL DMSO,避光振荡孵育5 min,应用酶标仪检测各孔吸光度值。
1.2.5 酶联免疫吸附法检测细胞中IL-1β、IL-6 和MCP-1 表达加入细胞裂解液,充分裂解各组培养后的细胞,3 500 r/min 离心10 min,收集上清液-20 ℃保存备用。分别参照IL-1β、IL-6和MCP-1试剂盒说明书,检测上清中其表达水平。
1.2.6 流式细胞仪检测细胞凋亡各组培养后的细胞使用PBS 清洗2 次,1 000 r/min 离心5 min,吸弃PBS。加入500 μL 结合缓冲液,重悬细胞。加入10 μL Annexin V-FITC,混合均匀后,室温避光孵育10 min。再加入5 μL PI,混合均匀,室温避光孵育5 min,流式细胞仪检测。
1.2.7 RT-qPCR 检测Caveolin-1 mRNA 表达 Trizol 试剂提取细胞中总RNA,微量核酸仪检测其浓度和纯度。参照逆转录试剂盒说明书,将RNA逆转录为cDNA。然后以cDNA 为模板,进行PCR扩增。扩增程序:95 ℃5 min,95 ℃15 s,58 ℃30 s,72 ℃30 s,共35 个循环,2-△△Ct法计算细胞中Caveolin-1 mRNA 的相对表达水平。
1.2.8 Western Blot 法检测细胞中Bcl-2、Bax 和Caveolin-1 蛋白表达RIPA 试剂提取细胞中总蛋白,经BCA 法测定蛋白浓度后,行10 %十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳后,将分离蛋白电转移至聚偏乙烯二氟(PVDF)膜,于使用5%脱脂奶粉进行封闭,时间为1 h。分别加入Bcl-2(1∶1 000)、Bax(1∶1 000)、Caveolin-1(1∶800)和GAPDH(1∶1 000)一抗,4 ℃孵育过夜后,加入山羊抗兔二抗(1∶5 000),37 ℃孵育1 h。加入化学发光试剂,避光显影后,凝胶成像系统曝光拍照。以GAPDH 为内参,Image J 软件分析目的蛋白相对表达水平。
1.2.9 甲状腺炎模型小鼠诱导及给药分组随机选择50 只小鼠,随机分为5 组,空白对照组、模型组、低剂量YLSPS 处理组、中剂量YLSPS 处理组、高剂量YLSPS处理组。采用灌胃法,每天灌胃1次,共实验4 周。实验结束后,各组小鼠摘眼球取血0.2 mL,3 000 r/min 离心10 min,取上清液,检测IL-1β、IL-6 和MCP-1 水平。然后各组小鼠采用麻醉法处死取胰腺组织,用于后续实验研究。
1.2.10 组织形态学观察与切片制作摘下各组小鼠的甲状腺组织,将其置于分析天平中称量,计算各组小鼠甲状腺指数,然后置于显微镜下,观察各组小鼠甲状腺的体积和形态。同时,取下部分小鼠甲状腺组织,将其用于制作切片,进行HE染色。
1.2.11 小鼠胰腺组织中Caveolin-1 蛋白表达检测各组小鼠甲状腺组织中Caveolin-1 蛋白表达的检测方法同1.2.7。
1.3 统计学方法GraphPad Prism 7.0 软件分析实验数据。符合正态分布的计量资料以均数±标准差表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 YLSPS对甲状腺滤泡上皮细胞活性的影响与Con组比较(100.00±0),YLSPS-L组、YLSPS-M组、YLSPS-H 细胞活性[(99.43±9.57)、(98.36±9.74)、(97.98±8.46)]无明显变化(F=0.122,P=0.947)。
2.2 YLSPS 对LPS 诱导的甲状腺滤泡上皮细胞炎症损伤的影响与Con 组比较,LPS 组IL-1β、IL-6和MCP-1 水平均显著升高(P<0.05)。与LPS 组比较,LPS+YLSPS-L 组、LPS+YLSPS-M 组和LPS+YLSPS-H 组IL-1β、IL-6 和MCP-1 水平均显著降低(P<0.05)。见表1。
表1 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞炎症损伤的影响Tab.1 The effect of YLSPS on LPS-induced inflammatory injury of Nthy-ori3-1 cells ±s

表1 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞炎症损伤的影响Tab.1 The effect of YLSPS on LPS-induced inflammatory injury of Nthy-ori3-1 cells ±s
注:与Con 组比较,*P<0.05;与LPS 组比较,#P<0.05;与LPS+YLSPS-L 组比较,&P<0.05;与LPS+YLSPS-M 组比较,$P<0.05
分组Con组LPS组LPS+YLSPS-L组LPS+YLSPS-M组LPS+YLSPS-H组F值P值IL-1β(pg/mL)58.69±5.79 435.34±30.27*314.54±29.25#205.38±19.02#&82.07±8.62#&$504.750<0.001 IL-6(pg/mL)88.89±7.18 273.28±24.50*221.05±16.20#164.75±12.40#&108.10±1.13#&$249.387<0.001 MCP-1(pg/mL)47.27±4.25 340.83±26.24*263.52±23.03#139.95±13.54#&71.24±7.05#&$687.290<0.001
2.3 YLSPS 对LPS 诱导的甲状腺滤泡上皮细胞凋亡的影响与Con 组比较,LPS 组细胞凋亡率和Bax 蛋白水平均显著升高(P<0.05),Bcl-2 蛋白水平显著降低(P<0.05)。与LPS 组比较,LPS+YLSPS-L 组、LPS+YLSPS-M 组和LPS+YLSPS-H 组细胞凋亡率和Bax蛋白水平均显著降低(P<0.05),Bcl-2蛋白水平显著升高(P<0.05)。见图1、表2。

图1 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞凋亡的影响Fig.1 The effect of YLSPS on LPS-induced apoptosis of Nthy-ori3-1 cells
表2 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞凋亡的影响Tab.2 Effects of YLSPS on LPS-induced apoptosis of Nthy-ori3-1 cells ±s

表2 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞凋亡的影响Tab.2 Effects of YLSPS on LPS-induced apoptosis of Nthy-ori3-1 cells ±s
注:与Con 组比较,*P<0.05;与LPS 组比较,#P<0.05;与LPS+YLSPS-L 组比较,&P<0.05;与LPS+YLSPS-M 组比较,$P<0.05
分组Con组LPS组LPS+YLSPS-L组LPS+YLSPS-M组LPS+YLSPS-H组F值P值凋亡率(%)7.62±0.71 29.38±2.40*21.26±2.03#15.58±1.27#&10.98±1.05#&$255.605<0.001 Bcl-2蛋白0.59±0.05 0.14±0.02*0.25±0.03#0.37±0.03#&0.49±0.04#&$232.286<0.001 Bax蛋白0.28±0.03 0.76±0.05*0.63±0.04#0.51±0.04#&0.37±0.03#&$224.100<0.001
2.4 YLSPS 对LPS 诱导的甲状腺滤泡上皮细胞中Caveolin-1 表达的影响与Con 组比较,LPS 组Caveolin-1的mRNA蛋白水平均显著降低(P<0.05)。与LPS 组比较,LPS+YLSPS-L 组、LPS+YLSPS-M 组和LPS+YLSPS-H 组Caveolin-1 的mRNA 蛋白水 平显著升高(P<0.05)。见图2、表3。
表3 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞中Caveolin-1表达的影响Tab.3 The effect of YLSPS on the expression of Caveolin-1 in LPS-induced Nthy-ori3-1 cells ±s

表3 YLSPS 对LPS 诱导的Nthy-ori3-1 细胞中Caveolin-1表达的影响Tab.3 The effect of YLSPS on the expression of Caveolin-1 in LPS-induced Nthy-ori3-1 cells ±s
注:与Con 组比较,*P<0.05;与LPS 组比较,#P<0.05;与LPS+YLSPS-L 组比较,&P<0.05;与LPS+YLSPS-M 组比较,$P<0.05
分组Con组LPS组LPS+YLSPS-L组LPS+YLSPS-M组LPS+YLSPS-H组F值P值Caveolin-1 mRNA 1.00±0.07 0.39±0.03*0.56±0.04#0.71±0.07#&0.88±0.06#&$168.311<0.001 Caveolin-1蛋白0.69±0.06 0.23±0.02*0.35±0.03#0.46±0.04#&0.58±0.04#&$183.722<0.001

图2 Caveolin-1 蛋白表达Fig.2 Caveolin-1 protein expression
2.5 Caveolin-1 过表达对LPS 诱导的甲状腺滤泡上皮细胞炎症损伤的影响与LPS+pcDNA组比较,LPS+pcDNA-Caveolin-1 组Caveolin-1 蛋白水 平 显著升高[(0.22 ± 0.02)vs.(0.61 ± 0.06),P<0.05],IL-1β、IL-6 和MCP-1 水平均显著降低[(436.69 ±32.48)、(265.29±22.61)、(347.47±31.79)vs.(94.27± 7.56)、(122.29±11.37)、(83.70±7.08),P<0.05]。见图3。
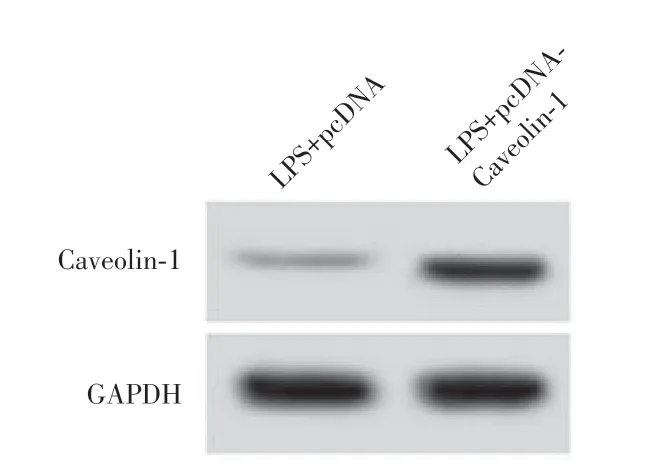
图3 Caveolin-1 蛋白表达Fig.3 Caveolin-1 protein expression
2.6 Caveolin-1 过表达对LPS 诱导的甲状腺滤泡上皮细胞凋亡的影响与LPS+pcDNA组比较,LPS+pcDNA-Caveolin-1 组细胞凋亡率和Bax 蛋白水平均显著降低[(28.75 ± 2.09)%vs.(12.98 ± 1.08)%,(0.77 ± 0.06)vs.(0.42 ± 0.04),P<0.05],Bcl-2 蛋白水平显著升高[(0.13 ± 0.02)vs.(0.41 ± 0.04),P<0.05]。见图4。
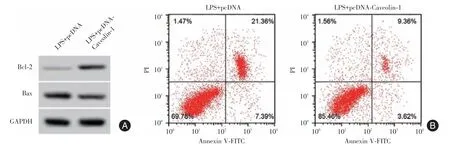
图4 Caveolin-1 过表达对LPS 诱导的Nthy-ori3-1 细胞凋亡的影响Fig.4 Effect of Caveolin-1 overexpression on LPS-induced apoptosis of Nthy-ori3-1 cells
2.7 抑制Caveolin-1 表达对YLSPS(1.0 μg/mL)作用的逆转与LPS+YLSPS+si-NC 组比较,LPS+YLSPS+si-Caveolin-1 组Caveolin-1 蛋白水平、Bcl-2蛋白水平显著降低(P<0.05),细胞凋亡率和Bax蛋白、IL-1β、IL-6 和MCP-1 水平均显著升高(P<0.05)。见图5、表4。
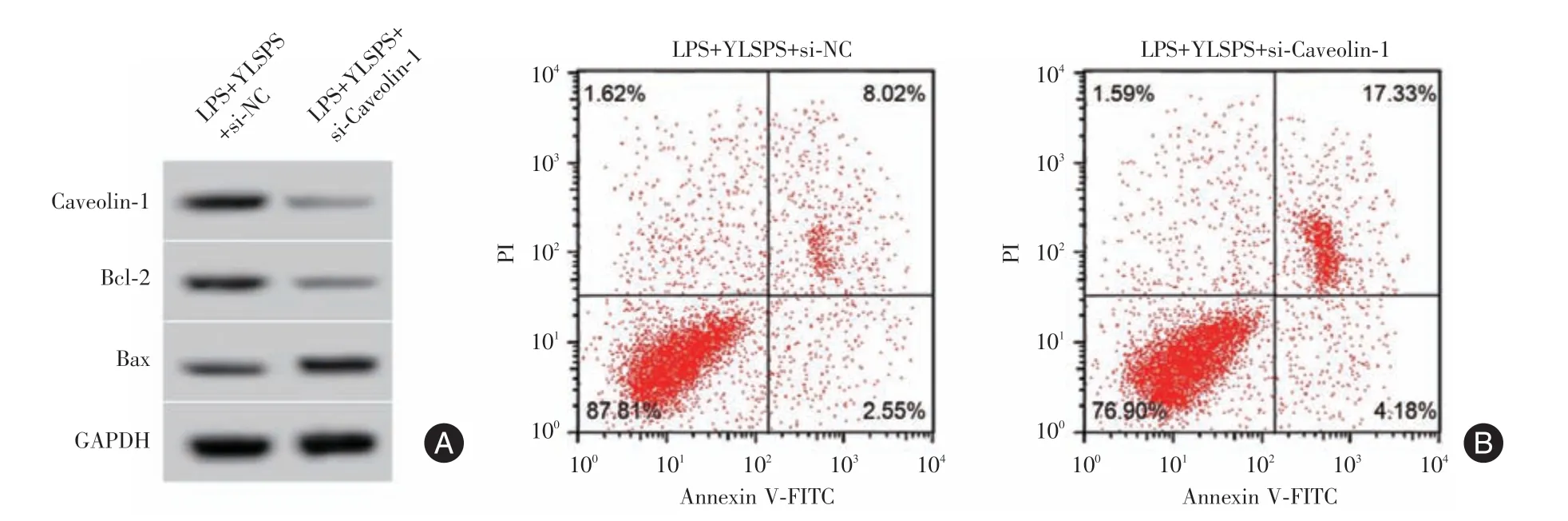
图5 抑制Caveolin-1 表达逆转YLSPS 对LPS 诱导的Nthy-ori3-1 细胞和凋亡的作用Fig.5 Inhibition of Caveolin-1 expression reverses the effect of YLSPS on LPS-induced Nthy-ori3-1 cells and apoptosis
表4 抑制Caveolin-1 表达逆转YLSPS 对LPS 诱导的Nthy-ori3-1 细胞炎症损伤和凋亡的作用Tab.4 Inhibition of Caveolin-1 expression reverses the effect of YLSPS on LPS-induced inflammatory injury and apoptosis in Nthy-ori3-1 cells ±s

表4 抑制Caveolin-1 表达逆转YLSPS 对LPS 诱导的Nthy-ori3-1 细胞炎症损伤和凋亡的作用Tab.4 Inhibition of Caveolin-1 expression reverses the effect of YLSPS on LPS-induced inflammatory injury and apoptosis in Nthy-ori3-1 cells ±s
分组LPS+YLSPS+si-NC LPS+YLSPS+si-Caveolin-1 t值P值Caveolin-1蛋白0.61±0.05 0.21±0.02 22.283<0.001 IL-1β(pg/mL)78.85±7.72 376.17±27.00 31.763<0.001 IL-6(pg/mL)92.37±7.99 240.97±18.20 22.428<0.001 MCP-1(pg/mL)67.66±6.34 291.05±22.87 28.238<0.001凋亡率(%)10.57±1.08 21.51±2.17 13.540<0.001 Bcl-2蛋白0.51±0.04 0.25±0.03 15.600<0.001 Bax 蛋白0.32±0.03 0.66±0.05 17.493<0.001
2.8 各组小鼠一般情况及甲状腺组织形态学观察(1)与空白对照组相比,模型组小鼠一般状态差、精神亢奋、易怒、毛发稀疏、无毛泽和体重增长慢;与模型组相比,YLSPS 处理后,各组小鼠状态得到明显改善,高剂量组小鼠状态接近对照组。(2)与对照组相比,模型组小鼠甲状腺体积显著增大,颜色更深;与模型组相比,YLSPS 处理后,各组小鼠状态甲状腺状态得到明显改善,高剂量组小鼠状态接近对照组。(3)空白对照组、模型组、低剂量YLSPS 组、中剂量YLSPS 组和高剂量YLSPS 组小鼠甲状腺指数为(2.565 ± 0.482)× 10-4、(5.427 ±0.391)×10-4、(4.134±0.338)×10-4、(3.502±0.481)×10-4和(2.835±0.327)×10-4。
2.9 YLSPS对各组小鼠甲状腺HE染色影响空白对照组甲状腺滤泡上皮细胞排列整齐,呈扁平状,滤泡腔光滑,泡腔内均匀充满深红色胶质。而模型组甲状腺滤泡上皮细胞显著增大,滤泡腔粗糙,泡腔内红色胶质明显减少。与模型组相比,YLSPS 处理后,甲状腺滤泡上皮细胞状态得到明显改善,且具有剂量依赖性,高剂量组与对照组接近。见图6。

图6 各组小鼠甲状腺组织(HE 染色)Fig.6 Thyroid tissue of mice in each group(HE staining)
2.10 YLSPS 对小鼠甲状腺滤泡上皮细胞炎症损伤的影响与空白对照组比较,模型组小鼠中IL-1β、IL-6 和MCP-1 水平均显著升高(P<0.05);与模型组比较,各剂量YLSPS 处理组中IL-1β、IL-6和MCP-1 水平均显著降低(P<0.05),且具有剂量依赖性,见表5。
2.11 各组小鼠甲状腺组织中Caveolin-1 表达情况与对照组比较,模型组小鼠甲状腺组织中Caveolin-1 蛋白表达水平降低(P<0.05)。与模型组比较,各剂量YLSPS 处理组小鼠甲状腺组织中Caveolin-1 蛋白表达水平升高(P<0.05),且具有剂量依赖性,见图7、表6。
表6 各组小鼠甲状腺组织中Caveolin-1 表达情况Tab.6 Expression of Caveolin-1 in thyroid tissue of mice in each group±s
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量处理组比较,&P<0.05;与中剂量处理组比较,$P<0.05
分组对照组模型组低剂量处理组中剂量处理组高剂量处理组F 值P 值Caveolin-1 mRNA 1.00±0.07 0.43±0.04*0.62±0.05#0.76±0.07#&0.91±0.06#&$148.086<0.001 Caveolin-1 蛋白0.82±0.07 0.34±0.03*0.49±0.04#0.62±0.06#&0.75±0.06#&$129.212<0.001

图7 各组小鼠甲状腺组织中Caveolin-1 蛋白的表达Fig.7 Caveolin-1 protein expression in thyroid tissues of mice in each group
3 讨论
玉郎伞是一种广西地区常用的民间草药,具有补气、补血和抗衰老等功效。玉郎伞的活性成分比较复杂,包括多糖、黄酮和皂苷类等物质[10]。研究显示,YLSPS 可通过降低血清中TGF-β 和IL-6表达、抗自由基和脂质过氧化对放射性肺损伤大鼠发挥保护作用[11];YLSP可通过增强抗氧化活性和免疫力,调节衰老相关基因的表达保护D-半乳糖诱导的大鼠氧化应激损伤和免疫功能[12];YLSPS可通过降低脂质过氧化减轻异烟肼和利福平诱导的小鼠肝损伤,具有研发为治疗肝损伤新药的潜在价值[13]。
桥本甲状腺炎是甲状腺最常见的炎症性疾病,与机体内炎症反应密切相关。IL-1β 是一种水溶性的细胞因子,可由活化的单核巨噬细胞、内皮细胞、中性粒细胞等分泌。IL-1β 在急慢性炎症、自身免疫性疾病和肿瘤中不仅能够破坏细胞完整性,促进细胞凋亡,还可通过激活下游信号通路,诱导其他炎症因子(IL-6)、趋化因子、黏附分子的表达,促进炎症的发生发展[14]。MCP-1 是机体内的重要趋化因子,参与调节肿瘤坏死因子α(TNF-α)和白三烯的释放,促进炎症反应[15-17]。本研究显示,不同浓度的YLSPS 作用于LPS 诱导的Nthy-ori3-1 细胞后,细胞中IL-1β、IL-6 和MCP-1 水平均显著降低,表明YLSPS可抑制LPS诱导的Nthyori3-1 细胞炎症损伤。
细胞凋亡是受多种基因调控的程序性死亡过程,在生物体内广泛存在。Bax 和Bcl-2 是细胞凋亡的重要调控分子,Bax 表达升高可促进细胞凋亡,而Bcl-2 表达升高则抑制细胞凋亡[18]。研究表明,细胞凋亡与桥本甲状腺炎的发生发展密切相关,桥本甲状腺炎中T 淋巴细胞及其细胞因子介导的炎症反应可诱导甲状腺滤泡细胞凋亡,最终导致腺体破坏[19]。本研究显示,YLSPS 可降低LPS诱导的Nthy-ori3-1 细胞凋亡率和Bax 蛋白表达,并促进Bcl-2 蛋白表达,说明YLSPS 可抑制LPS 诱导的Nthy-ori3-1 细胞凋亡。
Caveolin-1 定位于人染色体7q31.1,广泛表达于上皮细胞、脂肪细胞和成纤维细胞等终末细胞中。研究显示,Caveolin-1 在桥本甲状腺炎患者组织中表达降低,下调Caveolin-1 可诱导淋巴细胞浸润,其可能是桥本甲状腺炎治疗的分子靶点[20-21]。本研究结果显示,YLSPS 可促进LPS 诱导的Nthyori3-1 细胞中Caveolin-1 的mRNA 和蛋白的表达,过表达Caveolin-1 可抑制LPS 诱导的Nthy-ori3-1 细胞炎症损伤,抑制了LPS 诱导的Nthy-ori3-1 细胞凋亡。另外,抑制Caveolin-1 表达逆转了YLSPS 对LPS 诱导的Nthy-ori3-1 细胞炎症损伤和凋亡的影响,说明YLSPS 通过上调Caveolin-1 表达来抑制LPS 诱导的Nthy-ori3-1 细胞炎症损伤和凋亡。
本研究还显示YLSPS 可改善甲状腺炎模型小鼠甲状腺组织形态,降低模型小鼠血清中IL-1β、IL-6 和MCP-1 的水平,并促进模型小鼠甲状腺组织中Caveolin-1 蛋白的表达,与体外细胞实验结果一致,进一步提示YLSPS 可能通过上调Caveolin-1表达对甲状腺炎具有一定的治疗疗效,但其是否直接调控Caveolin-1 表达发挥作用还有待进一步探究。
综上所述,YLSPS可有效抑制LPS诱导的Nthyori3-1 细胞炎症因子表达和细胞凋亡,其可能通过上调细胞中Caveolin-1 表达发挥作用,具有开发为治疗甲状腺炎药物的潜在价值。
