胱硫醚-γ-裂解酶产生的H2S在小鼠脑缺血/再灌注损伤中的作用及与RhoA-ROCK2信号通路的关系
2022-09-13郭芳芳陈志武
郭芳芳,陈志武
(安徽医科大学基础医学院药理教研室,安徽 合肥 230032)
大脑是体内极其重要的器官,供应脑组织的血流量几乎占心输出量的20%[1]。缺血性脑卒中是临床上常见的脑血管疾病,其主要治疗方法是手术治疗和使用改善脑血液循环的抗血栓药物,从而恢复脑血流量的供应。而脑缺血区血液供应的恢复则可能导致脑缺血/再灌注(cerebral ischemia /reperfusion, I/R)损伤,从而可能产生更严重的脑损伤[2]。因此,寻找对脑I/R损伤具有保护作用的药物非常重要。
近十多年研究表明硫化氢(hydrogen sulfide, H2S)也是机体中一种重要的气体信号分子,具有抗炎、抗氧化、抗细胞凋亡等作用,还可通过调节离子通道活性发挥抗缺血/再灌注所引起的脑损伤[3]。内源性H2S在体内主要由胱硫醚-β-合成酶(l-cystathionine-β-synthetase, CBS),3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase, 3-MST)和胱硫醚-γ-裂解酶(l-cystathionine-γ-lyase, CSE)等三种酶产生。其中,CBS主要分布在神经细胞中;CSE主要分布在血管组织中,以血管内皮中含量最为丰富;而3-MST在各种细胞中均有分布[4]。我们以前的研究表明CSE产生的H2S对脑血管有明显的舒张作用,对脑I/R损伤可产生保护作用[5],但其确切的机制不明确。
RhoA-ROCK信号通路是细胞内一种重要的信号转导通路,与细胞的生长、分化、迁移和发育密切相关[6]。RhoA是Rho家族中的一个小GTPase蛋白。人类的RhoA由RHOA基因编码,位于3号染色体上,由一个效应结构域、四个外显子、一个高变区和一个CAAX盒基序组成(C:Cys;A:脂肪族残基;X:任何残基)。Rho相关蛋白激酶 (Rho associated protein kinase,ROCK)是RhoA最直接的下游效应分子,分为ROCK1和ROCK2两种亚型。ROCK1在几乎所有组织中普遍表达,但在大脑和骨骼肌中表达较少,而ROCK2在大脑、肌肉、心脏、肺和胎盘中的含量较高[7]。有研究表明RhoA-ROCK信号通路在血管内皮功能及血管张力的调节中发挥了重要的作用,并可能参与了I/R损伤过程[8-10],假说提示RhoA-ROCK信号通路有可能参与了CSE产生的H2S对脑I/R损伤的保护作用。因此,本文就RhoA-ROCK信号通路在小鼠脑血管CSE产生的H2S保护脑I/R损伤中的作用及机制进行了研究。
1 材料与方法
1.1 实验材料
1.1.1仪器 激光散斑血流视频监测系统,由瑞典帕瑞医学公司出品;冷冻研磨仪,由上海净信公司出品;自动组织包埋机,由德国Leica公司出品;全自动轮转切片系统,由德国Leica公司出品;全自动封闭式脱水机,由德国Leica公司出品;超速低温离心机,迪黑马(珠海)医学仪器有限公司出品;全波长酶标仪,由美国Thermo公司出品。
1.1.2药品与试剂 硫氢化钠(sodium hydrosulfide, NaHS),购自美国Sigma公司,批号为#SHBL6872V;半胱氨酸(L-Cysteine, L-Cys),购自美国Sigma公司,批号为#MKBC0049;DL-炔丙基甘氨酸(DL-ProPargylglycine, PPG),购自美国默克公司,批号为#BCBW6478;ROCK2抗体, 购自Abcam公司,批号为ab45171;ROCK2、RhoA活性试剂盒,购自江苏酶免实业有限公司, 批号分别为:1195M1,45317M1;NSE (神经特异性烯醇化酶)试剂盒,购自江苏酶免实业有限公司,批号为:0063M1;LDH乳酸脱氢酶试剂盒,购自南京建成生物工程研究所, 批号为:20210731;硫化氢(H2S)含量测定试剂盒,购自江苏菲亚生物科技有限公司, 批号为:G20210728S。
NaHS溶液的配置:使用生理盐水配置为4.8 mg·kg-1浓度的溶液,现用现配。
L-Cys溶液的配置:使用生理盐水配置为300 mg·kg-1浓度的溶液,现用现配。可置于4 ℃短时间保存。
PPG溶液的配置:使用生理盐水配置为50 mg·kg-1浓度的溶液,现用现配,可置于-20 ℃保存。
1.1.3实验动物 健康C57BL/6J小鼠(SPF级),(20~22) g,全部由河南斯克贝斯生物科技股份有限公司提供。饲养环境内通风良好,饲养温度为(22±3) ℃。实验所用动物生产许可证号为:SCXK(豫)2020-0005。
1.2 实验方法
1.2.1小鼠脑I/R模型[5]采用双侧颈总动脉结扎法建立脑I/R模型。小鼠腹腔注射4%水合氯醛麻醉后,沿颈正中切口,钝性分离出两侧颈总动脉,穿5-0号丝线于血管下备用,待两侧都分离后结扎两侧丝线,扎紧,结扎30 min后小心松开丝线并缓慢抽出,恢复血流供应,然后缝合伤口,并涂抹2%的氨苄青霉素钠。待小鼠清醒后放回笼子,正常饲养。
在造模前2 h,小鼠分别腹腔注射所需浓度NaHS、L-Cys以及PPG。实验分组为假手术组、模型组、L-Cys 组、NaHS 组、PPG组、以及PPG和L-Cys合用组。缺血后10 h各组小鼠再次分别注射同样药物,缺血后20 h时处死小鼠,取材置于-80 ℃冰箱,测量相应指标。
1.2.2脑血流量的测定[11]小鼠腹腔注射麻醉剂后,在造模前将小鼠头部皮肤剪开十字口,面积约1 cm2,分离皮下筋膜暴露头骨。将小鼠俯卧姿势置于激光散斑血流仪待测区域下,激光正中部位对准小鼠暴露的头骨部位,血流仪的高度维持在10 cm左右。结扎双侧颈总动脉前测定一次血流量,维持时间为30 s,结扎后立即测定脑血流量改变,维持时间30 s。结扎30 min后松开血管,进行再灌注过程中,自松开后一分钟开始计时,检测小鼠脑部再灌注20 min内的血流量的变化。实验结束后缝合头部,并涂抹2%的氨苄青霉素钠。按如下公式计算血流量变化率:
脑血流量变化率/%=再灌注血流量/缺血前血流量×100%
1.2.3HE染色 将小鼠处死后,小心取出完整的脑组织,浸泡于4%的多聚甲醛溶液中固定24~48 h后脱水,进行石蜡包埋,切片,封片,置于显微镜下观察海马区损伤。
1.2.4血清H2S含量和LDH活性的检测 小鼠眼眶取血,静置1 h后4 ℃下以3 000 r·min-1离心15 min,取上清液。按照试剂盒说明书步骤在665 nm波长处读取吸光值,并计算H2S含量。LDH的测定按照试剂盒步骤于667 nm处读取吸光值,并计算LDH活性。
1.2.5小鼠脑组织中NSE以及RhoA和ROCK2活性的检测 将小鼠处死后,小心取出完整的脑组织,用手术刀取下0.1 g脑组织样本,加入到预先准备好的含有900 μL的PBS溶液的离心管中,4 ℃下匀浆,5 000 r·min-1离心15 min取上清液待检。分别按照NSE、RhoA和ROCK2试剂盒说明书步骤操作,于450 nm波长处读取吸光值,并计算其活性。
1.2.6Western blot法检测ROCK2蛋白的表达 将小鼠处死后,各组脑组织裂解提取总蛋白,采用CBA试剂盒进行定量后,加入蛋白上样缓冲液 100 ℃ 煮沸10 min变性。将每组蛋白样品进行凝胶电泳,再将目的蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,TBST溶液清洗3次,4 ℃孵一抗(ROCK2:1 ∶5 000)过夜,次日用TBST洗3次,室温孵二抗(1 ∶5 000)1 h后显色,用ImageJ图像处理系统分析结果。

2 结果
2.1 L-Cys和NaHS对脑I/R小鼠的脑血流量的影响Fig 1,Tab 1结果显示,与假手术组相比,模型组在脑I/R后20 min内脑血流均有明显减少(P<0.01)。与模型组相比,L-Cys组和NaHS组小鼠脑血流量分别在再灌注5 min和10 min时就有明显的恢复(P<0.05),在20 min时基本恢复到假手术组水平(与假手术组比较,P>0.05)。CSE抑制剂PPG对脑血流没有明显的影响,但可明显地减弱L-Cys对血流量的恢复作用(P<0.05)。结果提示L-Cys可通过CSE促进脑I/R损伤小鼠脑血流量的恢复。

Fig 1 Effects of L-Cys and NaHS on cerebral blood flow after cerebral ischemia and reperfusion in mice

2.2 L-Cys和NaHS对I/R小鼠脑海马组织病理形态学变化的影响Fig 2结果显示,假手术组海马区的神经元细胞体积较大且为圆形,具有明显的核仁。细胞排列成多层,整齐而致密。然而,模型组海马区神经元或锥体细胞呈三角形或不规则形状,细胞皱缩,具有看不见的核仁和无序排列。与模型组相比,NaHS组和L-Cys组可以明显改善海马区的病理损伤,大多数神经细胞恢复正常,只有少数神经细胞皱缩,神经元坏死得到改善,正常细胞数量增加。PPG组损伤并没有改善,但PPG可以降低L-Cys的保护作用。结果表明L-Cys可通过CSE对小鼠脑海马神经元I/R损伤产生保护作用。

Fig 2 Effects of L-Cys and NaHS on pathomorphological changes of hippocampus after cerebral ischemia and reperfusion in mice (HE staining, ×200, n=5).
2.3 L-Cys和NaHS对I/R小鼠血清中H2S和LDH含量的影响Fig 3A和3B结果显示,与假手术组相比,模型组血清中H2S的含量明显降低(P<0.01),而LDH活性明显升高(P<0.05)。与模型组相比,NaHS组和L-Cys组的血清中H2S的含量均有明显的升高(P<0.05),LDH活性明显降低(P<0.05)。PPG对血清中H2S和LDH活性无明显的影响,但可明显地减弱L-Cys升高血清H2S含量和降低LDH活性的作用(P<0.05),表明L-Cys可通过CSE抑制脑I/R损伤诱导的小鼠血清中H2S的降低和LDH的升高。

Fig 3 Effects of L-Cys and NaHS on H2S content and LDH activity in serum of mice with cerebral ischemia and reperfusion n=6)
2.4 L-Cys和NaHS对I/R小鼠脑组织中NSE、RhoA和ROCK2活性的影响Fig 4A结果显示,与假手术组相比,模型组脑组织中的神经特异性的NSE含量明显降低(P<0.01)。与模型组相比,NaHS组和L-Cys组的NSE的含量有明显升高(P<0.05)。PPG对NSE的含量没有影响,但可明显减弱L-Cys抑制I/R损伤诱导的NSE含量的降低作用(P<0.05);Fig 4B和Fig 4C结果显示,与假手术组相比,模型组的脑组织中RhoA和ROCK2的活性明显升高(P<0.01)。而NaHS和L-Cys组脑组织中RhoA和ROCK2的活性低于模型组(P<0.01或P<0.05)。PPG对脑组织中RhoA和ROCK2活性无明显的影响,但可明显的减弱L-Cys抑制I/R损伤引起的RhoA和ROCK2活性的升高(P<0.01或P<0.05)。结果表明L-Cys可通过CSE降低小鼠脑I/R损伤引起的脑组织中NSE降低和RhoA和ROCK2活性升高。

2.5 L-Cys和NaHS对I/R小鼠脑组织中ROCK2蛋白表达的影响Fig 5结果显示,与假手术组相比,模型组的脑组织中ROCK2蛋白表达明显升高(P<0.05),NaHS和L-Cys可明显地降低小鼠脑I/R引起的脑组织中ROCK2蛋白的表达的升高(P<0.05)。PPG对ROCK2表达无明显影响,但可明显减弱L-Cys对I/R损伤诱导的ROCK2蛋白表达增高的降低作用(P<0.05)。结果表明,L-Cys可通过CSE抑制I/R损伤诱导的小鼠脑组织中ROCK2蛋白表达的增高。
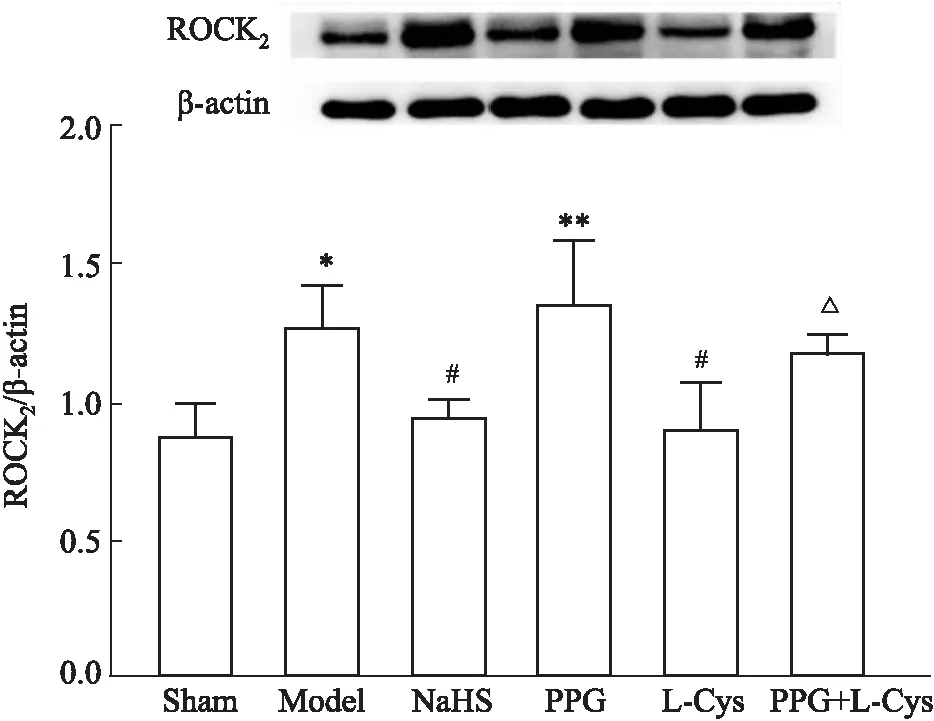
Fig 5 Effects of L-Cys and NaHS on expression of ROCK2 protein in brain tissues of mice after cerebral ischemia and reperfusion (Western blotting, n=3)
3 讨论
缺血性卒中是导致人类死亡的主要疾病之一,而愈后患者常伴有高致残率[12-13]。脑I/R 损伤的发病机制较为复杂,涉及氧自由基诱导的氧化应激损伤、谷氨酸介导的兴奋性毒性、钙离子超载和神经炎症等多种调控机制[14]。然而,临床上使用靶向这些致病因素的药物(如自由基清除剂、钙通道抑制剂和兴奋性氨基酸抑制剂)的治疗效果并不理想。因此,迫切需要开发治疗有效的药物。
H2S作为一种重要的内源性气体信号分子,也是一种血管活性物质,具有血管舒张、促进学习记忆、抗炎等多种生物学效应[15]。H2S可调节血管稳态并对脑损伤有保护作用。在大鼠大脑中动脉中,CSE酶抑制剂PPG可有效减弱H2S诱导的的血管舒张作用,而用CBS酶抑制剂氨基氧乙酸酯(AOAA)没有明显减弱H2S诱导的的血管舒张作用,表明脑血管系统中的H2S可能主要由CSE产生。本研究通过该方法发现与NaHS一样,CSE酶底物L-Cys可显著地促进小鼠脑I/R损伤后脑血流量的恢复。
在脑I/R损伤过程中,由于脑细胞的损伤,脑组织中的一些酶如LDH、NSE等可释放进入血液中,使这些酶在血清中水平升高,脑组织中水平下降。本研究表明CSE底物L-Cys可明显抑制脑I/R引起的小鼠血清中LDH活性的升高、脑组织中NSE降低及海马组织神经细胞的损伤,表明L-Cys对小鼠脑I/R损伤有明显的保护作用。本研究还发现NaHS也有相同的保护作用。
PPG是一种CSE特异性的抑制剂,本研究表明PPG本身对脑I/R小鼠脑血流量的恢复和脑损伤虽无明显的影响,但可明显减弱L-Cys促进脑血流量恢复和脑保护作用,表明L-Cys的这些作用是通过CSE产生的。结合外源性H2S供体NaHS也有促进脑I/R小鼠脑血流量恢复和脑保护作用,我们的结果表明CSE生成的H2S对小鼠脑缺血性损伤有保护作用,其机制之一可能与增加脑血流量有关,这与我们之前研究的CSE生成的H2S有脑血管舒张作用是一致的[5]。
RhoA-ROCK通路是一种细胞内重要的信号传导通路,参与了创伤性脑损伤、蛛网膜下腔出血、脊髓损伤、神经退行性疾病脑损伤后的变化,以及一些神经退行性疾病等多种神经相关疾病的病理过程[16],有望成为神经系统疾病的治疗靶点。本研究表明小鼠脑I/R明显地升高脑组织中RhoA和ROCK2活性及ROCK2蛋白的表达,CSE底物L-Cys可降低I/R损伤诱导的脑组织中RhoA和ROCK2活性及ROCK2蛋白表达的升高,但其作用可被CSE抑制剂PPG明显减弱,表明CSE产生的H2S可抑制小鼠脑I/R损伤导致的RhoA-ROCK信号通路的上调,这可能也是CSE产生的H2S发挥抗小鼠I/R损伤的机制。至于CSE产生的H2S是直接抑制脑组织中RhoA-ROCK信号通路的上调,还是继发与脑血管舒张和随后的脑血流量增加,有待于今后的进一步研究。
综上所述,CSE产生的H2S对小鼠脑I/R损伤有保护作用,其作用可能与抑制RhoA-ROCK信号通路及增加脑血流量有关。