槲皮素调控巨噬细胞胆固醇稳态改善载脂蛋白E敲除小鼠动脉粥样硬化
2022-09-14罗纲,向露,姚平,肖琳
罗 纲,向 露,姚 平,肖 琳
(中南大学湘雅公共卫生学院1.卫生毒理学系、2.营养与食品卫生学系,湖南 长沙 410078;3. 华中科技大学同济医学院公共卫生学院营养与食品卫生学系,湖北 武汉 430030)
动脉粥样硬化(atherosclerosis,AS)作为全球“头号杀手”—心血管疾病的关键病理学基础及急性发作致死、致残的幕后元凶,长期以来严重威胁人类健康。因此,针对AS主要病理生理学特点和关键生物学事件,探索新的干预措施,有望为AS的防控提出新的方向。
AS是一种慢性退行性病变,其病变范围广,累及各大、中动脉,典型表现为内膜下脂质蓄积、内皮受损、炎性细胞大量浸润、粥样斑块形成及由管腔狭窄,最终引发的靶器官缺血性改变[1]。其中,由巨噬细胞胆固醇代谢稳态失调引发的细胞泡沫化作为斑块形成的核心机制,在AS进程中扮演着重要角色。泡沫细胞的形成来源于不平衡的巨噬细胞胆固醇摄取与外排,表现为CD36、SRA-1、LOX1等多种清道夫受体表达上调后对氧化型低密度脂蛋白(oxidized low-density lipoprotein ,ox-LDL)的吞噬内化增加,以及由ATP结合盒亚族A1/G1(ATP-binding cassette subfamily A1/G1,ABCA1/G1)胆固醇转运蛋白介导的胆固醇外排减少[2]。泡沫细胞在受损内皮下空间的形成和积聚是AS斑块形成的标志性事件。因此,进一步阐明巨噬细胞胆固醇稳态调控机制对抑制细胞泡沫化并改善AS至关重要。
槲皮素(quercetin,Qu)作为一种广泛存在的黄酮类物质,膳食来源多种多样,在洋葱、芦笋、青椒等蔬菜及苹果、柑橘、甜瓜等水果中的含量尤为丰富[3]。流行病学研究表明,人群增加槲皮素等膳食黄酮类的日常摄取,可明显减少心血管疾病的发病几率[4]。大量体内、外实验研究表明,槲皮素对AS发生发展的多个关键环节均表现出良好的保护效应,如降低斑块氧化应激水平、拮抗炎症和恢复血管内皮功能等[5-6]。更重要的是,研究表明槲皮素可特异性靶向富集于AS斑块巨噬细胞,为其在斑块微环境中发挥多种生物活性功能奠定了重要的物质基础[7]。然而,槲皮素对AS保护作用的潜在机制至今尚未完全明确。因此,本研究使用高脂膳食喂养载脂蛋白E敲除(apolipoprotein E knockout,ApoE KO)小鼠建立AS模型,采用ox-LDL孵育RAW264.7巨噬细胞建立体外泡沫细胞模型并使用槲皮素干预,聚焦于巨噬细胞胆固醇稳态调控,探讨槲皮素改善AS的潜在分子机制。
1 材料与方法
1.1 实验动物及细胞SPF级成年♀ ApoE KO小鼠购于北京维通利华实验动物技术有限公司(SCXK【京】2019-0011)。饲料由北京科澳协力饲料有限公司提供。RAW264.7细胞系购于中国科学院细胞库(货号:TCM13)。
1.2 试剂血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)检测试剂盒(中生北控生物科技);细胞总、游离胆固醇检测试剂盒(普利莱生物科技);油红O(Sigma-Aldrich);ox-LDL、Dil标记的ox-LDL(Dil-labeled-ox-LDL)(奕源生物科技);25-NBD-cholesterol (Avanti Polar Lipids);槲皮素(Sigma);环孢菌素A(Cyclosporin A,Cyc A,CYP27A1抑制剂)(MedChem Express);细胞色素P450 27羟化酶(cytochrome P450 27-hydroxylase,CYP27A1)抗体(14739-1,proteintech);清道夫受体B(scavenger receptor B,CD36)抗体(18836-1,proteintech);肝X受体α(liver receptor Xα,LXRα)(ab176323,Abcam);ABCA1抗体(NB400-105,Novus Biologicals);ABCG1抗体(ab52617,Abcam);GAPDH抗体(2118,CST);HRP标记抗兔IgG抗体(7074,CST)。
1.3 仪器ELX800型酶标仪(美国BIOTEK);荧光倒置显微镜(日本OLYMPUS);7900HT荧光定量PCR仪(美国ABI);凝胶成像系统(英国SYNGENE)。
1.4 动物模型[6]将45只成年♀ApoE KO小鼠适应性喂养1周后,随机分为3组,即普通饲料组(normal diet,ND)、高脂饲料组(high fat diet,HFD,21%脂肪和0.15%胆固醇)、高脂饲料+槲皮素组(HFD+Qu,100 mg·kg-1体质量)。根据体质量确定HFD+Qu组小鼠每日槲皮素灌胃量,每周记录小鼠进食量与体质量。持续喂养16周后,2%戊巴比妥钠进行麻醉,经眼眶内眦动脉丛取血,并迅速分离其主动脉,采用4%多聚甲醛固定或-80 ℃冰箱冻存。
1.5细胞培养[6,8]将RAW264.7巨噬细胞接种于DMEM培养基(含10%FBS),置于37 ℃、5% CO2条件下培养。待细胞融合度近70%时采取如下处理,对照组(Con,DMEM培养基培养)、ox-LDL干预组(50 mg·L-1ox-LDL孵育)、ox-LDL+Qu干预组(50 mg·L-1ox-LDL和100 μmol·L-1槲皮素共同孵育)、Qu干预组(100 μml·L-1槲皮素孵育)、ox-LDL+Qu+Cyc A干预组(50 mg·L-1ox-LDL、100 μmol·L-1槲皮素和20 μmol·L-1Cyc A共同孵育)、Cyc A干预组(20 μmol·L-1Cyc A孵育)。
1.6 主动脉弓横截面油红O及HE染色取长约2 mm的各组小鼠主动脉弓组织,经固定、脱水、透明、浸蜡后进行OCT包埋并切片,每只小鼠收集10~15张切片,行油红O及HE染色。在显微镜下随机挑选视野,采集图像。
1.7 生化指标测定采用相应试剂盒,根据操作说明检测各组小鼠血清TC、TG、LDL-C及HDL-C水平。
1.8 PCR采用TRIzol法提取各组小鼠主动脉组织总RNA,严格按照说明书逆转录为cDNA,随后采用SYBR-Green扩增cDNA并获得Ct值。引物序列见Tab 1。β-actin为内参基因,利用2-△△Ct法得到各基因表达水平。

1.9 细胞油红O染色分别使用4%多聚甲醛和60%异丙醇对经过干预处理的各组细胞进行固定和浸洗,随后加入适量油红工作液,37 ℃孵育1 h后,在光学显微镜下观察染色情况并采集图像。
1.10 细胞Dil-ox-LDL摄取实验用含Dil-ox-LDL(5 mg·L-1)的无酚红培养基培养已干预处理后各组细胞2 h后,利用荧光显微镜采集目标图像。
1.11 细胞总胆固醇及游离胆固醇水平测定根据试剂盒说明书所述操作方法与步骤测定经干预处理的各组细胞的总胆固醇及游离胆固醇(free cholesterol,FC)水平。
1.12 胆固醇外流试验含荧光标记胆固醇NBD-cholesterol(5 μmol·L-1)的无酚红培养基孵育细胞4 h后,弃去上清并清洗,随后分别添加含apoA-I(50 mg·L-1)或HDL(50 mg·L-1)培养基继续培养4 h。依次收集培养上清,并0.1%Triton溶液充分裂解细胞。检测上清培养液及细胞裂解液荧光强度数值。计算公式:胆固醇外流率/%=上清荧光值/(上清荧光值+细胞裂解液荧光值)×100%。
1.13 蛋白免疫印迹(Western blot)收集待测细胞,RIPA裂解液于冰上充分裂解并提取细胞总蛋白。采用BCA法测定样品蛋白浓度后,进行蛋白变性。上样后电泳完成蛋白分离,将蛋白湿转于PVDF膜上,并用5%脱脂牛奶于室温下封闭2 h。随后相继进行一抗、二抗孵育及洗膜后,加入显影试剂并使用凝胶成像仪采集条带图像,利用Quantity one软件检测蛋白相对表达量。
2 结果
2.1 槲皮素减少ApoE KO小鼠AS斑块面积如Fig 1所示,ND组的主动脉内膜呈增生状,并存在泡沫细胞聚集及炎性细胞浸润;与之相较,HFD组的主动脉结构明显异常,管腔狭窄,内膜增厚并附着斑块,其内泡沫细胞和无结构坏死物大量存在。与HFD组相比,槲皮素干预组AS斑块损伤明显改善,以内膜增厚伴泡沫细胞浸润为主要表现,无明显斑块附着。
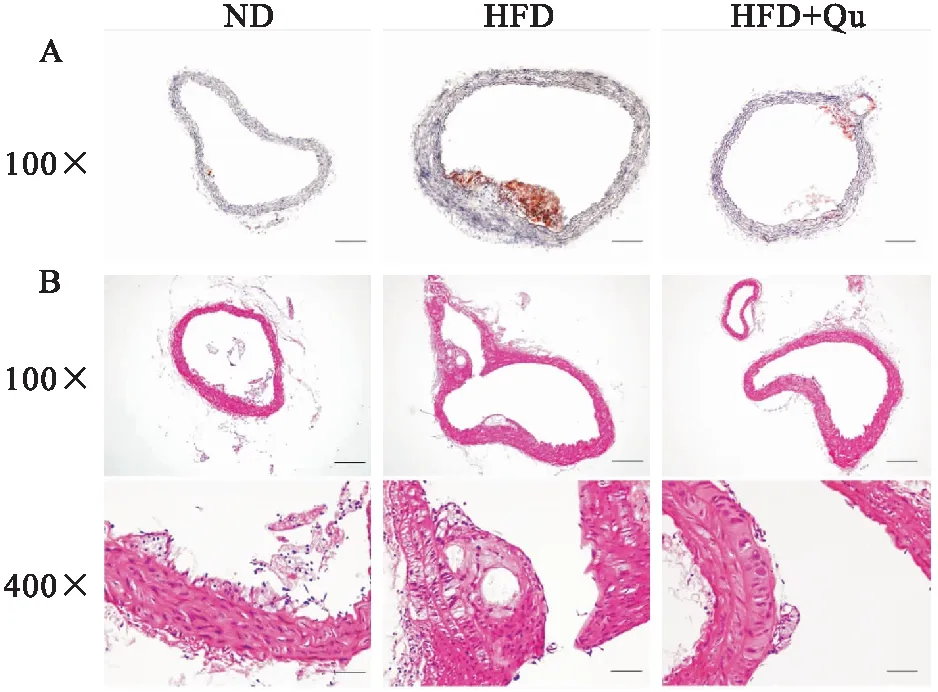
Fig 1 Quercetin ameliorated atherosclerotic lesion formation in ApoE KO mice
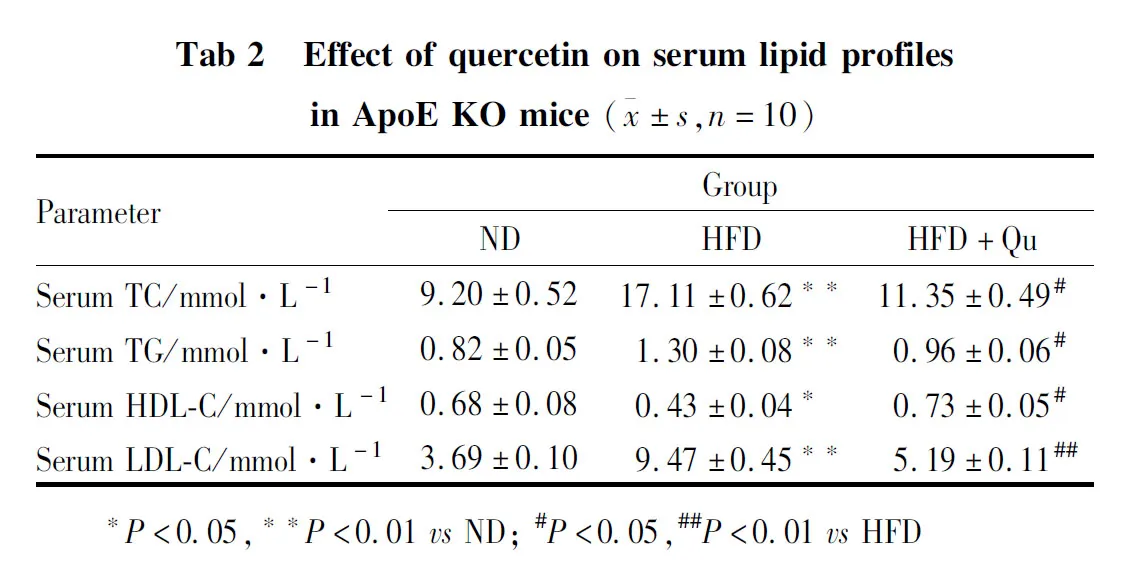
2.2 槲皮素降低ApoE KO小鼠血脂水平如Tab 2所示,相比于ND组,血TG、TC及LDL-C水平在HFD组均明显增高(P<0.01),HDL-C水平则明显下降(P<0.05)。相反,相比于HFD组,槲皮素干预组的TG、TC和LDL-C水平明显降低,分别降低了约34%、26%和45%(P<0.05),HDL-C水平则增高了约30%(P<0.05)。血脂水平变化与前述各组小鼠AS斑块形成情况相一致。
2.3 槲皮素改善ox-LDL诱导的巨噬细胞脂质蓄积细胞油红O染色结果显示,与对照组相比,经ox-LDL处理的巨噬细胞内红染脂滴数量(Fig 2A)及Dil-ox-LDL的荧光强度(Fig 2B)明显增加,由HDL与载脂蛋白A-I(apolipoprotein A-I,apoA-I)介导的胆固醇流出率较对照组分别增加了近30%和48%(Fig 2C),此外,细胞内TC和FC水平明显升高(Fig 2D)。经槲皮素干预后,巨噬细胞内脂质蓄积较ox-LDL组明显减少,Dil-ox-LDL荧光强度明显降低,胆固醇流出率进一步上升。
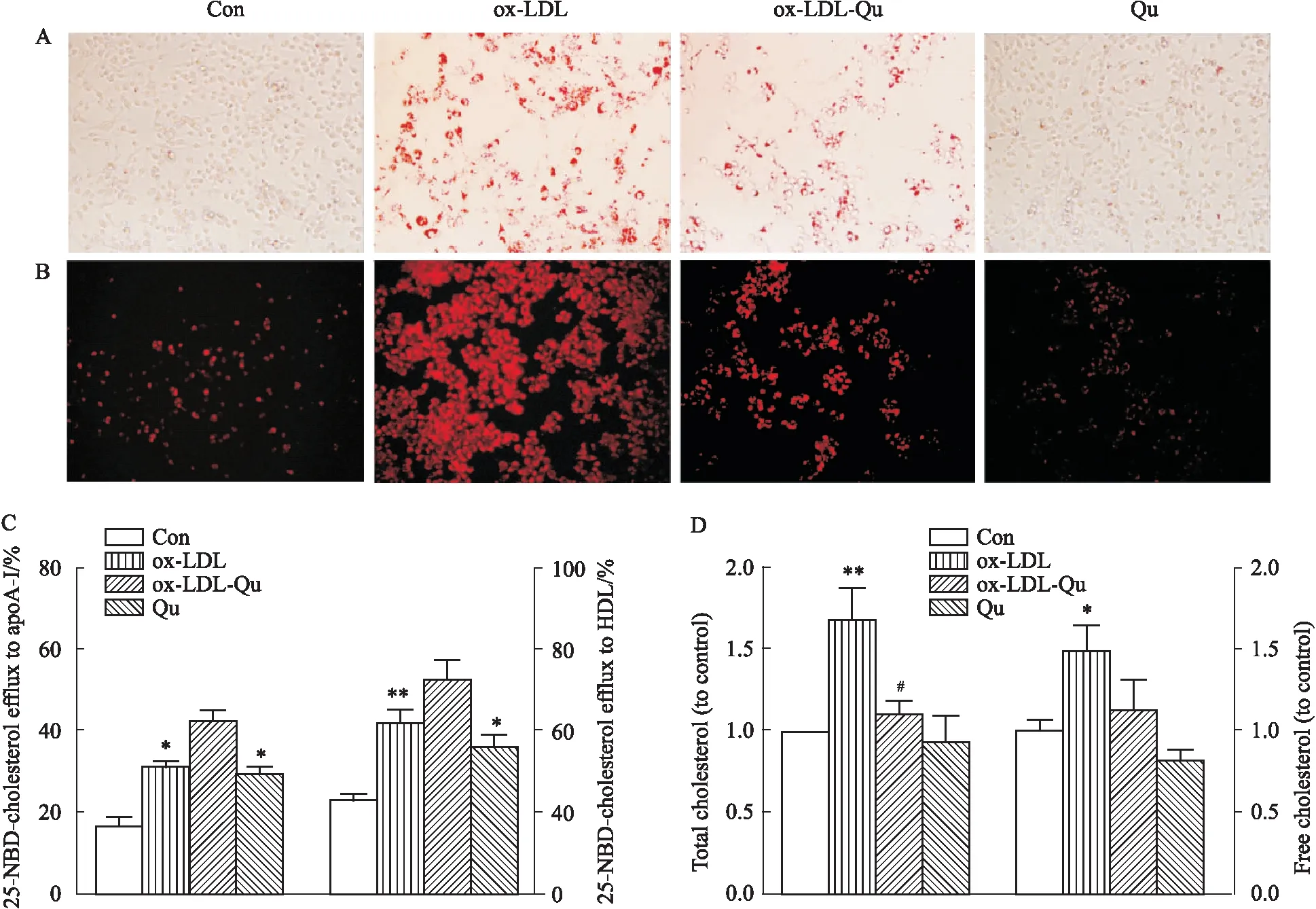
Fig 2 Quercetin reduced ox-LDL-induced lipid accumulation in RAW264.7 macrophages
2.4 槲皮素对胆固醇稳态调节相关蛋白表达的影响如Tab 3所示,与ND组相比,HFD组小鼠主动脉LXRα、CD36、ABCA1及ABCG1的mRNA表达水平均明显上升(P<0.05)。HFD组小鼠主动脉CYP27A1的mRNA表达水平虽高于ND组,但无统计学差异。相比于HFD组,在槲皮素干预后,小鼠主动脉组织中CYP27A1、LXRα及ABCA1的mRNA表达水平明显上调(P<0.05);而CD36的mRNA表达水平呈明显性下降(P<0.01)。如Fig 3所示,RAW264.7巨噬细胞经ox-LDL诱导后,CD36及ABCG1蛋白水平明显升高(P<0.05);CYP27A1、LXRα及ABCA1蛋白水平虽高于对照组,但差异无统计学意义。而槲皮素干预不仅使静息状态下的CYP27A1、LXRα及ABCA1/G1蛋白水平明显升高,同时进一步明显上调由ox-LDL诱导的CYP27A1、LXRα和ABCA1/G1蛋白表达(P<0.05)。相反,槲皮素对静息状态及ox-LDL诱导的CD36蛋白表达均存在明显的抑制作用(P<0.05)。


Fig 3 Effects of quercetin on cholesterol homeostasis-related protein expressions in RAW264.7 macrophages
2.5 槲皮素通过CYP27A1/LXRα信号通路调控胆固醇稳态如Fig 4所示,由ox-LDL干预的巨噬细胞,预孵CYP27A1抑制剂Cyc A可明显下调由槲皮素诱导的CYP27A1、LXRα及ABCA1/G1蛋白表达;并有效拮抗槲皮素对CD36蛋白表达的抑制作用(P<0.05),细胞内TC和FC水平均明显升高(P<0.05)。此外,Cyc A干预可明显降低静息状态下的CYP27A1和LXRα蛋白表达,并诱导CD36蛋白表达(P<0.05),细胞内TC水平较对照组明显升高(P<0.05)。
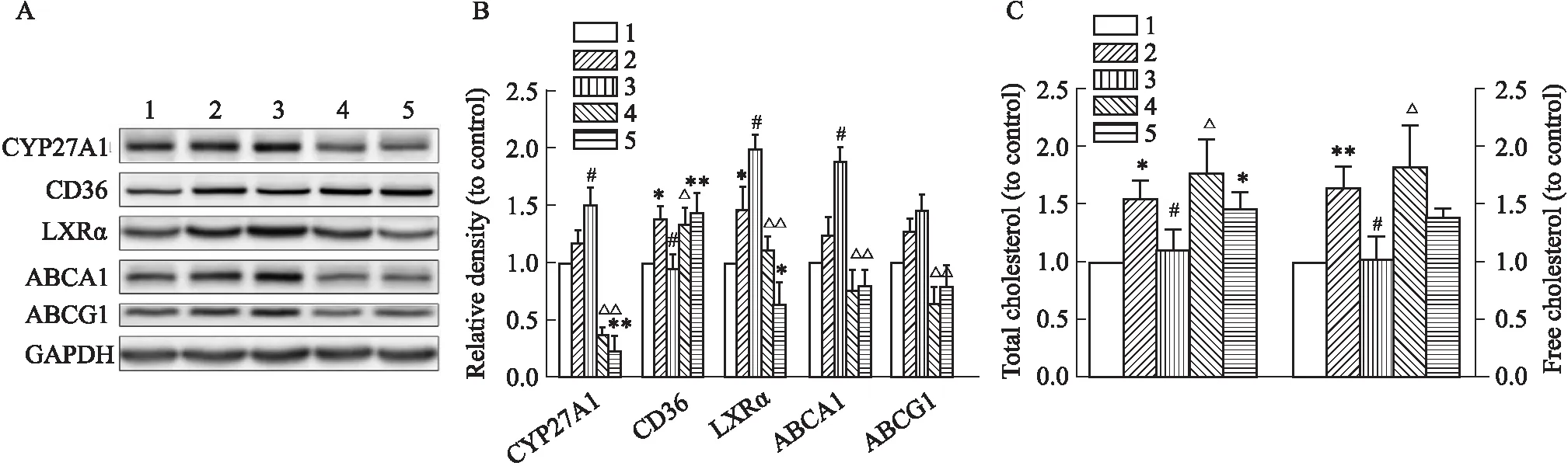
Fig 4 Cyc A antagonized protective effects of quercetin on ox-LDL-induced macrophage cholesterol disequilibrium
3 讨论
巨噬细胞作为构成AS斑块最主要的细胞成分之一,在AS进程的各个环节均发挥重要作用。研究表明槲皮素可特异性靶向富集于AS斑块巨噬细胞,为其在斑块微环境中发挥多种生物活性功能奠定了重要的物质基础[7]。本研究表明,槲皮素干预可显著改善HFD喂养的ApoE KO小鼠AS主动脉斑块损伤。由ox-LDL诱发的巨噬细胞泡沫化是AS斑块形成的核心事件,本研究以50 mg·L-1ox-LDL孵育RAW264.7巨噬细胞24 h建立泡沫细胞模型,经槲皮素干预后,巨噬细胞TC、FC水平明显降低,泡沫化程度有效减轻。
巨噬细胞泡沫化源于胆固醇摄取与外排过程的显著不平衡,主要表现为清道夫受体增加对ox-LDL的摄取,而膜胆固醇转运体减少对胆固醇的外排。CD36是巨噬细胞内极为重要的清道夫受体[9];而ABCA1/G1作为介导巨噬细胞胆固醇外流的主要转运体,其在荷脂巨噬细胞胆固醇外流过程中发挥不可替代的作用[10]。已有研究报道,LXRα可在转录水平上调控ABCA1/G1的蛋白表达[11]。本研究表明,槲皮素可明显拮抗由ox-LDL干预RAW264.7细胞上调的CD36蛋白,减少巨噬细胞对ox-LDL的摄取,这一结果与Choi等[12]的报道相一致。与此同时,槲皮素干预可有效拮抗由ox-LDL诱导激活的巨噬细胞LXRα-ABCA1/G1信号通路,明显增加巨噬细胞胆固醇流出率,这一现象与Jia等[13]报道相一致。然而槲皮素对CD36及LXRα-ABCA1/G1信号通路的潜在调控机制尚待进一步阐明。
CYP27A1是一种功能多样的细胞色素P450羟化酶,主要存在于细胞线粒体,可羟基化胆固醇的第27位碳基位点生成27-羟基胆固醇(27HC)。27HC作为LXRα的高亲和度内源性配体,在胆固醇代谢稳态调控中扮演了重要角色[14]。研究表明,CYP27A1可通过介导27HC生成,激活LXRα-ABCA1/G1信号通路以促进胆固醇外流[15];此外,巨噬细胞在27HC干预后,其清道夫受体CD36蛋白水平却明显下调[16]。由此表明,CYP27A1对巨噬细胞胆固醇摄取和外流过程具有双向调控作用,是维持细胞胆固醇稳态并由此改善AS的关键蛋白。本研究表明,槲皮素干预明显上调CYP27A1蛋白水平,诱导下游LXRα-ABCA1/G1蛋白表达,并抑制CD36蛋白表达,有效降低巨噬细胞内胆固醇水平;而使用CYP27A1特异性抑制剂Cyc A可有效拮抗槲皮素的上述保护作用,表明由CYP27A1调控的CD36与LXRα-ABCA1/G1信号通路在槲皮素调控巨噬细胞胆固醇稳态过程中发挥重要作用。
综上所述,槲皮素可通过上调CYP27A1蛋白表达,抑制由CD36介导的胆固醇摄取,并增加由LXRα-ABCA1/G1信号通路介导的胆固醇输出,有效降低巨噬细胞泡沫化水平而发挥AS保护作用。槲皮素调控CYP27A1表达的潜在分子机制有待进一步深入研究。