基于NF-κB/MAPK信号通路探讨天山堇菜七叶内酯对脂多糖诱导RAW 264.7细胞的保护作用及机制
2022-09-13史玉柱
王 雪,刘 燕,史玉柱
(新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830011)
天山堇菜(ViolatianshanicaMaxim)又名“比那夫西”,是堇菜科(Violaceae)堇菜属植物,药用其干燥全草,具有调理、软化、发汗的作用。临床用于热性感冒、发烧、头痛、咽痛、肢肿、小儿惊厥,也可外用于疔疮肿痛等症[1-2]。全草含挥发油、黄酮类、生物碱、氨基酸、皂苷、鞣质、香豆素等成分,具有明显的抗菌、抗氧化等作用[1-3]。天山堇菜在维吾尔药经典名方中存在着广泛的应用,它是常用的单方退烧药或复方抗病毒药的主要组分。如:复方天山堇菜颗粒、降热比那甫西糖浆、复方比那甫西丸、比那甫西颗粒等,以上经典名方的君药均为天山堇菜。因其副作用低,价格低廉,是一味极具有研究开发价值的药材。目前,有关天山堇菜及其化学成分药理作用及机制方面的深入研究相对比较匮乏。课题组前期研究[3-5]发现,天山堇菜总黄酮提取物具有较好的体内、外抗流感病毒作用及抗炎、免疫调节作用。通过化学成分分析发现天山堇菜总黄酮提取物中含有大量的七叶内酯,采用反相硅胶和Sephadex LH-20色谱技术对天山堇菜中的七叶内酯进行分离纯化,最终得到了含量大于97%的七叶内酯。七叶内酯有可能是天山堇菜总黄酮提取物发挥抗炎和免疫调节作用的物质基础。尽管七叶内酯是一个常见的化合物,普遍存在于很多中药材中,具有抗菌、抗炎、镇咳、祛痰、平喘等功效,但对其药理作用的研究都不够深入。因此,本研究采用大肠杆菌脂多糖(LPS)诱导小鼠单核巨噬细胞白血病细胞(RAW264.7)急性炎症模型考察七叶内酯的抗炎作用,探讨其是否通过调节NF-κB、MAPK信号通路发挥抗炎作用的机制,为天山堇菜的应用研究与开发提供科学依据。
1 材料与方法
1.1 药品与试剂天山堇菜七叶内酯,由新疆维吾尔自治区药物研究所植物化学研究室制备,纯度97%;阳性对照药:吲哚美辛(Indomethacin,INDO)购于美国Sigma公司,货号:I7378。脂多糖(LPS,Escherichia Coli 055:B5),美国Sigma公司,货号L2880;RPMI 1640培养基,Gibco公司,货号:C11875500CP,批号:8118002;胎牛血清FBS,美国Gibco公司,货号:10099-141,批号:19083660C;CellTiter 96®AQueous One Solution Cell Proliferation Assay,美国Promega公司,货号:G3581;Griess试剂盒,碧云天公司,货号:S0021;Mouse TNF-α ELISA Ready-SET-GO、Mouse IL-6 ELISA Ready-SET-Go,购于Thermo Fischer Scientific 公司,货号分别为:88-7324-88,88-7064-88;IL-1β酶联免疫试剂盒,批号:Z13019384,购自武汉华美生物技术有限公司;多聚甲醛购于天津南开允公合成技术公司,货号:30525-89-4;Triton X-100,Thermo Fischer Scientific公司,货号:8511;BSA,美国Sigma公司,货号:A1933;BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit),CatNo. P00125,Lot No. 052319190910,碧云天生物技术有限公司;iNOS抗体,p-p44/42(ERK1/2) (Thr202/Tyr204)抗体,美国CST公司,货号:4370S;p-p38 MAPK (Thr180/Tyr182)抗体,美国CST公司,货号:9211S;p-NF-κB p65 (Ser536)抗体,美国Abcam公司,货号:3033S;IκBα (E130)抗体,美国Abcam公司,货号:ab32518;Hoechst 33342核染料,日本东仁化学公司,货号:H342;荧光二抗Alexa Fluor 546 goat anti-mouse IgG或Alexa Fluor 546 goat anti-rabbit IgG,Thermo Fischer Scientific 公司,货号:A11035或A11030。RNAprep pure Cell kit(DP430),Lot U9012;FastKing gDNA Dispelling RT SuperMix(KR118),Lot W9318;SuperReal PreMix Plus(SYBR Green)(FP205),Lot U9208,购自天根生物技术有限公司。COX Fluorescent Inhibitor Screening Assay Kit,批号:0520422,购自Cayman Chemical Company。
1.2 仪器CO2细胞培养箱,Thermo Fischer Scientific公司,型号:LS-C0150;多功能酶标仪,瑞士TECAN公司,型号:SPARKTM20M;Molecular Devices,Spectramax M2, CA, USA;Cellomics Arrayscan高内涵细胞分析系统,Thermo Fischer Scientific公司。
1.3 方法
1.3.1细胞培养与细胞活力的检测 RAW 264.7细胞(小鼠单核巨噬细胞白血病细胞),购自国家实验细胞资源共享服务平台(China infrastructure of cell line resource),细胞采用含10%胎牛血清,100 kU·L-1青霉素和链霉素的RPMI 1640培养基培养,培养条件是饱和湿度,37 ℃,5% CO2。细胞呈对数增长时进行传代,调整细胞浓度至2×108个·L-1,接种100 μL于96孔培养板,细胞达到80% 融合时撤去血清继续培养12 h,然后加入AESN(终浓度为100、20、4、0.8、0.16 μmol·L-1)和阳性对照药吲哚美辛(INDO,10 μmol·L-1)孵育48 h,培养结束时每孔加入MTS溶液10 μL,于37 ℃继续孵育1.5 h,采用微孔板检测仪M2检测490 nm处的光吸收值。
细胞存活率/%=(ODsample-ODblank)/(ODcontrol-ODblank)×100%。
1.3.2AESN对细胞上清中炎症介质一氧化氮(NO)水平的影响 将RAW 264.7细胞以2×104个/孔的密度接种在96孔板中,孵育18 h后换上无血清的RPMI 1640培养液。设空白对照组,LPS模型组,AESN给药组(20、4、0.8、0.16 μmol·L-1)以及阳性对照药吲哚美辛(INDO,10 μmol·L-1)组,给药组分别加入相应浓度的AESN和INDO,空白对照组与模型组加入同体积无血清RPMI 1640培养液,孵育1 h后,除空白对照组外,各组加入终浓度为1 mg·L-1的LPS继续孵育24 h,培养结束时取100 μL上清,参照文献[6]将细胞上清与Griess试剂等体积混合,10 min后检测OD540的值。
1.3.3AESN对炎症因子TNF-α、IL-6、IL-1β释放的影响 将RAW 264.7细胞以2×104个/孔的密度接种在96孔板,分组、加药及加LPS同“1.3.2”,加入LPS孵育24 h后,收集细胞上清,按照ELISA试剂盒说明书的方法检测TNF-α、IL-6、IL-1β的含量。
1.3.4AESN对iNOS蛋白表达的影响 细胞接种、分组及给药同“1.3.2”,药物孵育1 h后,除空白对照组外,每孔加入终浓度为1 mg·L-1的LPS继续孵育24 h,孵育结束弃去上清,按照100 μL/孔加入4%多聚甲醛室温固定20 min,弃去,并用PBS清洗3次;再按照100 μL/孔加入0.25% Triton X-100打孔液室温作用15 min,PBS清洗3次;再加入100 μL/孔3% BSA封闭液封闭45 min后,弃去封闭液,加入Anti-iNOS抗体(1 ∶1 000稀释),4 ℃孵育过夜,次日用PBS清洗3次,加入含Hochest 33342的山羊抗兔荧光二抗(1 ∶800稀释),室温避光孵育2 h,PBS清洗3次,于Cellomics Arrayscan高内涵细胞分析系统检测分析。
1.3.5AESN对NF-κB通路、MAPK信号通路的影响 细胞接种、分组同“1.3.2”,提前加入化合物AESN(0.16、0.8、4、20 μmol·L-1)和阳性药吲哚美辛(10 μmol·L-1)孵育4 h,其它组别平行加入10 μL/孔PBS;向细胞中加入终浓度1 mg·L-1LPS孵育15 min检测IκBα的降解、孵育30 min检测p-p65核内表达,孵育45 min检测p-p38、p-ERK1/2核内的表达。细胞处理结束后,按照100 μL/孔加入4%多聚甲醛室温固定20 min,弃去并用PBS清洗3次;再按照100 μL/孔加入0.25 % Triton X-100打孔液室温作用15 min,PBS清洗3次;再加入100 μL/孔3% BSA封闭液封闭45 min后,弃去封闭液,分别加入:anti-IκBα抗体、anti-p-p65抗体、anti-p-p38抗体、anti-p-ERK1/2抗体,以上抗体均按1:1 000稀释,4 ℃孵育过夜;次日用PBS清洗3次后加入含Hochest 33342的山羊抗兔(或抗鼠)荧光二抗(1:800稀释),室温避光孵育2 h,PBS清洗3次,于Cellomics Arrayscan高内涵细胞分析系统检测分析。
1.3.6AESN对TNF-α、IL-6、IL-1β、iNOS mRNA表达的影响 将处于对数生长期的RAW 264.7细胞按照2×106个/皿接种于直径为6 cm的一次性无菌平皿中,设空白对照组,LPS模型组,AESN给药组(20、4、0.8、0.16 μmol·L-1),以及阳性对照药吲哚美辛(INDO,10 μmol·L-1)组,每组每个浓度3个重复,药物孵育1 h后,除空白对照组外,各组加入终浓度为1 mg·L-1的LPS继续孵育24 h,弃上清,按照RNA prep pure Cell kit(DP430)培养细胞总RNA提取试剂盒说明书的方法提取细胞总RNA,对提取的总RNA样品进行定量并保存于-80 ℃。按照FastKing gDNA Dispelling RT SuperMix(KR118),cDNA第一链合成预混试剂合成cDNA并保存于-20 ℃。设计并合成特异引物如Tab 1。
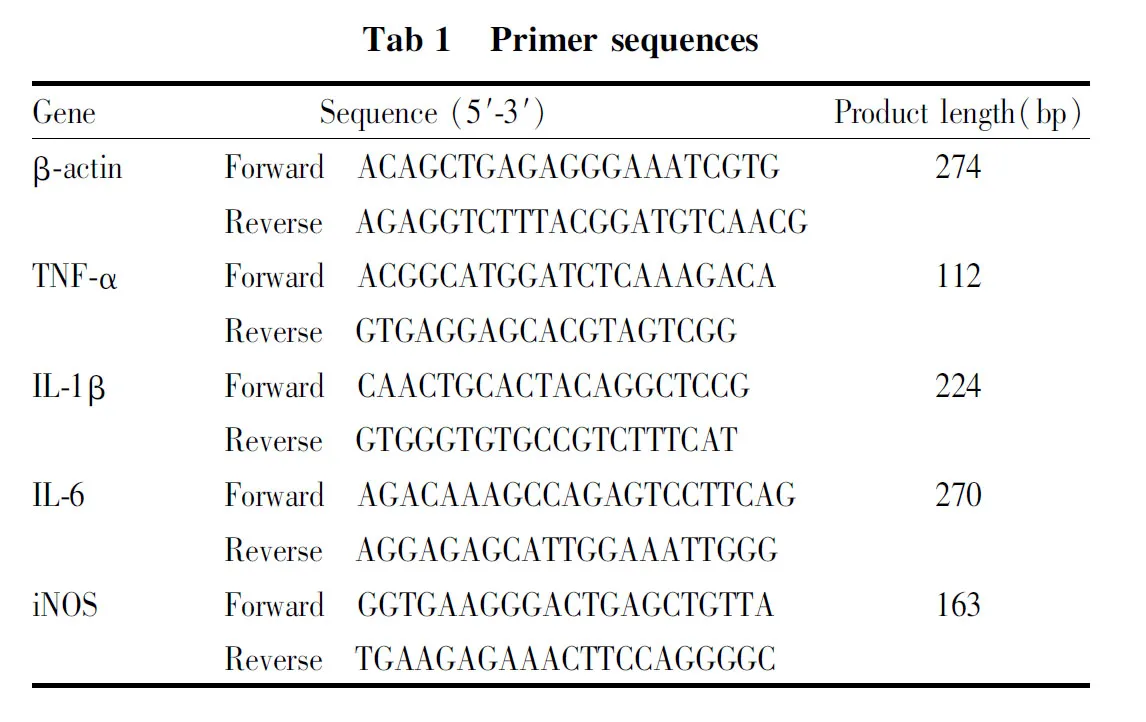
使用SuperReal PreMix Plus(SYBR Green)(FP205)荧光定量预混试剂,反应体系为20 μL。反应条件为:预变性95 ℃,15 min;40 cycles of:变性95 ℃,10 s;退火60 ℃,20 s;延伸72 ℃,32 s。qRT-PCR相对定量结果计算方法采用SybrGreen ER荧光检测系统,对目的基因进行相对定量分析,采用看家基因β-actin作为内参照对Ct值进行归一化处理,基因表达差异计算方法采用2-△△Ct法。
1.3.7AESN对COX-1、COX-2酶活性的影响 AESN对COX-1、COX-2活性的抑制作用按照试剂盒COX fluorescent inhibitor screening assay kit方法进行操作,并计算半数抑制浓度IC50。
2 结果
2.1 AESN对RAW264.7细胞活力的影响由Fig 1可见,AESN孵育48 h后,与空白对照组细胞活力相比较,AESN在0.16~20 μmol·L-1以及10 μmol·L-1吲哚美辛均未出现细胞增殖或毒性作用,仅在100 μmol·L-1出现明显的细胞毒性作用(P<0.01)。因此,后续实验选定0.16、0.8、4、20 μmol·L-1作为AESN的实验剂量。
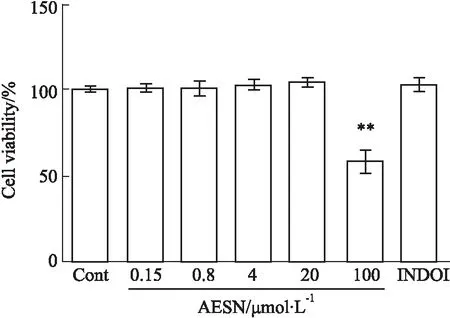
Fig 1 Effects of AESN on cell
2.2 AESN对LPS诱导RAW264.7细胞产生NO、TNF-α、IL-6、IL-1β的影响实验结果显示,给予1 mg·L-1LPS刺激24 h后,与Control组相比,LPS模型组NO、TNF-α、IL-6、IL-1β分泌量明显增加(Fig 2 A~D,P<0.01),AESN各剂量给药组对NO、TNF-α、IL-6、IL-1β的分泌量均具有明显抑制作用且呈剂量依赖性(Fig 2 A~D,P<0.05,P<0.01)。阳性对照药吲哚美辛(10 μmol·L-1)也能够明显抑制NO、TNF-α、IL-6、IL-1β的分泌(Fig 2 A~D,P<0.05或P<0.01),作用不如AESN的20 μmol·L-1剂量组明显。
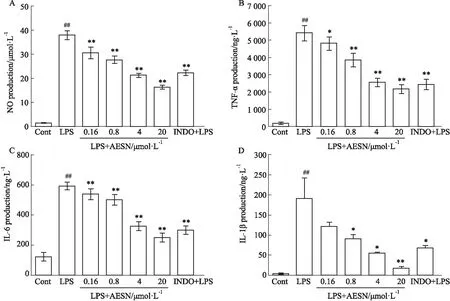
2.3 AESN对TNF-α、IL-6、IL-1β、iNOS mRNA表达的影响实验结果显示,给予1 mg·L-1LPS刺激24 h后,与Control组相比,LPS模型组TNF-α、IL-6、IL-1β、iNOS mRNA表达水平明显增加(Fig 3 A~D,P<0.01),AESN各剂量给药组对TNF-α、IL-6、IL-1β、iNOS mRNA表达水平均具有明显抑制作用(Fig 3 A~D,P<0.01)。阳性对照药吲哚美辛(10 μmol·L-1)也能够明显抑制TNF-α、IL-6、IL-1β、iNOS的mRNA表达水平(Fig 3 A~D,P<0.05,P<0.01),作用不如AESN剂量组明显。

2.4 AESN对iNOS蛋白表达的影响由Fig 4可见,给予1 mg·L-1LPS刺激24 h后,与Control组相比,LPS模型组iNOS蛋白荧光强度明显增强(P<0.01),AESN各剂量给药组均能明显减弱iNOS蛋白表达荧光强度(P<0.01)。阳性对照药吲哚美辛(10 μmol·L-1)也能够明显减弱iNOS蛋白的荧光强度(P<0.01),作用不如AESN 20 μmol·L-1剂量组明显。

Fig 4 Effects of AESN on iNOS protein expression induced by LPS in RAW 264.7 cells
2.5 AESN对NF-κB信号通路的调节作用由Fig 5可见,给予1 mg·L-1LPS刺激15 min时,LPS模型组IκBα蛋白与Control组相比显著降解(Fig 5B、D,P<0.01),LPS刺激30 min时,LPS模型组p-p65核转位明显增加(Fig 5A、C,P<0.01),而AESN在0.16~20 μmol·L-1对IκBα蛋白降解和p-p65核转位具有明显抑制作用(P<0.01),并呈剂量依赖性;吲哚美辛(10 μmol·L-1)也能够抑制IκBα降解及p-p65核转位(P<0.01),但作用不如AESN的20 μmol·L-1剂量组明显。

2.6 AESN对MAPK信号通路的调节作用免疫荧光结果(Fig 6)显示,给予1 mg·L-1LPS刺激45 min时,p-p38和p-ERK1/2核转位明显增加(P<0.01),AESN在0.16~20 μmol·L-1对p-p38、p-ERK1/2核转位具有明显地抑制作用(P<0.01),呈现剂量依赖性;阳性药吲哚美辛(10 μmol·L-1)对p-p38、p-ERK1/2的核转位也具有抑制作用(P<0.01),作用不如AESN的20 μmol·L-1剂量组明显。

2.7 AESN对COX-1、COX-2活性的影响由Tab 2可见,七叶内酯在4~100 μmol·L-1浓度范围内呈剂量依赖性地抑制COX-1酶活性,对COX-1半数抑制浓度IC50为28.1 μmol·L-1。由Tab 3可见,七叶内酯在0.8~20 μmol·L-1浓度范围内可呈剂量依赖性地抑制COX-2酶活性,对COX-2的半数抑制浓度IC50为2.3 μmol·L-1。
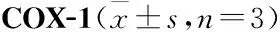
Tab 2 Effect of AESN on activity of
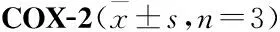
Tab 3 Effect of AESN on activity of
3 讨论
炎症反应是一种复杂的防御反应[6],由多种细胞因子参与,适度的炎症有利于机体健康,而过度的炎症会引起不良反应,从而导致疾病甚至死亡[7]。在免疫反应发生过程中,巨噬细胞作为机体重要的免疫细胞和炎症效应细胞,在诱导炎症反应的过程中发挥关键作用[6-9]。脂多糖是革兰氏阴性菌细胞壁的重要组成部分,具有抗原性,当革兰氏阴性细菌崩裂时释出,是很强的致热原,近年来在动物和细胞实验中被广泛用来诱导炎症的发生。LPS进入机体后,可以被巨噬细胞的TLR4识别并结合,启动细胞内NF-κB、MAPK等信号通路,促使下游通路得到激发,导致多种炎症因子TNF-α、IL-1β、IL-6、IFN-γ、GM-CSF等以及炎症介质NO、PGE2过量表达和分泌,引起机体损伤[10-14]。因此,抑制巨噬细胞分泌炎症因子是缓解炎症反应的重要环节。此外,LPS刺激巨噬细胞产生大量iNOS,iNOS与炎症密切相关[10-11],可诱导NO的产生,过量的NO将导致细胞损伤、组织坏死,进而促进炎症性疾病发生发展,而且其产生能活化自身的环氧合酶COX,其中COX-2是诱生型表达的酶,与炎症性疾病关系密切[13]。因此,本研究选用LPS诱导小鼠单核巨噬细胞白血病细胞RAW264.7急性炎症模型探讨七叶内酯的抗炎作用机制。
据报道[11-12],目前已有许多中药复方、单味中药、中药有效部位和有效成分均具有明显的抗炎作用。本研究在确定天山堇菜七叶内酯对RAW 264.7细胞安全浓度范围的基础上,从细胞、基因、蛋白水平深入探讨其对LPS诱导RAW264.7细胞炎症反应的保护作用机制。本研究发现,天山堇菜七叶内酯可明显降低LPS诱导RAW264.7细胞产生NO、TNF-α、IL-6、IL-1β水平,明显降低TNF-α、IL-6、IL-1β、iNOS的mRNA表达水平,对iNOS的蛋白表达也具有明显抑制作用,说明天山堇菜七叶内酯具有较好的抗炎作用,其抗炎作用与抑制炎症细胞因子的生成密切相关。
COX是花生四烯酸代谢途径中的关键酶,是体外抗炎药物筛选的重要靶点之一[14-16]。COX有3种同工酶,即:COX-1、COX-2、COX-3[14]。COX-1为结构酶,主要起到内环境稳定作用。COX-2为诱导酶,正常生理状态下,COX-2活性极低,在相关因素诱导后被激活,它可以诱导促进前列腺素等炎症介质的合成,介导炎症与疼痛反应,是炎症发展过程中的关键酶之一[14-16]。本研究结果显示,天山堇菜七叶内酯可显著抑制环氧酶COX-1的活性,其IC50为28.1 μmol·L-1,同时可明显抑制环氧酶COX-2的活性,其IC50为2.25 μmol·L-1。由于COX-2与COX-1的IC50比值为0.08,比值在0.01~0.1区间范围内,则说明天山堇菜七叶内酯对COX-2抑制的选择性较强,可作为COX-2的选择性抑制剂,从而抑制炎症的发生发展[15-16],这也是七叶内酯发挥抗炎作用的主要机制之一。
NF-κB是炎症反应中的关键转录因子。静息状态下与其抑制物IκBα形成无活性的复合体存在于细胞质中,当细胞受到LPS等刺激后其抑制物IκBα发生磷酸化降解,对NF-κB的抑制作用消失,NF-κB被激活,磷酸化后的NF-κB可转至细胞核中促使下游基因转录,从而上调炎症因子水平,加剧炎症反应[17]。本研究结果显示,LPS 刺激RAW 264.7细胞15 min后,IκBα蛋白明显降解,LPS刺激30 min后,p-p65核转位明显增加,细胞核中p-p65蛋白高表达,这与LPS刺激24 h后,NO、TNF-α,IL-6,IL-1β等炎症因子的高表达是相一致的。而天山堇菜七叶内酯对IκBα降解、p-p65核转位具有明显抑制作用,从而抑制下游炎症相关基因的表达,表明天山堇菜七叶内酯发挥抗炎作用与抑制NF-κB信号通路密切相关。MAPKs信号通路也是经典的炎症信号通路之一,主要由p38、ERK1/2和JNK 3条信号通路组成,是参与炎症反应的主要组成部分[18]。当细胞受LPS刺激后,p38、ERK1/2和JNK蛋白被磷酸化,转移入核调节多种转录因子,进一步促进炎症因子的转录和翻译,加剧炎症反应的程度。本研究发现,LPS 刺激RAW 264.7细胞45 min后,p-p38和p-ERK1/2核转位明显增加,即p38、ERK1/2蛋白磷酸化水平显著升高,而天山堇菜七叶内酯对p-p38、p-ERK1/2核转位具有明显地抑制作用,蛋白磷酸化水平显著下降,并呈现浓度依赖性,提示天山堇菜七叶内酯可通过抑制MAPKs信号通路,进而抑制炎症的继续发展。
综上所述,天山堇菜七叶内酯具有较好的抗炎作用,其发挥抗炎作用的机制与抑制NF-κB/MAPK信号通路密切相关。