TRPV4在心血管疾病治疗中的研究进展
2022-09-13邵俊兰焦小雨唐春雷江南大学生命科学与健康工程学院江苏无锡214000
邵俊兰,焦小雨,唐春雷(江南大学生命科学与健康工程学院,江苏 无锡 214000)
根据国家心血管病中心(School of Life Sciences and Health Engineering)近期发布的报告显示,中国患心血管病的人数约3.3亿,其中患脑卒中1300万,冠心病1100万,心力衰竭890万,高血压2.45亿。2018年,心血管病死亡占我国城乡居民总死亡原因的首位,在农村为46.66%,在城市为43.81%[1]。目前,市面上常有的心血管治疗药主要有五类,包括血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素受体阻滞剂(angiotensin receptor blockers,ARB)、钙通道阻滞剂(calcium channel blockers,CCB)、利 尿 剂、β-受体阻滞剂等。由于心血管治疗药全身性地作用于受体、通道和酶,缺乏较强的特异性,在广泛应用于疾病治疗的同时也会产生不良反应,比如高钾血症、电解质紊乱、直立性低血压等。为减少不良反应,提升患者生活质量,近年来以TRPV4为靶点的药物研究新方向已得到越来越多的重视。
瞬时受体电位(transient receptor potential,TRP)超家族由哺乳动物基因组中存在的28个TRP通道基因编码,并根据DNA和蛋白质序列同源性分为七个亚家族:经典瞬时受体电位(transient receptor potential canonical,TRPC), 瞬时受体M型(transient receptor potential melastatin,TRPM),瞬时受体锚蛋白(transient receptor potential ankyrin,TRPA),瞬时受体多囊蛋白(transient receptor potential polycystin,TRPP),瞬时受体粘脂蛋白(transient receptor potential mucolipin,TRPML)、无机械感受器电位C(no mechanoreceptor potential,NOMPC,TRPN)和瞬时受体香草素(transient receptor potential vanilloid,TRPV)[2]。TRPV可以进一步细分为6种亚型——TRPV1~6,其中,TRPV4蛋白在不同的血管内皮细胞中表达[3],参与了多种血管功能,包括应答血流剪切力、调节血管张力、机械信号传导、血管新生等。TRPV4功能障碍与许多病理生理状态有关,本综述就其在心血管疾病方面发挥的重要性进行探讨。
1 TRPV4的结构
TRP通道是四聚体蛋白,大多数TRP是非选择性阳离子通道,对钠、氯、钾和钙具有高渗透性,但每种亚型都具有独特的离子渗透性、电导和电压依赖性,并被不同的配体或生理刺激激活。
人类的TRPV4基因位于染色体12q23-q24.1上,有15个外显子,这些外显子编码组成全长含有871个氨基酸的蛋白质。TRPV4两侧是大的N端和C端结构域,中间是6个跨膜的α-螺旋结构域(S1~S6),其NH2末端附近有3个锚蛋白重复结构域(ankyrin-repeat domains,ARD),COOH端区域维持通道蛋白折叠、成熟和运输,允许离子流动的孔位于S5和S6结构域之间[4]。孔打开和关闭以允许阳离子穿过膜,门控通常由一种或多种刺激(例如配体结合)控制。
2 TRPV4的功能与相关疾病
2.1 TRPV4的生理功能
2.1.1 调节血管通透性 通过激活TRPV4通道可以增加内皮 Ca2+内流,同时激活肌球蛋白轻链激酶,刺激一氧化氮合成,并激活一氧化氮介导的负反馈回路,该回路通过环磷酸鸟苷(cyclic GMP,cGMP)依赖性衰减来增加血管通透性,从而保护血管屏障[5]。有研究通过观察后肢缺血动物模型发现,TRPV4激动剂通过诱导缺血后肢的淋巴管生成来改善缺血后肢的血流,缺氧后肢的淋巴管生成促进Ca2+通过TRPV4通道进入淋巴管内皮细胞,该研究表明通过激活TRPV4使淋巴管和血管中TRPV4上调将是治疗周边动脉阻塞性疾病的一个有效策略[6]。
2.1.2 维持细胞屏障 上皮屏障的特征在于细胞内紧密连接,而内皮屏障由细胞间紧密连接和/或黏附连接组成,这些连接限制了液体和蛋白质跨组织膜的细胞旁通道,而炎症等病理生理状态会破坏这些屏障的完整性。研究人员通过组织学观察发现TRPV4缺陷(TRPV4-/-)小鼠的结合上皮细胞间隙较野生型(TRPV4+/+)小鼠宽,TRPV4-/-小鼠结合上皮的外源性示踪渗透比TRPV4+/+小鼠更强,而对黏着小带蛋白的免疫反应性比 TRPV4+/+小鼠更低。该研究表明TRPV4在结合上皮细胞黏附连接的形成中起重要作用,这种黏附连接可以调节其通透性[7]。
2.2 TRPV4通道异常的相关疾病
2.2.1 心力衰竭 内皮功能障碍是心血管疾病发病机制的第一步,也是心力衰竭患者病死率的重要预测因素。TRPV4在血管内皮细胞中广泛表达,如主动脉、大动脉(例如颈动脉)和小动脉,以及靶器官(例如肺)中的毛细血管,TRPV4下调可能会导致血管紧张素Ⅱ诱导的内皮功能障碍。此外,TRPV4通道在血管生成和动脉发生中起重要作用,它参与了血流剪切应力引起的动脉侧支生长,是治疗主动脉闭塞或狭窄的有效靶点[8]。
心力衰竭不仅会影响心脏和血管,还会影响肺部,肺充血是心力衰竭的标志性特征之一。来自啮齿动物肺部的证据表明,高肺静脉压诱导的肺水肿是由肺毛细血管内皮TRPV4通道的激活驱动的,Thorneloe等[9]研究进一步表明TRPV4在充血型心力衰竭患者的肺组织中表达增加。
2.2.2 肺动脉高压 心力衰竭可分为左心衰竭和右心衰竭,其中,左心衰竭会引起全心衰竭,继而累及右心室,从而出现肺动脉高压。在肺动脉平滑肌细胞中,激活5-羟色胺受体可以导致TRPV4介导Ca2+流入,可能介导肺动脉平滑肌细胞增殖[10]。有研究表明,TRPV4通道参与肺动脉高压的外膜成纤维细胞活化和外膜重塑,该项研究首次证明了TRPV4通道在外膜重塑中的作用[11]。以上研究提示,TRPV4是治疗肺动脉高压的潜在有效靶点,值得进一步研究。
2.2.3 高血压 研究表明,高盐饮食诱发的心血管疾病(如高血压)中TRPV4与血管张力的调节密切相关[12]。高血压小鼠的TRPV4通道被抑制,无法介导Ca2+内流入细胞内,继而导致TRPV4在血管舒张中的作用被抑制。
在离体肠系膜动脉中的正常生理情况下,当内皮细胞受到刺激时,细胞膜上的TRPV4通道打开,引起胞外的Ca2+内流,继而引起下游的KCa2.3通道的打开,K+外流,使得膜电位趋于极化,通过肌内皮间隙连接扩散到相邻的平滑肌细胞,同时引起血管舒张[13]。研究发现,TRPV4与KCa2.3不仅是上下游的关系,两者在生理和功能上相互作用,在内皮细胞中,两者耦联成为一个复合体,刺激内皮依赖性的超极化因子(endothelium derived hyperpolarizing factor,EDHF)介导的信号传导和随后的血管舒张。TRPV4-KCa2.3复合体相互作用,是高盐饮食诱发的高血压小鼠小动脉中EDHF介导的反应减少的基础[14]。可见TRPV4-KCa2.3通道在高血压疾病中发挥着重要作用。
2.2.4 急性肺损伤 急性肺损伤(acute lung injury,ALI)是各种直接和间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,导致急性低氧性呼吸功能不全。缺血再灌注诱导的水肿形成是肺移植后导致发病和死亡的最常见也是最重要的原因之一,最近一项在离体的灌注小鼠肺(iolated perfused mouse lungs,IPL)中进行的体外模拟实验表明,与野生型对照相比,TRPV4缺陷型(TRPV4-/-)IPL的水肿形成增强,表明TRPV4对维持肺泡上皮屏障具有保护作用。该研究突出了TRPV4通道在肺泡上皮细胞和防止水肿形成方面的新的功能[15]。
3 TRPV4通路的激活和调控
3.1 TRPV4相关信号通路(见图1)

图1 不同外部刺激下的TRPV4信号通路Fig 1 TRPV4 signal pathway under different external stimuli
蛋白激酶C(protein kinase C,PKC)对丝氨酸162、丝氨酸189以及苏氨酸175的磷酸化使表达TRPV4的人胚胎肾细胞293对低渗应激敏感;同时蛋白激酶A(protein kinase A,PKA)对丝氨酸824的依赖性磷酸化使TRPV4通道蛋白对低渗应激敏感[16]。TRPV4激动剂4α-佛波醇-12,13-十二烷酸酯(4α-phorbol-12,13-didecanoate,4α-PDD)和温度(>27℃),可能会通过血清糖皮质激素蛋白激酶1(serum glucocorticoid protein kinase-1,SGK1)机制对TRPV4的824丝氨酸进行磷酸化[17]。在 HeLa细胞中,Src家族激酶对苏氨酸110和苏氨酸805的磷酸化也显示出TRPV4对热、剪切应力、低渗肿胀和4α-PDD敏感[17]。可见,磷酸化可以调节TRPV4活性以响应多种刺激。
3.2 TRPV4在体内的调控方式
3.2.1 依赖Ca2+的调控方式 在平滑肌中,TRPV4被内皮衍生的代谢产物环氧二十碳三烯酸(epoxyeicosatrienoic acid,EET)激活,导致大的电导钾通道激活和平滑肌超极化。内皮细胞在血管内稳态中起主要作用,其机制独立于复杂的信号级联。这一机制可将大量钙离子快速转运到细胞内,导致钙依赖性一氧化氮(nitric oxide,NO)合成酶的激活,从而诱导NO的产生,引起NO依赖性血管舒张。已有研究证明在小鼠颈动脉细胞中,TRPV4通道可在完整的动脉内皮细胞中产生一个独特的局灶性Ca2+瞬变群体,表明它们在血管内稳态中起到重要的调控作用[18]。
3.2.2 渗透调节 TRPV4可以在细胞对低渗的反应中被激活,因此,它被认为是一种机械或渗透传感器。TRPV4通过渗透压的变化随时监测细胞和响应环境,对细胞功能和生存至关重要。研究表明,细胞体积的变化是影响TRPV4活性的重要调节因子,细胞肿胀继而导致该通道激活[19]。
3.2.3 机械调节 有研究团队评估TRPV4在将小鼠胆管上皮细胞膜液流的机械作用转化为Ca2+浓度和胆汁分泌增加方面的潜在作用,证明了TRPV4是胆管上皮中的一个功能性机械敏感通道。TRPV4通过将液体流动转化为细胞内钙信号,是胆管机械敏感信号传导的重要启动者,也是胆管内胆汁形成所必需的顶端信号复合体的重要成员[20]。
4 TRPV4激动剂和拮抗剂
4.1 天然和合成激动剂
已发现的常见TRPV4激动剂有双穿心莲内酯A(bisandrographolide A,BAA)、4α-PDD、4α-佛波醇-12,13-二己酸酯(4α-phorbol-12,13-dihexanoate,4α-PDH)和GSK1016790A,其结构如图2所示,均能有效激活人TRPV4。
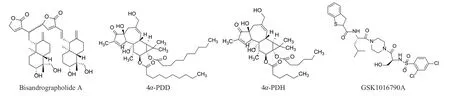
图2 已开发的TRPV4激动剂Fig 2 Developed TRPV4 agonists
4.1.1 BAA David E.Clapham团队使用钙成像分析筛选了50种中草药的提取物库,发现从穿心莲中分离的提取物BAA可以激活TRPV4(EC50=950 nmol·L-1),并且在完全激活TRPV4通道的浓度下对TRPV1~3通道没有影响[21]。
4.1.2 4α-PDD和4α-PDH 4α-PDD是靶向TRPV4的合成化合物,研究发现TRPV4的S3~S4区域是形成4α-PDD激活通道的重要位点。随后,新的 4α-PDD衍生物激动剂被设计和测试用于激活TRPV4通道。4α-PDH显示出非常高的TRPV4激活功效(EC50=70 nmol·L-1),其效力是4α-PDD的5倍,且比未修饰的4α-PDD更稳定。该研究表明,4α-PDD激活下的TRPV4通道在细胞外Ca2+存在下会增加内皮细胞通透性,继而引起血管舒张[22]。
4.1.3 GSK1016790A 葛兰素史克公司通过筛选小分子文库鉴定了另一种完全合成的TRPV4激动剂——GSK1016790A(EC50=1~10 nmol·L-1)。GSK1016790A是TRPV4的特异性小分子激动剂,与传统的4α-PDD(EC50在微摩尔范围内)相比,它已被证明是一种更有效的激活剂(EC50在纳摩尔水平)。研究表明,GSK1016790A在多种细胞类型中刺激TRPV4通道,包括内皮细胞、尿平滑肌细胞、尿路上皮细胞和过度表达TRPV4的HEK-293细胞[23]。浓度在1 nmol·L-1以上时,GSK1016790A在表达鼠源和人源TRPV4的HEK细胞中引发Ca2+的流入(EC50分别为18和2.1 nmol·L-1),引起剂量依赖式的TRPV4全细胞电流的激活。GSK1016790A特异性激活TRPV4,引发质膜上该通道的表达下调、快速部分脱敏。但是由于TRPV1和TRPV4在 S3~S4 区域显示出一定程度的相似性(60%同源性,40%同一性),GSK1016790A对 TRPV1也有一定的抑制作用(EC50=50 nmol·L-1),在3个物种(小鼠、大鼠和狗)的动物实验中,静脉注射 GSK1016790A的确会导致血压成剂量依赖性降低,但随后会出现严重的循环衰竭,导致体内引起严重的血管效应,进而导致内皮屏障的破坏,并且这种循环衰竭是肺、肠和肾中严重血管渗漏和组织出血的结果[24]。因此,TRPV4激动剂不太可能成为有效的治疗剂,限制了研究人员对激动剂的进一步研究开发。
4.2 TRPV4拮抗剂
已经报道了几种非选择性TRPV4拮抗剂,其中比较常见的拮抗剂见图3。
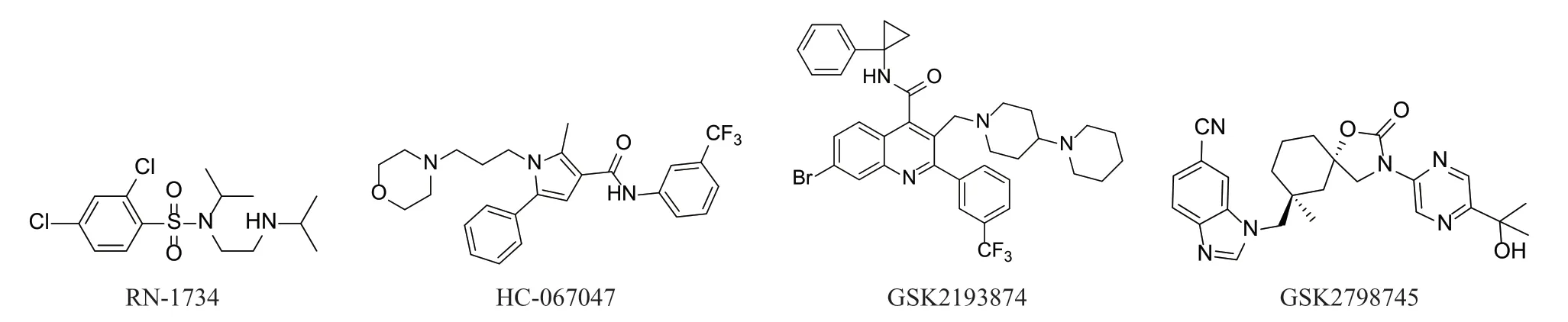
图3 已开发的TRPV4拮抗剂Fig 3 Developed TRPV4 antagonist
4.2.1 RN-1734 RN-1734对TRPV4通道具有选择性,对于hTRPV4、mTRPV4和rTRPV4的IC50值分别为2.3、5.9和3.2 μmol·L-1[25]。
4.2.2 HC-067047 HC-067047是另一个被广泛使用的TRPV4拮抗剂,在环磷酰胺诱导的膀胱炎小鼠和大鼠模型中显示出增加膀胱功能的作用(IC50分别为133 nmol·L-1和17 nmol·L-1),对人TRPV4的IC50为48 nmol·L-1。研究表明HC-067047可阻断人的肺动脉平滑肌细胞中的TRPV4电流和Ca2+信号[26-27]。有研究首次发现,在脂多糖(lipopolysaccharide,LPS)诱导的抑郁小鼠模型中海马体TRPV4显著增加,使用 TRPV4 抑制剂 HC067047 或敲低海马 TRPV4,可以减弱其抑郁行为。该研究也表明了TRPV4通道可能在改善神经炎症介导的抑郁症方面是一个潜在靶点[28]。
4.2.3 GSK2193874 葛兰素史克公司于2017年报道了一种具有口服活性、特异性和选择性的TRPV4抑制剂——GSK2193874,它通过重组TRPV4通道和天然内皮TRPV4电流来抑制Ca2+内流[29]。在离体啮齿动物和犬的肺中,GSK2193874可防止血管通透性增加以及肺动脉高压引起的肺水肿。同时,当GSK2193874剂量高达30 mg·kg-1时,对大鼠的血压或心率均无影响。此外,在急性和慢性心力衰竭模型中,GSK2193874预处理可以抑制肺水肿的形成并增强动脉氧合。GSK2193874同时具有优良的跨物种TRPV4效力,在大鼠中,其静脉注射的清除率(CL)=7.3 mL/(min·kg),口服给药的半衰期(t1/2)=10 h,生物利用度(F)=31%;在狗中,其静脉注射的CL=6.9 mL/(min·kg),口服给药的t1/2=31 h,F=53%。综上,GSK2193874作为慢性口服药物,具有清除率低、口服生物利用度高、对其他 TRP 通道选择性好、无血流动力学影响等优良特点。这些历史悠久的药物已作为体内和体外药理学工具被广泛应用,但其仍存在一些选择性问题和安全性问题,影响了其进一步的临床研究。
4.2.4 GSK2798745 葛兰素史克公司通过高通量筛选发现了另一TRPV4拮抗剂GSK2798745。2019年,GSK2798745因其良好的体内药效动力学效应和临床前安全性被报道,其在人体内的平均全身半衰期约为13 h,IC50=1.8 nmol·L-1[30]。在健康志愿者和心力衰竭受试者中完成的Ⅰ/Ⅱa期试验表明,其体外测定的效力值与肺水肿大鼠体内药代动力学/药效学模型预测的值一致,GSK2798745可以在很大程度上阻断肺血管内皮细胞中的TRPV4通道。GSK2798745在健康志愿者(服用量达14 d)和心力衰竭患者(服用量达7 d)中均没有观察到明显的安全问题,表明其可以在心力衰竭以及其他适应证的长期临床研究中进行评估。迄今为止,GSK2798745是唯一一种在人体中进行研究的有效且具有选择性的TRPV4抑制剂[31]。
5 小结与展望
心血管疾病及其引发的一系列并发症给患者的生理和心理上都带来巨大的痛苦。TRPV4在细胞中表达广泛,尤其是在血管内皮细胞中的高表达,使其成为治疗心血管疾病的潜在有效靶点,具有广泛的应用前景。
当前TRPV4激动剂作为药物的发展明显滞后于TRPV4拮抗剂,这是由于TRPV4的不当激活会产生与内皮损伤和肺微血管通透性屏障破坏相关的急性循环衰竭。而当前的临床试验提示我们TRPV4拮抗剂可以治疗充血性心力衰竭症状,以及其他涉及TRPV4的病理症状,其作为心血管疾病治疗药物具有很大的潜力。但TRPV4拮抗剂仍存在一些亟待解决的问题,一方面,已有的TRPV4拮抗剂在大多数情况下特异性较差,它们可能会作用于TRPV家族其他亚型而产生不良反应;另一方面,目前TRPV4拮抗剂数量非常有限,临床研究报道较少。针对以上问题,开发特异性的TRPV4拮抗剂是目前的重要研究方向。在未来,期待更多的TRPV4拮抗剂的发现以及更多对TRPV4拮抗剂的临床疗效评价。
