麸炒枳壳标准汤剂指纹图谱及抗氧化活性研究
2022-09-13张胜娜周衡朴刘英杰吴素香林洁朱志红瑞安市中医院浙江瑞安500浙江中医药大学杭州400温州医科大学附属第三医院浙江瑞安500
张胜娜,周衡朴,刘英杰,吴素香,林洁,朱志红*(.瑞安市中医院,浙江 瑞安 500;.浙江中医药大学,杭州 400;.温州医科大学附属第三医院,浙江 瑞安 500)
麸炒枳壳为芸香科植物酸橙Citrus aurantiumL.及其栽培变种的干燥未成熟果实枳壳的炮制品,用于理气宽中,行滞消胀等[1-3]。中药饮片标准汤剂能作为一种标准,标化不同的临床用药形式,提高用药的准确性和剂量的一致性[4-7];中药配方颗粒是传统中药饮片、汤剂的改良产品,是中药现代化的重要成果,中药饮片经提取研究制备成标准汤剂,然后采用不同的方法制成中药配方颗粒,因此对中药饮片的标准汤剂进行质量控制也是有必要的。本研究遵循标准汤剂制备要求,制备麸炒枳壳标准汤剂,采用冷冻干燥技术将其制备成标准汤剂冻干粉,计算出膏率,以柚皮苷和新橙皮苷为指标成分,测定其含量,计算转移率,建立指纹图谱,为建立麸炒枳壳标准汤剂的质量标准提供参考;同时进行体外抗氧化活性研究,为麸炒枳壳标准汤剂的临床应用及麸炒枳壳配方颗粒的质量控制提供参考。
1 材料
1.1 仪器
Waters e2695 高效液相色谱仪(美国Waters科技有限公司);Free Zone 2.5L冷冻干燥机(美国Labconco公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);RE-3000旋转蒸发仪(上海亚荣生化仪器厂);Synergy H1酶标仪(美国伯腾公司)。
1.2 试药
柚皮苷(批号:110722-201815,纯度≥98%,中国食品药品检定研究院),新橙皮苷(批号:200155-160801,纯度≥98%,江苏永健医药科技有限公司),维生素C(北京索莱宝科技有限公司,批号:20240706),DPPH自由基清除能力试剂盒、羟自由基清除能力试剂盒、总抗氧化能力试剂盒(江苏艾迪生生物科技有限公司,批号:G20220114S),甲醇、乙腈(色谱级,美国天地有限公司),水为超纯水,其他试剂为分析级。
1.3 药材
麸炒枳壳共15批(FZK1~ FZK15),经瑞安市中医院副主任中药师刘英杰鉴定为芸香科植物酸橙Citrus aurantiumL.及其栽培变种的干燥未成熟果实枳壳的炮制品。经检验均符合《中国药典》2020年版规定,样品来源见表1。

表1 麸炒枳壳饮片的来源Tab 1 Source of Aurantii Fructus Praeparatus
2 方法与结果
2.1 麸炒枳壳标准汤剂冻干粉的制备及出膏率的测定
称取15批麸炒枳壳饮片各100 g,煎煮2次。一煎加入饮片8倍量水,浸泡30 min,武火煮沸,文火保持微沸30 min。二煎加入饮片6倍量水,武火煮沸,文火保持微沸30 min。趁热用3层纱布滤过,合并2次滤液,50℃减压浓缩至100 mL,冷冻干燥,得标准汤剂冻干粉,计算出膏率,结果见表2。

表2 麸炒枳壳标准汤剂测定结果Tab 2 Determination of Aurantii Fructus Praeparatus standard decoction
2.2 柚皮苷、新橙皮苷的测定
2.2.1 液相色谱条件 色谱柱:Agilent SB-C18(4.5 mm×250 mm,5 µm);流动相:乙腈-水(20∶80)(用磷酸调节pH值至3);检测波长:283 nm;流速:1 mL·min-1;进样量:10 μL;温度:30℃。供试品及对照品图谱见图1。

图1 枳壳标准汤剂HPLC图谱Fig 1 HPLC chromatogram of Aurantii Fructus Praeparatus standard decoction
2.2.2 对照品溶液的制备 取柚皮苷、新橙皮苷对照品适量,精密称定,加甲醇制成每l mL分别含柚皮苷和新橙皮苷80.19 μg、79.08 μg的溶液,即得。
2.2.3 供试品溶液的制备 取麸炒枳壳冻干粉或药材粉末约0.2 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称重,加热回流1.5 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过。精密量取续滤液10 mL,置25 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm微孔滤膜,即得。
2.2.4 线性关系考察 精密称取柚皮苷4.90 mg、新橙皮苷4.80 mg,用甲醇配制成含柚皮苷7.65~980.00 μg·mL-1、新橙皮苷7.50~960.00 μg·mL-1的系列对照品溶液,以峰面积(Y)对质量浓度(X,μg·mL-1)进行线性回归。结果柚皮苷的标准曲线为:Y=1.22×105X+6.67×105,r=0.9994,柚皮苷在7.65~980.00 μg·mL-1与峰面积线性关系良好;新橙皮苷的标准曲线为:Y=1.43×105X+1.87×105,r=0.9994,新橙皮苷在7.50~960.00 μg·mL-1与峰面积线性关系良好。
2.2.5 精密度试验 精密吸取对照品溶液10 μL,按“2.2.1”项下条件进样6次,结果柚皮苷和新橙皮苷峰面积RSD均为1.3%,说明仪器精密度良好。
2.2.6 稳定性试验 取麸炒枳壳冻干粉(批号:181101)约0.2 g,精密称定,按“2.2.3”项下方法制备供试品溶液,放置0、2、4、6、8、24 h后进样测定。测得柚皮苷和新橙皮苷峰面积RSD分别为1.3%和2.2%,说明供试品溶液在24 h内稳定。
2.2.7 重复性试验 取麸炒枳壳冻干粉(批号:181101)6份,每份约0.2 g,精密称定,按“2.2.3”项下方法制备供试品溶液,进样测定,结果柚皮苷和新橙皮苷含量RSD均为1.7%,说明该方法重复性良好。
2.2.8 加样回收试验 精密称取6份同一批已知柚皮苷、新橙皮苷含量的麸炒枳壳冻干粉40 mg,加入柚皮苷、新橙皮苷含量100%的对照品,按“2.2.3”项下方法制备供试品溶液,进样测定,计算加样回收率。柚皮苷和新橙皮苷平均加样回收率分别为100.25%和100.76%,RSD分别为0.85%和0.81%,表明该方法准确可靠。
2.3 样品的含量测定
取15批麸炒枳壳冻干粉供试品溶液进样测定,使用外标两点法制作随行标准曲线,计算柚皮苷、新橙皮苷含量。进样测定峰面积,测定15批麸炒枳壳中柚皮苷、新橙皮苷含量[1],计算转移率。
转移率(%)=冻干粉中指标成分含量/饮片中指标成分含量×100%
15批麸炒枳壳的出膏率为10.42%~16.51%;柚皮苷的含量为7.27%~12.81%,转移率为19.04%~42.26%;新橙皮苷含量为4.98%~8.72%,转移率为13.87%~24.19%(见表2)。
2.4 麸炒枳壳标准汤剂指纹图谱的建立
2.4.1 色谱条件色谱柱:Agilent SB-C18(4.5 mm×250 mm,5 µm);流动相:甲醇(A)-水(B),梯度洗脱(0~20 min,25%~40%A;20~44 min,42%~62%A;44~50 min,62%~80%A;50~60 min,80%~100%A;60~70 min,100%~25%A);检测波长:330 nm;流速:1 mL·min-1;进样量:10 μL;柱温:30℃。
2.4.2 精密度试验 精密吸取“2.2.2”项下对照品溶液10 μL,按“2.3.1”项下条件进样6次,测得柚皮苷保留时间和峰面积RSD分别为0.15%和2.4%,新橙皮苷保留时间和峰面积RSD分别为0.16%和2.5%,说明仪器精密度良好。
2.4.3 稳定性试验 取麸炒枳壳冻干粉(批号:181101)约0.2 g,精密称定,按“2.2.3”项下方法制备供试品溶液,放置0、2、4、6、8、24 h后,进样测定。结果柚皮苷保留时间和峰面积RSD分别为0.76%和4.1%,新橙皮苷保留时间和峰面积RSD分别为0.83%和4.1%,说明柚皮苷和新橙皮苷在24 h内稳定。
2.4.4 重复性试验 取麸炒枳壳冻干粉(批号:181101)6份,每份约0.2 g,精密称定,按“2.2.3”项下方法制备供试品溶液,进样测定,柚皮苷保留时间和峰面积RSD分别为0.18%和3.0%,新橙皮苷保留时间和峰面积RSD分别为0.21%和4.8%,说明该方法重复性良好。
2.4.5 指纹图谱相似度分析 精密吸取各批供试品溶液10 μL,注入高效液相色谱仪得指纹图谱,采用“中药色谱指纹图谱相似度评价系统”软件进行色谱峰匹配,找出共有峰。结果表明15批麸炒枳壳标准汤剂指纹图谱中共出现12个共有峰,且分离度较好,见图2。以FZK1为参照,采用中药色谱指纹图谱相似度评价系统(2012A)软件,分析色谱数据,计算相似度,依次为0.988、0.992、0.989、0.989、0.993、0.997、0.995、0.993、0.992、0.993、0.981、0.966、0.992、0.988、0.988,15批麸炒枳壳标准汤剂相似度均大于0.95,符合指纹图谱要求(大于0.9)。

图2 麸炒枳壳标准汤剂指纹图谱Fig 2 Fingerprints of Aurantii Fructus Praeparatus standard decoction 6.柚皮苷(naringin);8.新橙皮苷(neohesperidin)
2.4.6 聚类分析 将共有峰峰面积导入SPSS 26进行聚类分析,结果见图3。15批麸炒枳壳可分为两类:I类是FZK2、FZK3、FZK4、FZK6、FZK7、FZK11、FZK12,Ⅱ类是FZK1、FZK5、FZK8、FZK9、FZK10、FZK13、FZK14、FZK15。结果表明不同产地不同批次的麸炒枳壳存在一定差异。

图3 麸炒枳壳标准汤剂聚类分析图Fig 3 Cluster analysis of Aurantii Fructus Praeparatus standard decoction
2.4.7 主成分分析 使用SPSS 26软件对数据标准化后进行主成分分析,设定特征值大于1,结果见表3。共筛选出3个主成分,第3个成分的累积方差贡献率达83.831%。表明多种成分引起麸炒枳壳的质量差异,且前3个主成分能反映麸炒枳壳的基本特征。以这3个成分绘制主成分平面得分图(见图4),可将样品分为两类,与聚类分析结果一致。
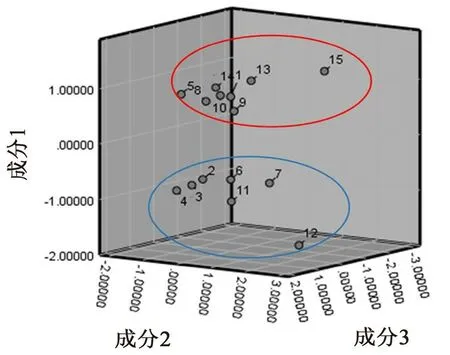
图4 主成分得分图Fig 4 Principal component score

表3 主成分方差分析结果Tab 3 Variance analysis of principal component
2.5 体外抗氧化作用
2.5.1 供试品溶液的配制
① 麸炒枳壳标准汤剂供试品溶液:取一定量的麸炒枳壳标准汤剂冻干粉,用纯水配制成1、10、50、100、500、1000、2500 μg生 药·mL-1系列质量浓度的供试品溶液,备用。
② 麸炒枳壳药材供试品溶液:取麸炒枳壳药材,用80%乙醇回流提取2次,每次60 min,回收乙醇,浓缩液冷冻干燥,冻干粉用纯水配制成1、10、50、100、500、1000、2500 μg生药·mL-1系列质量浓度的供试品溶液,备用。
③ 维生素C供试品溶液:取一定量的维生素C,纯水配制成1、10、50、100、500、1000、2500 μg·mL-1系列质量浓度的供试品溶液,备用。注意避光。
2.5.2 体外抗氧化试验 按说明书中方法,以维生素C和水溶性维生素E(Trolox)为对照,进行试验,结果见图5。

图5 各成分的ABTS自由基清除能力(A)、DPPH自由基清除能力(B)、总抗氧化能力(C)Fig 5 Scavenging effect of Aurantii Fructus Praeparatus standard decoction on ABTS(A),DPPH(B)and total antioxidant capacity(C)
ABTS自由基清除能力结果显示,当质量浓度为2500 μg·mL-1时,枳壳标准汤剂ABTS自由基清除能力可达(80.42±11.93)%,稍弱于维生素C,强于枳壳药材。说明枳壳标准汤剂和枳壳药材具有一定的抗氧化能力,且枳壳标准汤剂>枳壳药材。
DPPH自由基清除能力结果显示,当质量浓度为2500 μg·mL-1时,枳壳标准汤剂DPPH自由基清除能力可达(94.98±8.65)%,与维生素C的清除能力相当,说明枳壳标准汤剂和枳壳药材具有良好的DPPH自由基清除能力。
总抗氧化能力结果显示,当质量浓度为100 μg·mL-1时,维生素C的Frap值为(0.4756±0.0211),枳壳标准汤剂的Frap值为(0.1847±0.0258),枳壳药材的Frap值为(0.1576±0.0132),说明枳壳标准汤剂和枳壳药材有一定的总抗氧化能力。
3 讨论
3.1 色谱条件的筛选
在建立麸炒枳壳标准汤剂指纹图谱的过程中,考察了甲醇、乙腈、磷酸水等作为流动相以及不同流动相梯度对指纹图谱的影响,最终确定了以甲醇-水为流动相,检测波长为330 nm,流速为1 mL·min-1,进样量为10 μL,柱温为30℃,此时色谱峰数最多且分离度均较好。
3.2 标准汤剂质量控制
2020年版《中国药典》中,枳壳的含量测定指标是柚皮苷和新橙皮苷,麸炒枳壳标准汤剂中柚皮苷和新橙皮苷的含量和转移率均较高,体现了其质量稳定、有效成分含量高。麸炒枳壳标准汤剂指纹图谱中特征峰超过10个,各批次麸炒枳壳图谱相似度高,该方法适用于麸炒枳壳标准汤剂质量控制。
3.3 抗氧化作用
本试验比较了枳壳标准汤剂和枳壳药材的体外抗氧化活性,枳壳标准汤剂和枳壳药材均具有一定的抗氧化能力,但测得的几项标准汤剂抗氧化活性均强于药材。可能是标准汤剂中多糖、苷类、蛋白质、氨基酸等水溶性成分含量较高,且这些成分均具有一定的抗氧化作用[8-9]。
3.4 小结
枳壳含有黄酮类、生物碱类等成分,柚皮苷和新橙皮苷为黄酮类的主要成分,麸炒后含量均略微下降[10]。本试验可为麸炒枳壳饮片的质量控制和临床应用提供依据。
