塞来昔布胶囊体内外相关性的研究
2022-09-13丁强金波管志美王彬周莎莎殷美园刘雁鸣刘翔天地恒一制药股份有限公司长沙40湖南省骨关节疾病药物工程技术研究中心长沙40湖南省药品审核查验中心长沙400国家药品监督管理局药用辅料工程技术研究重点实验室长沙4000湖南省药品质量评价工程技术研究中心长沙4000
丁强,金波,2*,管志美,王彬,4,周莎莎,4,殷美园,刘雁鸣,刘翔*(.天地恒一制药股份有限公司,长沙 40;2.湖南省骨关节疾病药物工程技术研究中心,长沙 40;.湖南省药品审核查验中心,长沙 400;4.国家药品监督管理局药用辅料工程技术研究重点实验室,长沙 4000;5.湖南省药品质量评价工程技术研究中心,长沙 4000)
塞来昔布是辉瑞公司开发的可用于缓解骨关节炎、类风湿关节炎及治疗成人急性疼痛的特异性环氧化酶-2抑制剂。与传统的非甾体抗炎药相比,其在保留较好疗效的同时,可显著减少胃肠道不良反应[1],无论是急性创伤外伤导致的急性疼痛,还是外科手术后的止痛,都是理想的镇痛药物[2]。
随着仿制药质量一致性评价工作的日益深入,通过良好设计保证仿制药与原研制剂质量的一致性十分重要,其中溶出度试验作为评价固体制剂内在质量的重要手段,也是一种评价药物在体内释放和吸收的有效手段[3]。对于具有良好体内-体外相关性的药物,可以通过测定体外溶出度来预测药物的体内生物利用度,进而用于制剂的处方筛选和质量评价[4],因此建立良好的具有体内外相关性的溶出曲线对于仿制药的质量评价有重要的意义。根据生物药剂学分类(BCS),塞来昔布属于BCSⅡ类药物,由于塞来昔布难溶于水,其溶出快慢会直接影响药物在体内的吸收和利用。目前已有塞来昔布胶囊溶出曲线测定及生物等效性研究的文献报道[5-8],尚未见塞来昔布胶囊体内外相关性溶出曲线的研究,本文旨在以进口塞来昔布胶囊(西乐葆)作为参比制剂,通过筛选具有一定区分力的溶出曲线,并将不同溶出行为的自研制剂与参比制剂进行生物等效性研究,从而建立塞来昔布胶囊具有一定体内外相关性的溶出曲线,为仿制药一致性评价提供依据。
1 材料
1.1 仪器
RT-600锐拓溶出仪(锐拓仪器设备有限公司);PB-10 pH计(北京赛多利斯科学仪器有限公司);NewClassic MS105DU电子天平(梅特勒·托利多公司,精度0.01 mg);MP1100B电子天平(上海舜宇恒平科学仪器有限公司,精度0.01 g);FAVD-25智能真空脱气仪(上海富科思分析仪器有限公司);微孔滤膜(MCE,0.45 μm,天津市津腾实验设备有限公司);TU-1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 试药
塞来昔布胶囊(规格:0.2 g,西乐葆,批号:L61633、N92682、T94942,Pfizer Pharmaceuticals LLC);塞来昔布胶囊(规格:0.2 g,批号:170101、181201,天地恒一制药股份有限公司);塞来昔布对照品(纯度:99.9%,批号:2.0,EDQM);甲醇(色谱纯,Sigma试剂公司);磷酸三钠(分析纯,国药集团化学试剂有限公司);盐酸、冰醋酸、氢氧化钠、三水合乙酸钠(分析纯,湖南汇虹试剂有限公司);十二烷基硫酸钠(SLS,分析纯,湖北葛店人福药用辅料有限责任公司);十六烷基三甲基溴化铵(CTAB,分析纯,天津市光复精细化工研究所);水为自制纯化水。
2 方法与结果
2.1 pH-溶解度的考察
塞来昔布属于BCSⅡ类即低溶解度高渗透性药物[9-10],其在pH值1.0~6.8的缓冲液中几乎不溶。根据《普通口服固体制剂溶出度试验技术指导原则》,溶出介质通常采用水、0.1 mol·L-1盐酸、缓冲液(pH 3~8)。本研究初步选择在水、pH 1.0盐酸、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液以及pH 12.0磷酸三钠溶液中进行溶出介质的选择,并测定了原料药在不同pH介质及加入不同浓度的表面活性剂介质中的饱和溶解度,结果见表1。
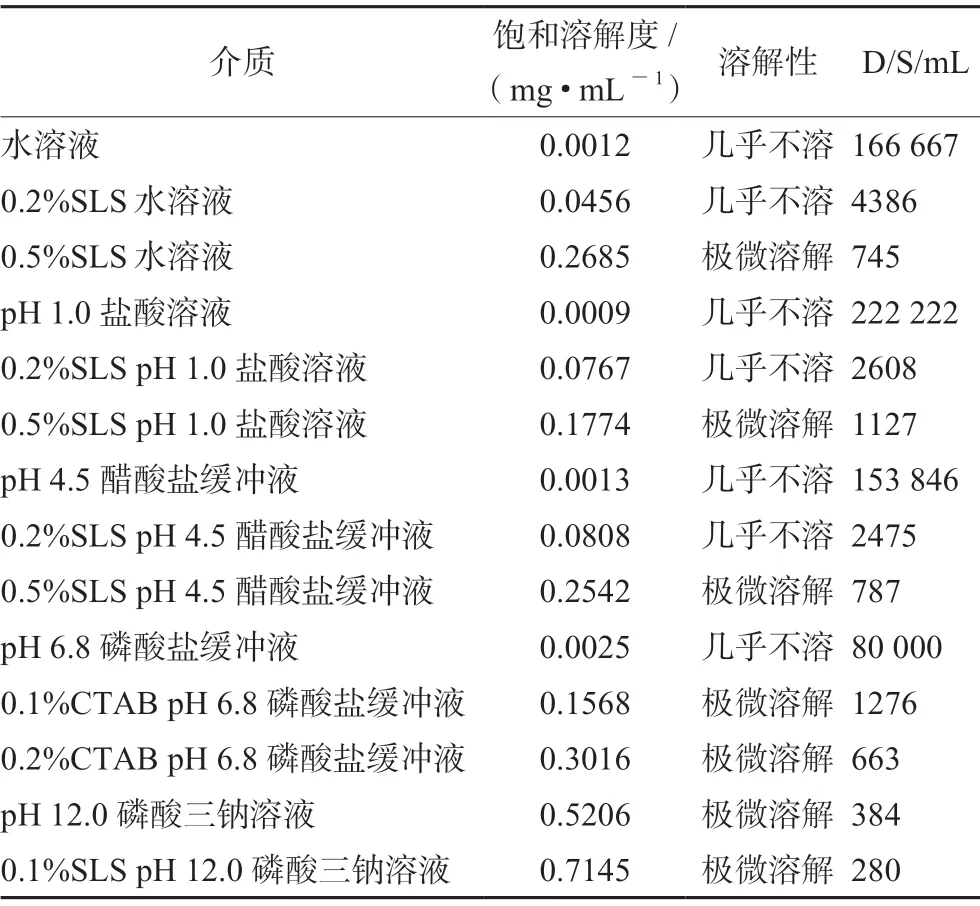
表1 塞来昔布在不同介质中的饱和溶解度Tab 1 Saturated solubility of celecoxib in different media
结果表明,塞来昔布在pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液及水溶液中几乎不溶,在pH 12.0磷酸三钠溶液中极微溶解,相对于其他介质溶解度有明显提高,在各介质中加入表面活性剂后,原料药溶解度显著提高。塞来昔布单次给药的最高剂量为200 mg(D值),根据测定的饱和溶解度(S值),计算塞来昔布的D/S值,结果表明本品在各介质中溶解所需体积远大于250 mL,为低溶解性药物。
2.2 溶出度试验条件的选择
2.2.1 溶出方法的选择 本品为常规胶囊剂,《普通口服固体制剂溶出曲线测定与比较指导原则》中推荐溶出方法为桨法、篮法。美国食品药品监督管理局(FDA)溶出度方法数据库中塞来昔布胶囊的溶出方法为桨法,50 r·min-1,溶出介质是1%SLS的0.04 mol·L-1磷酸三钠溶液(pH 12.0)1000 mL[11]。塞来昔布胶囊进口药品注册标准(JX20130156)[12]中溶出度方法也采用相同的方法,故首选桨法作为本品的溶出方法。
2.2.2 检测方法的选择 塞来昔布胶囊进口药品注册标准(JX20130156)中溶出度的检测方法为高效液相色谱法(HPLC),检测波长为256 nm。考虑到溶出曲线测定样品检测量较大,本研究选择方便快捷的紫外-可见分光光度法(UV)进行考察。方法学研究结果表明塞来昔布具有较好的紫外吸收,并且辅料和胶囊壳不干扰塞来昔布的测定,塞来昔布在0.005~0.120 mg·mL-1与吸光度线性关系良好,方法精密度良好(RSD为0.73%),高、中、低三个浓度的样品平均回收率均在98.52%~101.65%,回收率的RSD在0.84%~1.2%。
2.2.3 溶出介质的选择 根据pH-溶解度考察结果,在满足完全溶出的条件下,为了寻找具备良好区分力的溶出条件,选择以1000 mL低浓度表面活性剂的缓冲液为介质进行溶出曲线的考察,结果如表2所示。
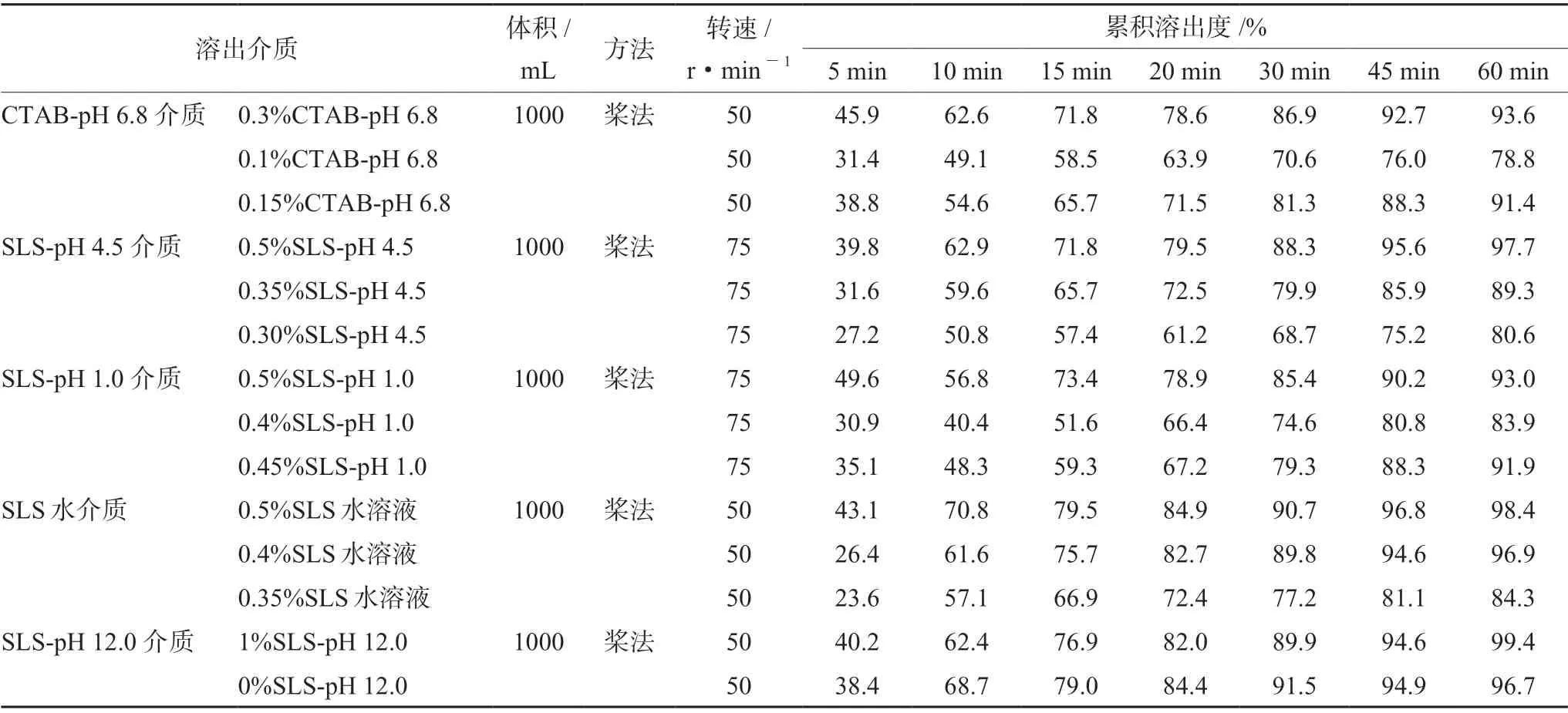
表2 参比制剂在5种不同介质中溶出度的考察Tab 2 Dissolution of reference drug in 5 different media
根据上述研究结果选用低浓度SLS,在满足主药溶出完全的情况下,又具有适当的区分力。最终确定的溶出介质为0.45%SLS的pH 1.0盐酸溶液、0.35%SLS的pH 4.5醋酸盐缓冲液、0.15%CTAB的pH 6.8磷酸盐缓冲液、0.4%SLS的水溶液和pH 12.0磷酸三钠溶液。
2.2.4 样品测定方法 取塞来昔布胶囊,采用桨法,溶出介质为0.15% CTAB的pH 6.8磷酸盐缓冲液、0.4%SLS的水溶液和pH 12.0磷酸三钠溶液1000 mL,转速为50 r·min-1;另外以0.45%SLS的pH 1.0盐酸溶液和0.35%SLS的pH 4.5醋酸盐缓冲液1000 mL为溶出介质,转速为75 r·min-1;分别在第5、10、15、20、30、45、60 min时,取溶出液10 mL,同时补充相同体积和温度的溶出介质,0.45 μm滤膜过滤,弃去初滤液,精密量取溶出液续滤液1 mL,加溶出介质稀释至20 mL,摇匀,作为供试品溶液。另取塞来昔布对照品适量,精密称定,加甲醇-水(75∶25)溶液溶解并稀释制成0.5 mg·mL-1塞来昔布,摇匀,作为对照品储备液,精密量取对照品储备液适量,加溶出介质定量稀释制成0.01 mg·mL-1塞来昔布的溶液,作为对照品溶液。照UV法,在256 nm的波长处测定供试品溶液及对照品溶液的吸光度,按外标法以吸光度计算溶出量并绘制溶出曲线。
2.3 自研制剂与参比制剂的溶出曲线考察
根据《普通口服固体制剂溶出度试验技术指导原则》,采用非模型依赖法相似因子(ƒ2)来比较溶出曲线。ƒ2可作为评价产品处方工艺变化以及与参比制剂间溶出曲线差异的评价参数,被FDA 推荐为比较两条溶出曲线相似性的首选方法[13],当ƒ2在50~100,则认为两者溶出曲线相似。为探索不同处方制备的自研制剂与参比制剂的体内外一致性情况,我们选择采用不同SLS和聚维酮K30用量制备的两组样品进行研究,考察不同介质条件下自研制剂的溶出行为,两组自研制剂处方组成如表3所示,自研制剂与参比制剂溶出曲线对比如图1所示。
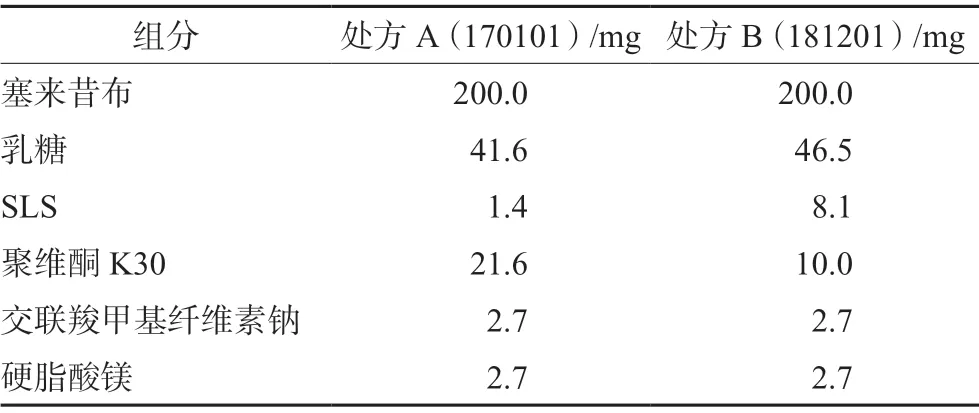
表3 不同处方组成研究Tab 3 Different formulations
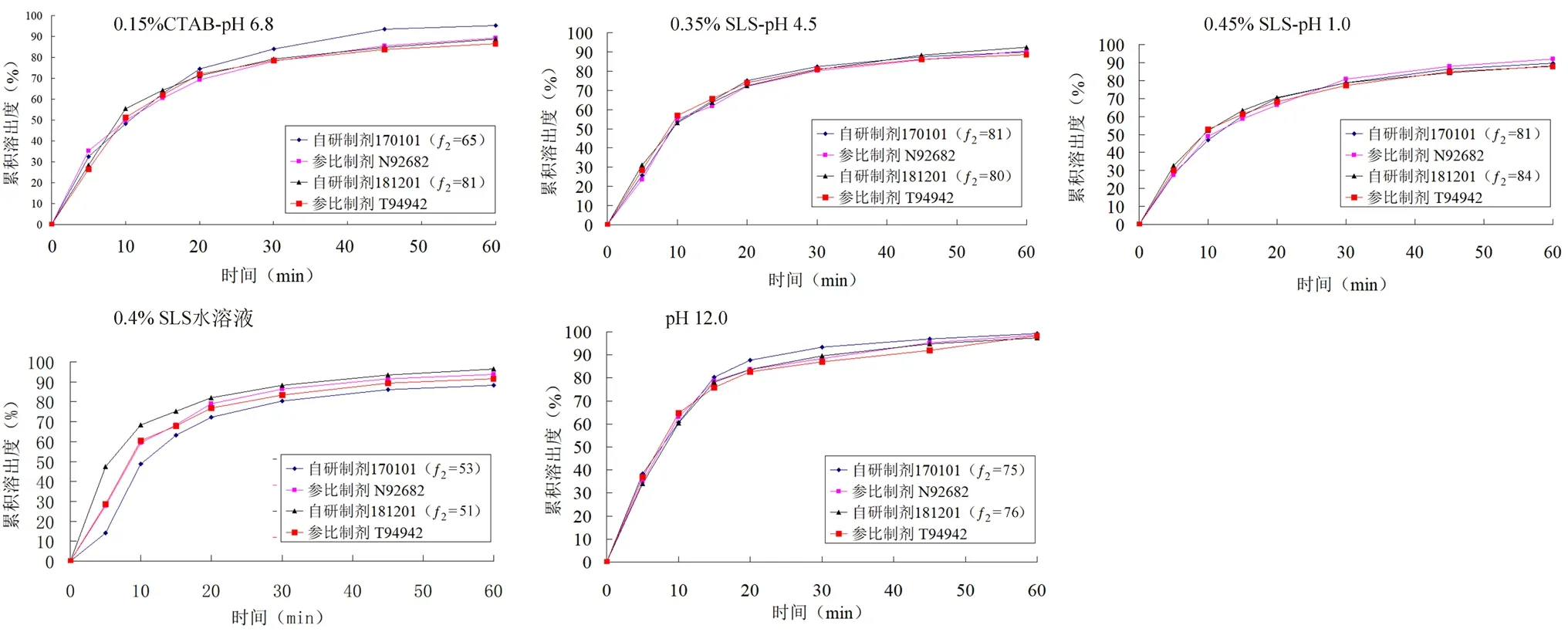
图1 自研制剂与参比制剂在不同溶出介质溶出曲线对比图Fig 1 Dissolution curve of self-prepared drug and reference drug in different dissolution medium
结果表明,自研制剂(170101)与参比制剂(N92682),自研制剂(181201)与参比制剂(T94942)在上述5种介质中的溶出曲线相似因子ƒ2值均大于50,表明自研制剂与参比制剂溶出曲线具有相似性。
2.4 自研制剂与参比制剂的生物等效性试验
为进一步评价自研制剂与参比制剂的一致性,本试验研究了健康受试者在空腹状态下,单次口服两种不同处方制备的胶囊与辉瑞制药的塞来昔布胶囊的药动学特征,比较两制剂药动学参数AUC和Cmax的差异,初步评估生物等效性,为制剂处方工艺是否需进一步优化提供参考。
采用单中心、空腹、随机、开放、两制剂、两周期、双交叉试验设计,12例健康受试者按筛选号顺序随机分为A、B两个给药序列组,每周期单次口服0.2 g 参比制剂或受试制剂,周期间的洗脱期为7 d。给药前禁食10 h以上,按照给药方案空腹服用试验制剂或参比制剂0.2 g(1粒),240 mL温水送服,服药前及服药后1 h内禁止饮水,服药后4、10 h统一进食标准午餐和晚餐。受试者分别于给药前(0 h)及给药后0.5、1、1.5、2、2.25、2.5、2.75、3、3.5、4、5、6、8、10、12、24、48 h采集静脉血4 mL,血样采集后置于肝素钠抗凝试管内,于1 h内在4℃、1600 g离心10 min分离血浆,立即将血浆于-40℃冰箱中进行预冻,样品在储存冰箱中放置2~48 h后置-80℃冰箱保存。采用LC-MS/MS法测定血浆中塞来昔布的浓度,采用WinNonlin软件非房室模型法计算塞来昔布的人体药动学参数[8],采用多因素多变量方差分析(ANOVA)进行个体间、制剂周期的显著性分析。Cmax、AUC0~t、AUC0~∞经对数转换后进行方差分析,计算几何均值比(GMR)的90%置信区间(90%CI),采用双单侧t检验方法进行等效性比较,等效标准为80%~125%。同时tmax进行Mann-Whitney U非参数检验。主要药动学参数见表4,塞来昔布的平均血药浓度-时间曲线见图2。
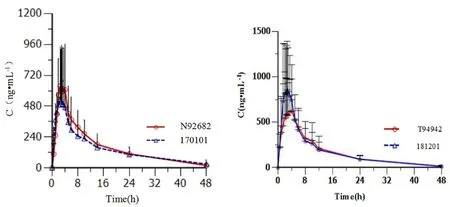
图2 自研制剂与参比制剂塞来昔布平均药时曲线Fig 2 Mean plasma concentration-time curve of celecoxib from the self-prepared drug and reference drug
表4 空腹口服塞来昔布胶囊的主要药动学参数(±s)Tab 4 Main pharmacokinetic parameters of oral celecoxib capsules under fasting condition (±s)

表4 空腹口服塞来昔布胶囊的主要药动学参数(±s)Tab 4 Main pharmacokinetic parameters of oral celecoxib capsules under fasting condition (±s)
PK参数 处方A(n=12) 处方B(n=12)自研制剂170101 参比制剂N92682 自研制剂181201 参比制剂T94942 Cmax/(ng·mL-1) 571.70±177.41 699.71±340.52 939.18±586.05 835.133±438.01 AUC0~t /(h·ng·mL-1) 7109.77±2013.90 7845.15±3168.55 8321.115±3428.96 7832.075±3191.45 AUC0~∞/(h·ng·mL-1) 8121.46±3497.70 8190.31±3445.55 8504.523±3418.26 8031.94±3268.39 tmax/h 2.40±0.64 3.00±0.93 2.417±0.99 3.583±2.27 t1/2/h 14.46±8.53 9.70±2.91 9.026±2.684 8.744±2.75 MRT0~t /h 13.22±2.73 12.44±2.11 10.64±1.82 11.23±1.99 MRT0~∞/h 19.13±11.97 14.33±3.74 11.94±2.60 12.47±3.30
2.5 生物等效性试验结果分析
多因素变量方差分析结果表明,自研制剂与参比制剂主要药动学参数Cmax、AUC0-t、AUC0-∞、t1/2及MRT在个体间、制剂间、周期间差异均无统计学意义(P>0.05),tmax值经Mann-Whitney U非参数检验亦表明不同制剂间差异无统计学意义(P>0.05)。采用双单侧t检验进行等效性比较,结果表明,处方A与B制备的制剂与参比制剂的AUC0~t、AUC0~∞的GMR(90%CI)分别为82.20%~106.52%、89.80%~110.67%和92.71%~123.69%、93.33%~123%,均落在80.00%~125.00%,显示具有生物等效性。而Cmax的GMR(90%CI)分别为68.54%~110.43%和104.52%~149.51%,表明不同处方条件下制备的自研制剂与参比制剂溶出速率存在差异。
3 讨论
FDA溶出数据库中塞来昔布胶囊测定的溶出介质为pH 12.0的磷酸三钠溶液,并非为生理pH值条件,且添加1%SLS以达到漏槽条件。实际研究表明pH 12.0介质中不添加表面活性剂基本可以达到漏槽条件。从pH 12.0介质的体外溶出曲线来看,不同处方制备的样品溶出曲线与参比制剂相似度较高,但从体内研究结果来看,两者之间以及和参比制剂比较均存在一定的差异,结合体内外数据该介质条件不具备体内外相关性。塞来昔布在生理相关pH值介质中的溶解度非常低,所以FDA溶出数据库中采用pH 12.0磷酸三钠溶液(1%SLS)为溶出介质。
Cmax和AUC是反映受试制剂和参比制剂吸收速率和吸收程度的参数,生物等效性试验的药时曲线显示处方A的自研制剂比参比制剂吸收速率慢,处方B的自研制剂比参比制剂吸收速率快。体外溶出曲线显示自研制剂与参比制剂在0.45%SLS的pH 1.0盐酸溶液、0.35%SLS的pH 4.5醋酸盐缓冲液和0.15%CTAB的pH 6.8磷酸盐缓冲液中具有很好的相似性,相似因子较高。在0.4%SLS的水溶液中,虽然两制剂与参比制剂的溶出曲线ƒ2值相对偏低(均在50左右),采用处方A的自研制剂比参比制剂溶出速度慢,而采用处方B的自研制剂比参比制剂溶出速度快,与体内研究的药动学参数及药时曲线变化趋势基本一致,因此该介质条件可能具有一定的体内外相关性。
体外溶出曲线是一种评价自研制剂与参比制剂差异的重要方法,通过体内外充分研究,找出具有区分力的溶出曲线,才能在仿制药处方工艺研究中科学评估自研制剂与参比制剂的差异。本研究所得的0.4%SLS的水溶液可能是具有区分力的溶出曲线,对塞来昔布胶囊的一致性评价及上市后持续质量评价均具有重要的参考指导意义。
