次氯酸钠溶液清净乙炔气的实验研究
2018-07-27尚国隆钟洁水
尚国隆 ,张 伟 ,钟洁水 ,杨 霞
(1.青岛科技大学计算机与化工研究所,山东 青岛 266042;2.甘肃银光聚银化工有限公司PVC厂,甘肃 白银 730900;3.青岛银科恒远化工过程信息技术有限公司,山东 青岛 266042)
电石法制聚氯乙烯中乙炔气是合成氯乙烯单体的原料之一,因电石含有硫磷等杂质,所生成的粗乙炔气中不可避免的含有H2S、PH3等杂质气体。这些杂质一方面使氯乙烯合成工艺中的触媒失效,造成成本浪费,降低氯乙烯产量,另一方面由于磷化氢(特别是P2H4)的自燃点较低,与空气接触易燃烧,威胁安全生产[1]。因此,乙炔气的清净是工业生产中必不可少的工序。
目前,国内主要采用浓硫酸法和次氯酸钠法达到乙炔清净的目的。由于浓硫酸法存在成本高,温度不易控制,废酸不易处理等一系列问题[2,3],因此国内多数厂家主要利用次氯酸钠(以下简称次钠)溶液的氧化性进行乙炔气的清净。次钠溶液的氧化性由溶液中含有的次氯酸根(ClO-)电离平衡生成的次氯酸(HClO)提供,主要受溶液pH值和有效氯含量的影响。pH值不同,溶液的氧化性产生差异[4],当pH值小于6时,次钠溶液中HClO的含量增多,此时溶液的氧化能力增强[5]。随着pH值的升高,溶液中OH-的含量增加,不利于HClO的形成,而且NaClO的氧化电位也降低,此时溶液的氧化能力减弱[6,7]。另外,溶液的有效氯含量也是衡量次氯酸钠氧化性能的另一指标[8]。有效氯含量越高,磷、硫等杂质去除的越彻底;但有效氯含量过高,氧化能力过强,反应过于激烈,副反应多,容易生成氯乙炔[9],影响乙炔纯度的同时,对生产操作安全也有一定影响。
但目前对不同有效氯含量及pH值的次钠溶液对乙炔气清净效果的研究很少,文献鲜有报导。工厂在生产中多采用经验值,一般采用有效氯含量为0.08%~0.10%,0.08%~0.12%,0.085%~0.12%,pH值为 6.5~7.5,6.5~8 或 7~8 的次氯酸钠溶液进行清净[10-16]。因此,本文建立了用次钠溶液清净乙炔气中硫化氢和磷化氢的实验装置,基于次氯酸钠的氧化性和稳定性,从次钠溶液有效氯浓度和pH值两方面进行研究,探索其对乙炔气中硫、磷去除效果的影响,为工业生产的应用和工艺优化提供数据和理论支持。
1 实验
1.1 实验装置与流程
首先在烧瓶内加入电石和水制取粗乙炔气,并经冷却后收集储存在聚乙烯气袋中。
其次,将气袋中的粗乙炔气通入扎氏吸收瓶,用盛有不同有效氯浓度和pH值的次钠溶液清净乙炔气,然后通入锥形瓶,分别利用溴水、乙酸镉吸收乙炔气中未清净的PH3、H2S杂质气体,实验仪器及装置见图1。由于实验中存在着清净气的收集等一系列问题,因此用化学法[17]检测乙炔气中的硫、磷含量时分开进行。同时考虑到清净液以及吸收液用量问题,检测PH3含量时以针筒代替H2S实验装置中的乙炔气袋和测体积设备,并以装有溴水的扎氏吸收瓶代替图1中的两个锥形瓶进行未清净的PH3的吸收。
1.2 分析及计算方法
1.2.1 分析方法
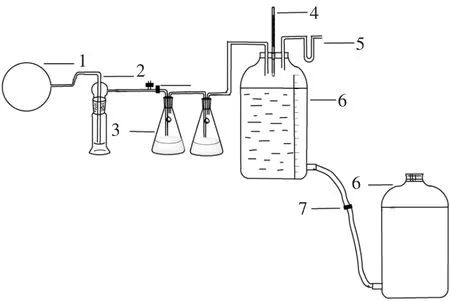
图1 硫化氢磷化氢吸收装置
实验过程需要取样分别以反滴法、比色法测定清净前后硫化氢、磷化氢含量[18]。检测清净前后H2S含量时,将吸收了H2S气体的乙酸镉溶液以及锥形瓶洗涤液一起并入碘量瓶,在酸性条件下,经碘液在暗处反应10 min后,用硫代硫酸钠标准溶液进行滴定,以公式(2)计算出硫化氢含量。检测清净前PH3含量时,将吸收了PH3的溴水以上述同样的方式转入碘量瓶,经氯化亚锡-钼酸盐法反应后,用比色法进行检测,并以公式(1)计算出磷化氢含量。测硫化氢瞬时吸收率时,以气质联用仪检测。采用的分析仪器(见表1)。
本文实验分析所用的试剂:亚硫酸钠溶液(100 g/L);溴水(wt0.3%);氯化亚锡-盐酸溶液(20 g/L);钼酸铵-硫酸溶液(15 g/L);磷酸二氢钾标准溶液(0.2866 g/L);盐酸溶液(1∶1);乙酸镉溶液(27 g/L);碘标准溶液(0.02 mol/L);硫代硫酸钠标准滴定溶液(0.02 mol/L)。

表1 主要实验仪器
考虑到碘液的挥发性,在测硫化氢浓度前应先做空白实验进行校正,保证实验的准确性,以减少误差。
1.2.2 计算方法
1.2.2.1 磷化氢含量的计算磷化氢的含量由公式(1)计算得出:

式中:V1—相当于磷酸二氢钾标准溶液的体积,mL;V—应换算为101.3 kPa,20℃下的试样的体积,mL;0.05—1 mL磷酸二氢钾标准溶液相当于磷化氢的体积,mL(101.3 kPa、20 ℃)。
1.2.2.2 硫化氢含量的计算硫化氢的含量由公式(2)计算得出:
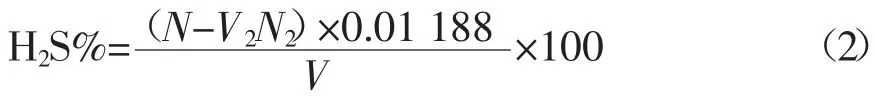
式中:N—空白实验对应的碘的物质的量,mol;V2—消耗硫代硫酸钠标准溶液的体积,mL;N2—硫代硫酸钠标准溶液的浓度,mol/L;0.01188—在101.3 kPa、20℃时,1 mL碘标准滴定溶液相当的硫化氢体积数,L;V—应换算为 101.3 kPa,20℃下的试样的体积,L。
1.2.2.3 有效氯含量的计算
次钠有效氯含量由公式(3)计算得出:

式中:c—硫代硫酸钠标准滴定溶液的实际浓度,mol/L;V—硫代硫酸钠标准溶液的用量,mL;M—试样的质量,g;0.03545—每毫摩尔 Cl的克数,g/mmol。
1.2.2.4 去除率
硫化氢或磷化氢的去除率由公式(4)计算得出:

式中:X—H2S或 PH3去除率,%;C0—H2S或 PH3初始浓度,10-6;C1—清净后或某一时间点 H2S 或 PH3浓度,10-6。
1.3 实验内容
本文分别以PH3、H2S的平均去除率和瞬时去除率为研究对象,考查次钠溶液有效氯浓度和pH值对它们的影响。实验中所用的次钠溶液有效氯浓度和pH值的取值见表2。
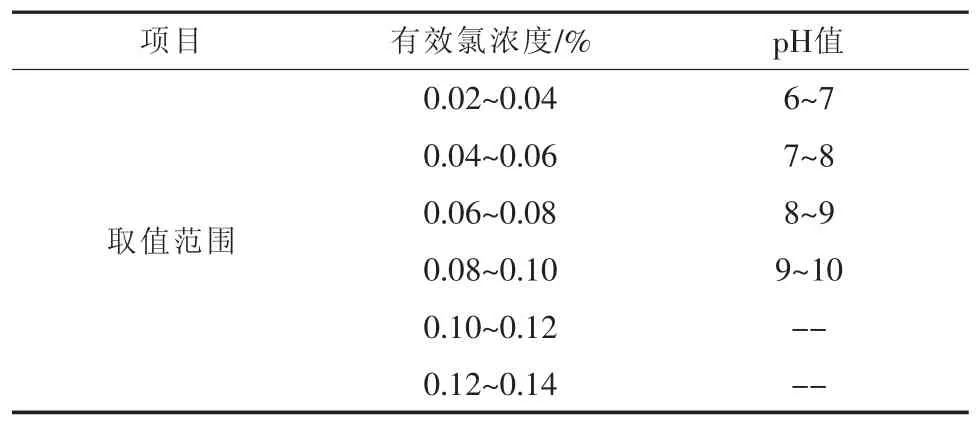
表2 次钠溶液有效氯浓度和pH值取值
2 实验结果与讨论
由于次氯酸钠稳定性较差,在15℃时,次氯酸钠水溶液一般较稳定,温度越高越易分解[19-20],本实验环境温度均在12~15℃,本文以下所称室温均指该温度。
2.1 次氯酸钠有效氯浓度的影响
在室温下,以200 mL/min的气速考察次钠溶液有效氯浓度对磷、硫平均去除效果的影响,实验结果见图2。此时次钠溶液pH值均在7.5左右,磷化氢初始浓度为 391×10-6,硫化氢初始浓度为 110×10-6。
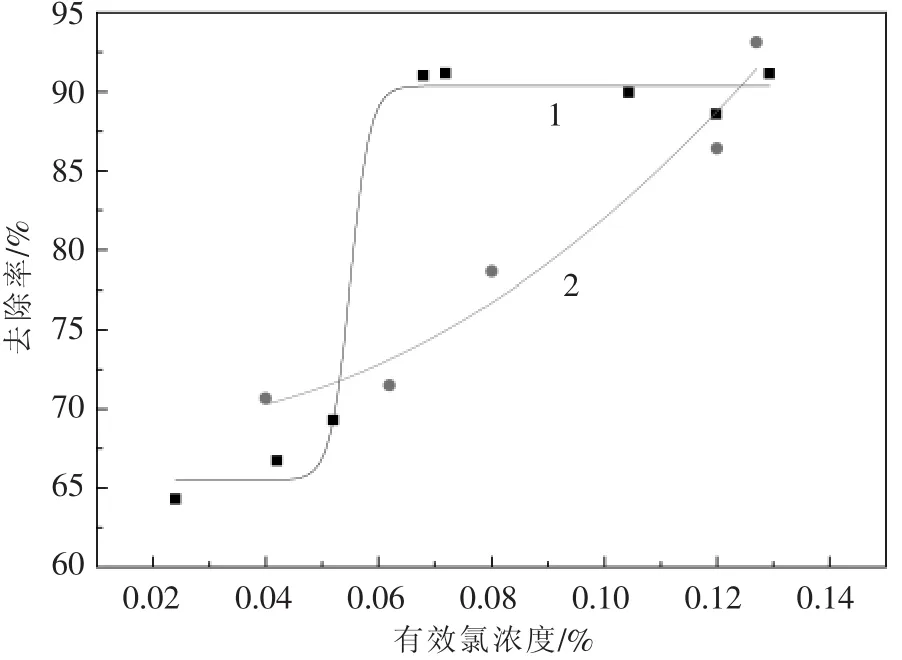
图2 次钠溶液有效氯浓度对硫、磷去除效果的影响
结果表明,乙炔气的清净效果整体随着次钠溶液有效氯浓度的增加而升高。有效氯浓度在0.06%以上时,磷化氢的去除率比较稳定,达到90%,而硫化氢的去除率随着有效氯浓度的增加不断升高,达到72%以上。这是因为次钠溶液的氧化性与有效氯浓度有一定关系,在常温下,0~1%范围内,次氯酸钠的氧化还原电位(ORP)随着有效氯含量的增加而升高,即有效氯含量越高,次氯酸钠溶液的氧化性越强。但是从安全生产的角度出发,不应使次氯酸钠的有效氯含量过高。综合考虑次氯酸钠的清净效果和安全两个方面,选择有效氯浓度在0.085%~0.12%范围内的次钠溶液最佳,此时磷化氢的平均去除率在90%以上,硫化氢的平均去除率去除率达到80%以上。
2.2 次氯酸钠对pH值的影响
次氯酸钠的氧化性主要受pH值控制。室温下,以200 mL/min气速通过清净装置,考察次钠溶液不同的pH值对磷、硫平均去除效果的影响。其中,乙炔气中磷、硫初始浓度分别为 351×10-6、56×10-6,当次钠溶液有效氯浓度在0.08%~0.12%时,对PH3的影响较小,因此本实验对PH3、H2S的清净,所用次钠溶液有效氯浓度分别为0.09%、0.12%,结果见图3。
实验结果表明:当次钠溶液pH值在6~10的范围内变化时,PH3与H2S的去除率整体上随着次钠溶液pH的升高而降低。其中,pH值对H2S的影响较大,对PH3的影响较平缓。这是因为随着pH值的升高,次钠溶液的氧化性逐渐减弱,不利于硫、磷的去除。但是,当溶液pH值过低时,由于溶液中存在着下列平衡:

图3 次钠溶液pH值对硫、磷去除效果的影响
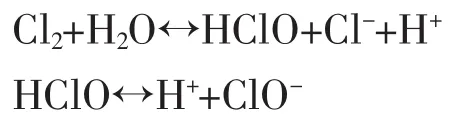
pH值过低,会使Cl2增多,易从溶液中溢出,溶液有效氯浓度降低的同时,使乙炔气中混入氯气,从而增加副反应的发生[21]。
因此应选择合适的pH值以达到乙炔清净的目的,实验表明当pH值在7~8.5时,硫、磷去除率较好,均在85%以上。
2.3 不同有效氯浓度下的瞬时吸收率
从以上实验可以看出pH值和有效氯浓度对硫化氢的影响较大,对磷化氢的影响并不是特别显著,同时考虑到PH3毒性的影响,因此瞬时吸收实验主要以H2S为研究对象,考察次钠溶液有效氯浓度对硫化氢去除率的影响。实验在次钠溶液pH值为8,气速为80 mL/min,有效氯浓度分别为0.03%、0.062%、0.088%、0.094%以及0.107%五个水平下进行。结果见图4。
从图4可以看出,不同有效氯浓度条件下,实验一开始的硫化氢吸收率均较高,随着反应时间的延长,硫化氢消耗大量的次氯酸钠,导致次钠溶液有效氯浓度降低,吸收效率不断下降,最终以降低到初始值为实验结束。同时,在实验进行的前10 min,虽然次钠溶液的有效氯浓度不断降低,但是清净效果呈上升趋势,均在93%以上。这是因为随着反应的进行,H2S与次氯酸钠生成更多的硫酸,导致溶液pH降低,低pH值使得次氯酸钠溶液氧化性增强,硫化氢清净效果提高;并且次钠溶液初始有效氯浓度越高,相应处理的H2S气体越多,反映在图4上,即相同量的H2S气体进气量,初始有效氯浓度越
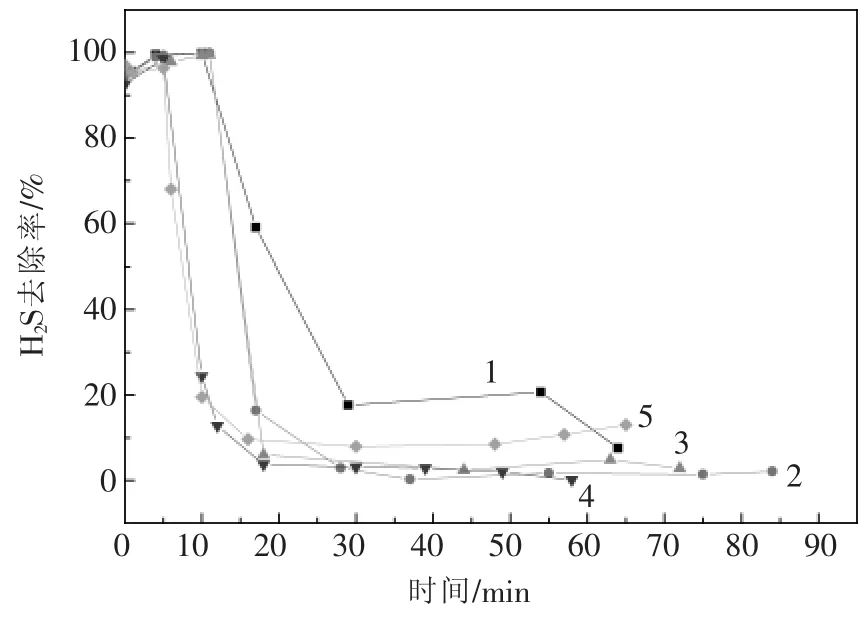
图4 次钠溶液有效氯浓度对H2S瞬时去除率的影响
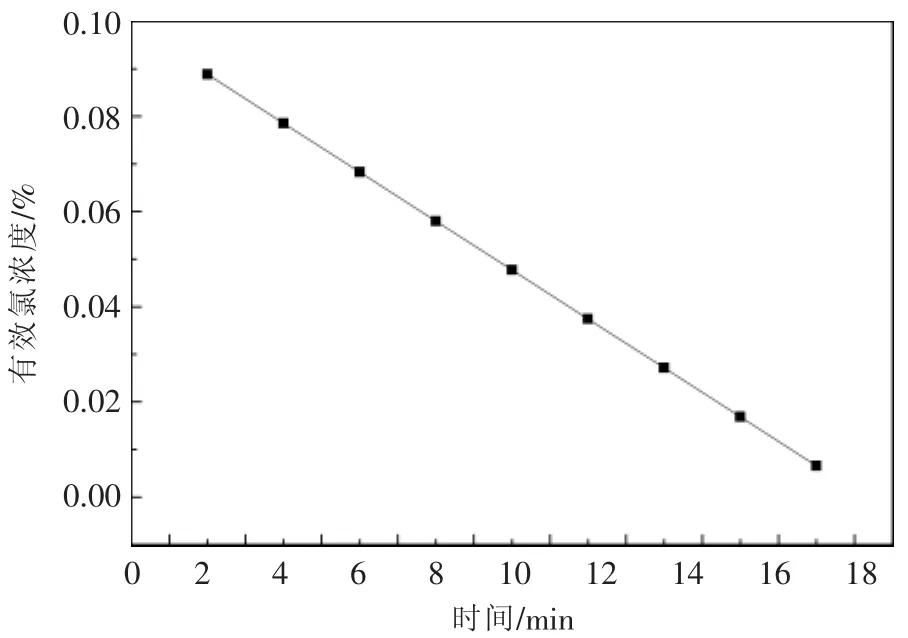
图5 理论计算H2S进气量对初始有效氯浓度为0.094%的次钠溶液有效氯浓度的影响
图5为初始有效氯浓度为0.094%的次钠溶液,随着80 mL/min的H2S气体通入,根据理论计算得出的相对应的次钠溶液有效氯浓度的变化。取样检测11 min时的有效氯浓度及pH值,此时溶液有效氯浓度在0.028%左右,pH值为4.5,H2S去除率约为99%;理论计算的有效氯浓度为0.037%,两者误差30%左右,可以满足工业应用。
3 结论
本文从平均吸收率和瞬时吸收率两个方面出发,研究次钠溶液有效氯浓度和pH值对乙炔气中硫、磷含量清净效果的影响,在本实验条件下,得出以下结论。
(1)次钠溶液的有效氯浓度及pH值,对乙炔气中硫、磷的清净效果具有直接影响,并对硫化氢的影响更为显著;
(2)气速为200 mL/min,pH值为7.5的条件下,有效氯浓度0.085%~0.12%时,硫化氢去除率在80%以上,磷化氢去除率稳定在90%左右。
有效氯浓度低于0.06%时,磷、硫去除率均在72%以下;
(3)气速为200 mL/min,有效氯浓度为0.12%的条件下时,pH值在7.0~9.5时,硫、磷的平均去除率均在85%以上;
(4)硫化氢清净初期,次钠溶液的pH值起主要作用,次钠氧化去除H2S反应速度较快,10 min即可使H2S的去除率达到93%以上;
本实验所用的主要吸收仪器为扎氏吸收瓶,相当于一个平衡级,现工业上乙炔清净广泛采用的是双塔流程,可将以上结果对该流程进行模拟与优化。
