免疫组织化学技术在子宫颈上皮内病变中的应用价值分析
2022-09-08黄秋梅洪美玲
黄秋梅 洪美玲
子宫颈癌(cervical cancer)是威胁女性健康安全最严重的疾病之一,是女性恶性肿瘤发病率的第二位[1]。通常而言,子宫颈癌潜伏期长,需要经历从低级别鳞状上皮内病变(low squamous intraepithelial lesions,LSIL)至高级别鳞状上皮内病变(high squamous intraepithelial lesions,HSIL)才会转化为早期癌,再转化为浸润癌[2]。而在SIL时期,也为宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)时期进行治疗的5年内存活率为100%,这足以说明在SIL时期进行筛查、治疗的重要性。但不同SIL时期需要的治疗方法不同,如LSIL时期大部分无须治疗,可以自行好转,而HSIL时期就需要进行治疗,所以如何准确有效地检测出SIL等级有急迫的现实意义。有研究显示,应用免疫组织化学技术检测于子宫颈上皮内病变效果突出[3]。为进一步研究其具体应用价值,特展开免疫组织化学技术应用于子宫颈上皮内病变中的价值分析,现报道如下。
1 资料与方法
1.1 一般资料
收集泉州市妇幼保健院·儿童医院自2019年2月-2020年10月宫颈活检或LEEP刀锥切标本163例,纳入标准:已婚妇女,术前宫颈活检病理检查确定存在宫颈鳞状上皮内病变,患者无严重重要脏器疾病。排除标准:合并其他手术,病理诊断为炎症或癌变,临床资料不完整。其中133例子宫颈上皮内病变患者为观察组,按照级别不同分为低级别鳞状上皮内病变(LSIL)组45例和高级别鳞状上皮内病变(HSIL)组88例。30例子宫肌瘤全切子宫的正常宫颈患者为对照组。LSIL组年龄35~70岁,平均(45.39±2.95)岁;HSIL组年龄33~71岁,平均(45.67±3.12)岁;对照组年龄32~69岁,平均(46.53±3.27)岁。三组一般资料比较,差异无统计学意义(P>0.05),有可比性。
1.2 方法
所有切片标本使用中性福尔马林(10%)[苏州瑞诺德生物科技有限公司,苏锡食药监械(准)字2014第1410004号,500 ml/瓶]固定,石蜡包埋,采用常规厚度4 μm连续切片。常规HE染色及染色免疫组化EnVision法标记,使用光镜观察细胞形态,进行诊断和分级[4]。所用抗体为p16、p53、p63及Ki-67的鼠单克隆抗体,试剂盒为迈新公司产品,严格参照试剂盒说明书和相关单克隆抗体参考文献[5-6]使用。切片经由具有多年操作经验的两位病理医师重新对SIL进行分级处理,确保结果无误。具体方法:(1)将石蜡切片放于新鲜二甲苯中浸泡10 min,浸泡2次后将去除多余液体,后分别浸泡于85%、95%及无水乙醇中,各浸泡5 min后利用蒸馏水冲洗1 min。(2)将普通水浴锅预热至95 ℃~100 ℃,后将已浸泡于抗原修复液的切片在此锅内加热20 min,并依据不同样品、目的蛋白合理控制最佳加热时间,20 min后冷却切片,并用免疫染色条洗涤剂洗涤5 min,洗2次。(3)使用蒸馏水冲洗修复后切片1 min,利用油笔固定玻片上待测组织区域,并加入100 μl的内源性过氧化酶封闭剂,置于室温下孵育5 min,后行TBS溶液冲洗3 min,分别冲洗3次。(4)去除TBS溶液后再次加入100 μl一抗,于4 ℃条件下进行1 h孵育,后加入抗小鼠/免过氧化物酶聚合物。(5)将TBS溶液取出后加入新鲜配制DAN显色液,于室温下进行5 min孵育,利用蒸馏水冲洗后加入100 μl苏木素,于室温下孵育8 min,后进行脱水、透明、封片。
1.3 观察指标及评价标准
阅读试剂盒产品说明及单克隆抗体相关文献,p16阳性表达为胞核和/或胞浆着色,见图1。细胞核出现棕色颗粒为p53、p63及Ki-67的阳性表达,见图2、表1。

表1 抗体的强度表达

图1 p16强阳性表达(HE染色放大40倍)
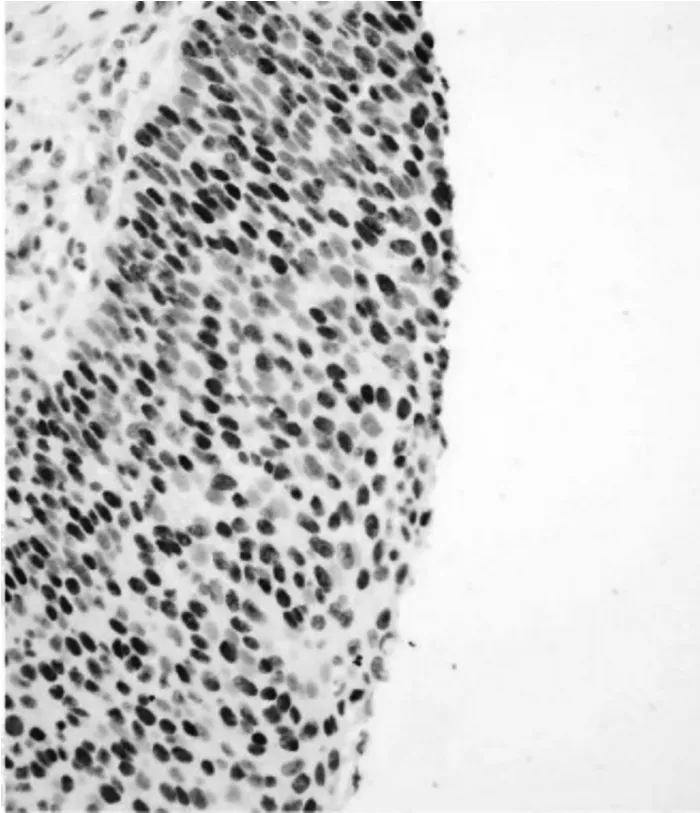
图2 p53、p63、Ki-67强阳性表达(HE染色放大40倍)
1.4 统计学处理
采用SPSS 22.0统计学软件进行数据分析,正态分布的计量资料采用(±s)表示,非正态分布的计量资料转化后采用(±s)表示,两组间的比较采用独立样本t检验;计数资料以率(%)表示,数据比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组p16免疫组化染色结果比较
p16在对照组中染色结果全部呈阴性(-),LSIL组中75.56%呈弱阳性(+),HSIL组62.50%呈中阳性(++),三组染色结果比较,差异有统计学意义(P<0.05),见表2。

表2 三组p16免疫组化染色结果比较[例(%)]
2.2 三组p53免疫组化染色结果比较
p53在对照组染色结果全部呈阴性(-);LSIL、HSIL组84.44%、61.36%呈中阳性(++);三组染色结果阴性(-)、中阳性(++)、强阳性(+++)比较,差异有统计学意义(P<0.05),见表3。
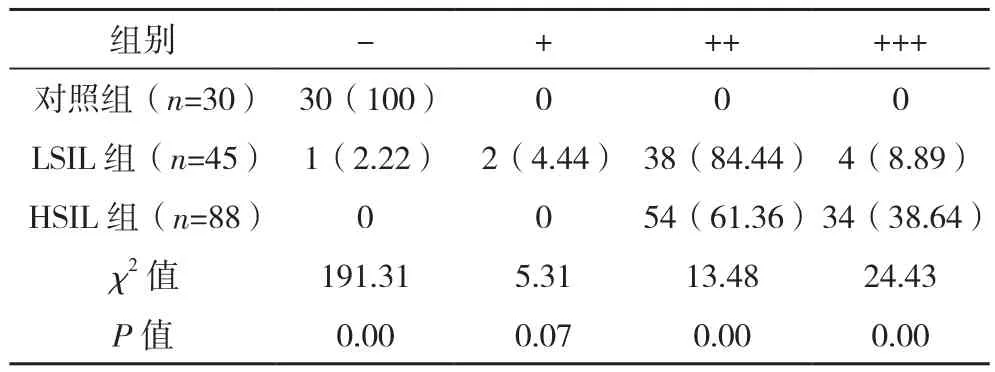
表3 三组p53免疫组化染色结果比较[例(%)]
2.3 三组p63免疫组化染色结果比较
p63的强度表达在对照组中染色结果全部呈阴性(-);LSIL中82.22%呈阴性(-);LSIL组阴性(-)率高于HSIL组(P<0.05);三组染色结果比较,差异有统计学意义(P<0.05),见表4。
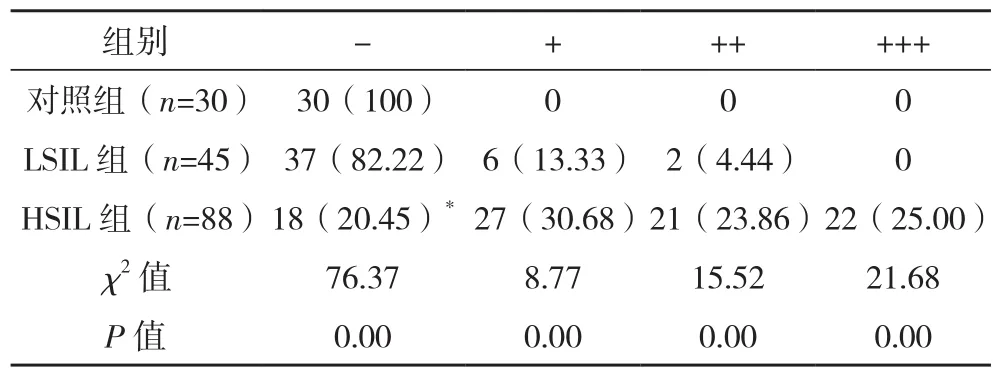
表4 三组p63免疫组化染色结果比较[例(%)]
2.4 三组Ki-67免疫组化染色结果比较
Ki-67在对照组的免疫组化染色结果为阴性(-);在LSIL组中77.78%呈弱阳性(+),HSIL组中80.68%呈中阳性(++);三组染色结果阴性(-)、弱阳性(+)、中阳性(++)的表达,差异有统计学意义(P<0.05);三组染色结果强阳性(+++)表达,差异无统计学意义(P>0.05),见表5。
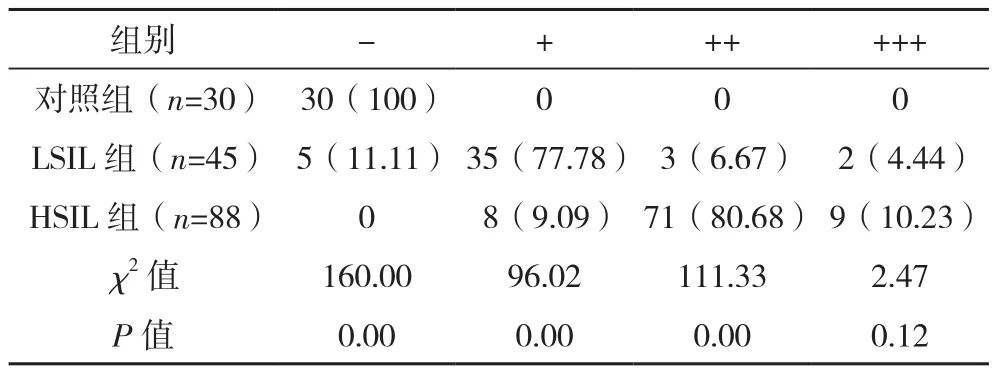
表5 三组Ki-67免疫组化染色结果比较[例(%)]
2.5 三组p16、p53、p63、Ki-67阳性率比较
p16、p53、p63、Ki-67在对照组中的阳性率均为0,p16、p63、Ki-67在HSIL组中的阳性率均高于LSIL组(P<0.05);三组p53阳性率比较,差异无统计学意义(P>0.05),见表6。
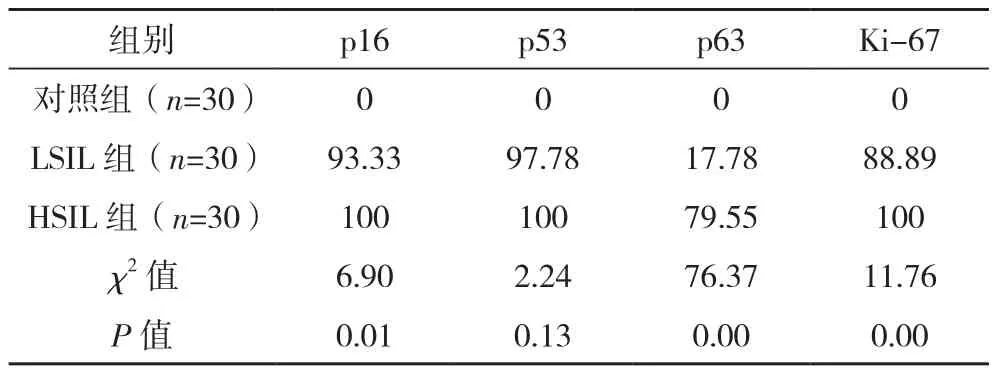
表6 三组p16、p53、p63、Ki-67阳性率比较(%)
3 讨论
在目前的临床治疗中,子宫颈上皮内病变有着两种截然不同的结局,或是自然消退,并不影响健康,或是逐步发生病变,由CIN1发展至CIN2、CIN3,直至早期癌、浸润癌,严重威胁身体健康[7-9]。由于子宫颈上皮内病变潜伏期长,在CIN时期进行治疗可得到较好的效果,预后情况良好,所以为避免子宫颈癌威胁到女性的身体健康,提高子宫颈癌的早期筛查准确率有重要意义[10-11]。随着免疫组织化学技术的飞速发展,国内外众多学者使用免疫组织化学技术来检测子宫颈上皮内病变程度,如石克等[12-13],免疫组织化学技术的重要性越发凸显。为观察免疫组织化学技术在子宫颈上皮内病变的应用,本研究使用p16、p53、p63、Ki-67来检测子宫颈上皮内病变的程度,分析其应用价值。
p16是一种直接参与细胞周期调控的基本基因,是一种抗癌基因,负责调节细胞的增殖与分裂,研究表明p16基因广泛参与肿瘤形成,检测p16基因可以有效预测子宫颈上皮内病变的程度[14]。p53是一种人体抑癌基因,在所有的恶性肿瘤中,一半以上都会出现p53基因的突变,同时p53基因在正常上皮的形成过程中有着重要作用,在上皮组织表达明显[15]。p63同样也是一种抑癌基因,p63在子宫颈上皮内病变的异常表达与缺失可作为SIL转化的标志[16]。Ki-67对肿瘤细胞的增生活性有一定反应作用,是细胞增生的标记物,可以作为区分LSIL或是HSIL的辅助诊断指标[17]。而这四种判断病变程度的指标都可以使用免疫组织化学技术进行测定,在本次研究中,30例子宫肌瘤全切子宫的正常宫颈在p16、p53、p63、Ki-67的染色测验中结果全部呈阴性,这说明应用免疫组织化学技术可以很好地判断子宫颈是否正常,初步筛查准确率极高[18]。p16、Ki-67在LSIL组中大部分呈弱阳性状态,在HSIL组中大部分呈中阳性,随着SIL的病变分级,阳性细胞数逐步增加。p53在LSIL、HSIL组中大部分呈中阳性表达,p63在LSIL中大部分呈阴性表达。并且p16、p53、Ki-67的在LSIL及HSIL组中的阳性率都极高,p53各个组别间比较,差异无统计学意义,p63在LSIL组中阳性率较低,差异有统计学意义。这充分表明四项指标对于子宫颈上皮内病变程度都有着一定的监测效果,可以通过免疫组织化学技术判断其病变等级,对子宫颈上皮内病变的前期诊断和治疗中有着重要作用,可以有效减少宫颈癌的发病率[19-20]。
综合上述,免疫组织化学技术应用于子宫颈上皮内病变能在一定程度上检测病变程度,减少宫颈癌的发生,值得临床早期诊断与治疗应用。
