基于网络药理学、分子模拟的射干治疗脑胶质瘤的作用机制
2022-09-08姜东京刘松柏陆海峰钟其新戴小蓉
周 扬 ,姜东京 ,刘松柏 ,陆海峰 ,曾 峰 ,钟其新 ,戴小蓉
(1.苏州卫生职业技术学院药学院,苏州检验医学生物技术重点实验室,江苏苏州 215009;2.广州中医药大学青蒿研究中心,广东广州 510445;3.广州中医药大学第一附属医院科研处,广州中医药大学第一临床医学院,广东广州 510405;4.广州中医药大学深圳医院(福田),广东深圳 518034)
脑胶质瘤起源于脑神经胶质细胞,是最常见的原发性颅内肿瘤,约占所有中枢神经系统肿瘤的27.7%[1],具有快速浸润生长、增殖迅速、易复发等显著特点[2],是一类严重危害人类生命健康的疾病,也是目前临床研究的热点之一[3]。
射干始载于《神农本草经》,味苦,性寒,具有清热解毒、消肿止痛、活血化瘀之功效[4]。近年来研究发现,其所含的异黄酮成分鸢尾苷(tectoridin)、鸢尾苷元(tectorigenin)、野鸢尾苷(iridin)和野鸢尾黄素(irigenin)等是其主要药理活性成分。射干在抗肿瘤、调节免疫、抗病毒等多种过程中有着广泛的作用[5]。其有效成分野鸢尾黄素被报道在肝癌、胃癌、肺癌等多种人类肿瘤中表现出一定的抗肿瘤作用[6-8],而射干对于脑胶质瘤的作用研究仍未有相关报道。
中药存在多成分、多靶点、多通路的协同作用特点[9],传统药理学的单一性思维难以总结药物作用于机体的机制,网络药理学通过利用生物学数据库构建“疾病-基因-靶点-药物”网络探讨药物对疾病的作用机制,为中药复杂研究提供了新方向[10]。本研究基于网络药理学方法、分子对接技术及实验验证方法对射干治疗脑胶质瘤的作用机制进行研究,以期为后续射干治疗脑胶质瘤的研究和临床应用提供一定的理论依据。
1 材料与方法
1.1 射干化学成分与靶点收集
1.2 脑胶质瘤疾病靶点收集
通过GeneCards、OMIM、CTD 数据库,输入关键词“brain glioma”检索疾病靶点,筛选relevance score>20的来源于GeneCards数据库的靶点和有直接证据的CTD 数据库的靶点,将各数据库检索结果汇总后去重,获得脑胶质瘤疾病相关靶点。
1.3 “化合物-靶点-疾病”网络的构建与分析
根据收集获得的靶点信息,利用VENN DIAGRAMSR在线软件,绘制药物和疾病的Venn图,获得药物和疾病的共同靶点。利用Cytoscape软件构建“化合物-靶点-疾病”网络,并利用CytoCNA 插件对网络进行拓扑学,并根据度值筛选关键药效分子。
1.4 蛋白质相互作用(PPI)网络的构建与分析
将射干治疗脑胶质瘤的预测靶点导入STRING数据库,物种限定为“Homo sapiens”,获取高置信度(≥0.7)的蛋白质相互作用信息。将其导入Cytoscape软件,构建PPI网络,利用CytoCNA 插件对网络进行拓扑学分析,并根据度值筛选核心靶点。
1.5 基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析
利用R 语言ClusterProfiler包对治疗靶点进行GO功能和KEGG 通路富集分析,物种限定为Homo sapiens,阈值Pvalue<0.05,并利用R语言ggplot2包将结果可视化。对Pvalue前20的通路构建化合物-靶点-通路图。
1.6 分子对接验证
从Pubchem 数据库中获取度值排名前10的关键药效分子的三维结构SDF格式文件,利用Py MOL软件将其转换为PDB 格式,利用AutoDock 软件将其转换为PDBQT 格式。从PDB数据库中获取度值排名前10 的核心靶点的PDB 格式文件,并使用Py MOL软件对蛋白进行去水、加氢、分离配体与受体等操作,利用AutoDock软件计算配体Gridbox坐标数据,并将其转换为PDBQT 格式。利用AutoDock vina软件进行分子对接模拟,通过结合能(Binding Energy,BE)对活性成分与靶点之间的结合活性进行评价,利用Py MOL软件将对接结果进行可视化。
1.7 实验药物、试剂与仪器
射干饮片(规格:薄片,安徽道源堂中药饮片有限公司);胶质瘤细胞株U87(中国科学院典型培养物保藏委员会细胞库);VEGF、MMP9、GAPDH、PI3K、p-PI3K、AKT、p-AKT(北京博奥森生物技术有限公司);Annexin V-FITX/PI细胞凋亡检测试剂盒、实时荧光定量PCR 试剂盒(北京索莱宝科技有限公司);AMBION mir Vana PARIS Kit RNA 提取试剂盒(美国Life Technocologies公司);VEGF 上下游引物、MMP9 上下游引物、GAPDH 上下游引物(广州锐博生物科技有限公司);5218R 高速冷冻离心机(德国eppendorf公司);Sartorius BSA224S-CW 电子天平(赛多利斯科学仪器北京有限公司);Direct-Q3纯水机(美国millipore公司);imark 酶标仪(美国Bio-Rad公司);Power Pac Basic型蛋白电泳仪(美国Bio-Rad公司);流式细胞仪(美国BD Bioscience公司);实时荧光定量PCR 仪(美国Applied Biosystems公司)。
1.8 细胞培养及分组给药
将射干饮片粉碎过80目筛后,称取一定量饮片粉末加入700 m L/L乙醇回流提取2次。第1次加8倍量乙醇,第2次加6倍量,每次提取50 min,提取完成后趁热过滤,合并两次提取液,采用旋转蒸发仪回收乙醇,将提取液浓缩成稠膏,冷冻干燥,得到射干乙醇提取物冻干粉。干粉用PBS配制成100 mg/m L的贮存液,使用0.22μm 的微孔滤膜过滤除菌,于4℃保存备用。人脑胶质瘤U87细胞用含有100 m L/L胎牛血清和10 g/L青霉素-链霉素的DMEM 培养基进行培养,在37℃和50 m L/L CO2饱和湿度的培养箱中培养并传代。培养液每2 d更换1次。细胞经3次传代后取对数生长期的细胞进行实验。将实验分为空白组(只含培养基)、射干提取物8 mg/m L组和16 mg/m L组,用相应浓度的药物预处理细胞48 h,进行后续实验。
(1)以中青年教师为主。独立学院由于建校时间不长,自有引进教师主要为应届毕业生,进校时年龄普遍集中在 30 岁以下,而且所占比例一般都超过了50%以上。
1.9 蛋白免疫印迹(Western Blotting)实验检测VEGF、MMP9和PI3K/AKT信号通路相关蛋白表达
取各组细胞上清液加入裂解液,冰上裂解30 min后低温高速离心取上清液,收集细胞总蛋白,采用BCA蛋白测定试剂盒测定细胞总蛋白浓度,用100 m L/L SDS-PAGE凝胶电泳分离蛋白,电泳完成后采用湿转法将蛋白转移到PVDF膜上,在室温下用50 g/L脱脂奶粉封闭PVDF膜1 h。然后加入稀释的相应一抗,将膜与一级抗体于低温4℃孵育过夜,用TBS-5洗膜5次,然后在室温下用二级抗体孵育2 h,再用TBS-T洗膜5次,最后加入配好的显色液进行显色。使用Image J软件对条带灰度值进行分析。
1.10 CCK8法检测细胞活力
将实验分为8 组,分别为空白组和射干提取物2、4、8、16、32、64、128 mg/m L 浓度组。取对数生长期的U87细胞以2×103个细胞/孔的速度接种在96孔板中。24 h贴壁后弃去上清,用相应浓度的射干提取物预处理细胞48 h,空白组只加等量培养基,每孔重复3次,添加CCK8溶液并培养2 h,之后于450 nm 测定A值,绘制细胞生长曲线,选择合适的射干提取物浓度用于后续实验。
1.11 流式细胞术检测细胞凋亡
吸弃原培养基,收集各组细胞,然后用PBS洗涤2次,加入500μL 的Binding缓冲液重新悬浮细胞。在避光条件下,将细胞悬浮液转移到检测管中,分别加入5μL Annexin V和5μL Propidium Iodide(PI),轻轻吹打混匀,室温下孵育30 min,用流式细胞仪检测细胞凋亡水平,进行结果分析。
1.12 实时荧光定量PCR(qRT-PCR)检测细胞中VEGF和MMP9基因mRNA的表达
取适量各组细胞,根据实验步骤依次选用试剂提取总RNA并测定其含量、合成cDNA、PCR扩增,PCR反应条件为:95℃预变性1 min,95℃变性15 s,60℃退火30 s,72℃延伸40 s,共40 个循环。以GAPDH 为内参、cDNA 为模板扩增,所得数据采用2-△△ct法计算目的基因的mRNA 相对表达量。
1.13 统计学分析
采用SPSS 21.0 软件对数据进行统计学分析。实验数据以均值±标准差() 表示,计量资料多组间采用单因素方差分析,计数资料采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 射干的活性成分与靶点
通过TCMSP、TCMID、ETCM 和数据挖掘共得到32个活性成分(表1),通过Swiss Target Prediction共收集到射干的潜在靶点484个。
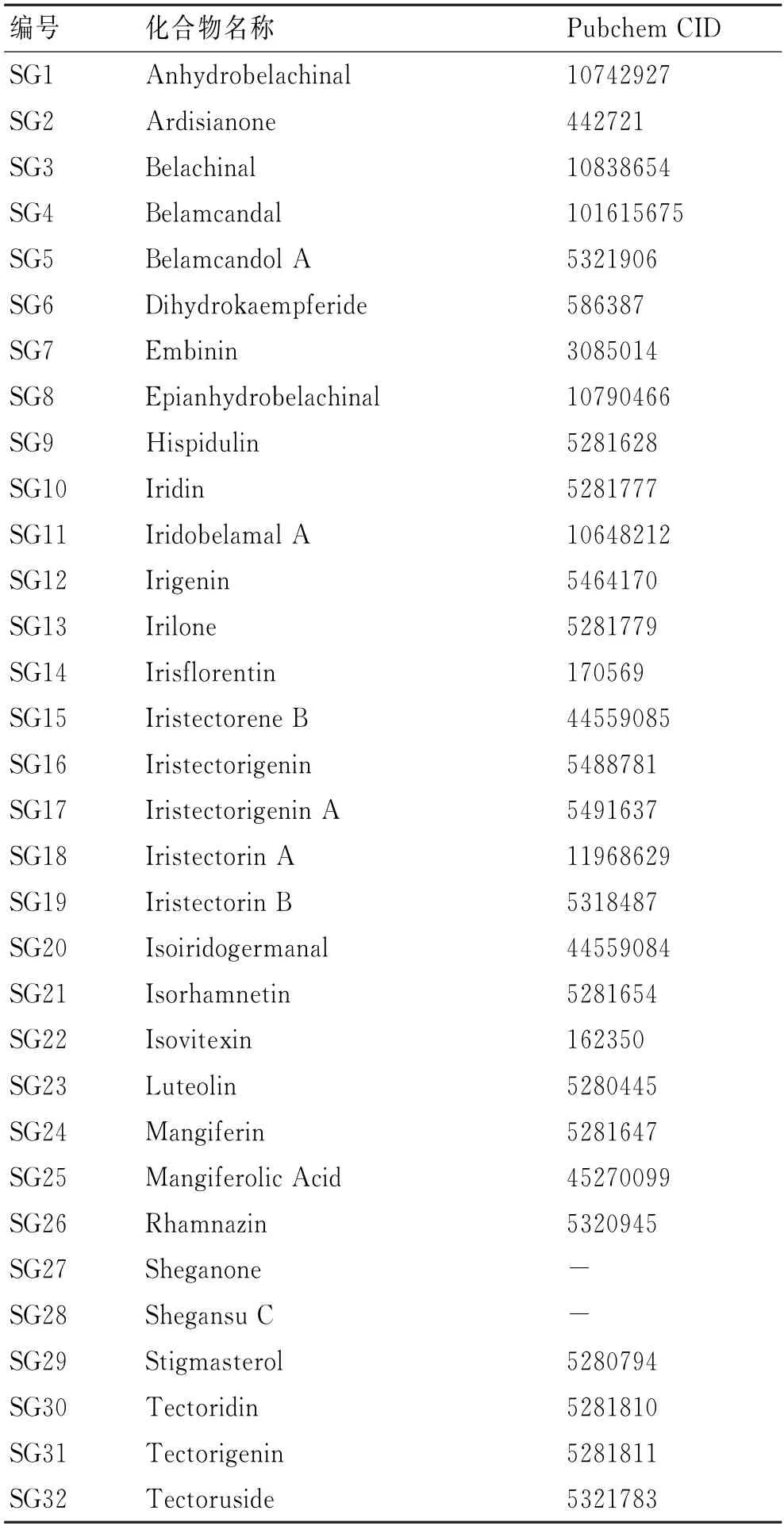
表1 射干活性成分基本信息Tab.1 Basic information of active ingredients in Belamcanda chinensis
2.2 脑胶质瘤疾病靶点及其与药物共有靶点
通过GeneCards、OMIM、CTD 数据库分别得到137个、209个、236个脑胶质瘤疾病靶点,去重后共获得464个脑胶质瘤疾病相关靶点。将射干药物靶点与脑胶质瘤疾病靶点进行映射,得到射干治疗脑胶质瘤共62个靶点,绘制Venn图(图1)。
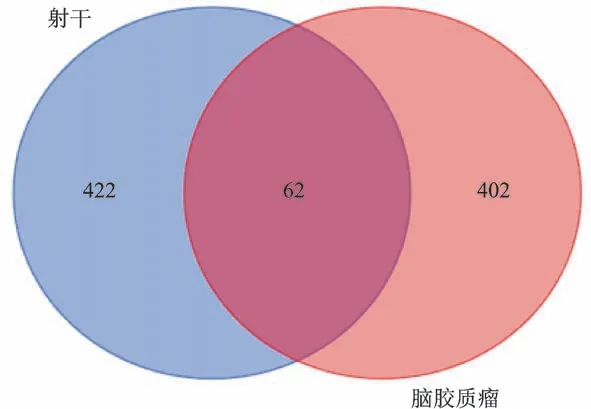
图1 射干药物靶点与脑胶质瘤疾病靶点Venn图Fig.1 Venn map of drug targets of Belamcanda chinensis and glioma disease targets
2.3 “化合物-靶点-疾病”网络
利用Cytoscape软件构建“化合物-靶点-疾病”的网络模型(图2)。高度值的节点在网络中相互作用的节点较多,在网络中占据重要地位。网络药物节点度值中位数为6,筛选度值大于或等于两倍中位数的节点作为关键药效分子,共获得12个关键药效分子,按度值由大到小编号分别为SG20、SG11、SG26、SG9、SG21、SG23、SG6、SG27、SG4、SG8、SG1 和SG3。

图2 化合物-靶点-疾病网络图Fig.2 Compound-target-disease network map
2.4 PPI网络
基于STRING 数据库和Cytoscape软件构建射干治疗脑胶质瘤靶点的PPI网络(图3)。网络节点度值中位数为7,筛选度值大于或等于两倍中位数的节点作为核心靶点,共获得17 个核心靶点,分别为AKT1、STAT3、HRAS、VEGFA、MAPK1、PIK3CA、EGFR、PTPN11、MTOR、PTGS2、ESR1、PTK2、ERBB2、MMP9、APP、AR、TNF。
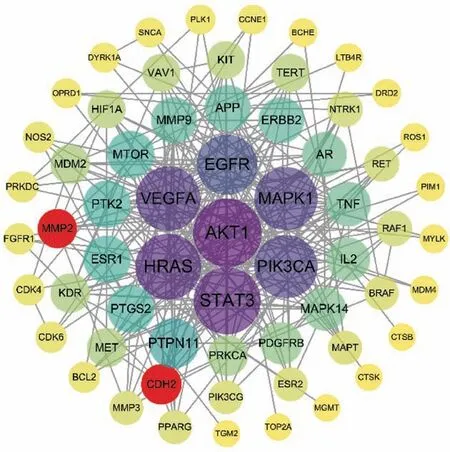
图3 射干治疗脑胶质瘤靶点的PPI网络Fig.3 PPI network of therapeutic targets of Belamcanda chinensis in the treatment of glioma
2.5 GO 功能和KEGG 通路富集分析
基于R 语言Cluster Profiler包对治疗靶点进行GO 功能和KEGG 通路富集分析(图4、图5)。GO功能富集分析共富集到1 667个生物过程(Biological Process,BP)条目,主要涉及肽基丝氨酸磷酸化、蛋白激酶B 信号转导、肽基丝氨酸修改等;富集到56个细胞组分(Cellular Component,CC)条目,主要涉及膜筏、膜微结构域、膜区域等;富集到64个分子功能(Molecular Function,MF)条目,主要涉及跨膜受体蛋白酪氨酸激酶活性、蛋白酪氨酸激酶活性、蛋白丝氨酸/苏氨酸激酶活性;KEGG 通路富集分析富集到79条相关通路,主要涉及PI3K/Akt信号通路、Glioma神经胶质瘤、Rap1 信号通路、VEGF 信号通路、MAPK 信号通路、HIF-1信号通路、JAK-STAT 信号通路等。

图4 GO 功能富集分析条形图Fig.4 Go function enrichment analysis

图5 KEGG 通路富集分析气泡图Fig.5 Bubble diagram of KEGG pathway enrichment analysis
2.6 分子对接分析
利用PDB数据库获取核心靶点蛋白(表2),利用AutoDock vina软件对度值前10的关键药效分子和核心靶点进行分子对接模拟(图6)。最低结合能越小,说明二者结合活性越好,一般认为最低结合能小于-5 kal/mol,说明两者能够自发结合并结合较好[12]。图6中大部分关键药效分子与核心靶点最低结合能小于-5 kal/mol,说明两者具有良好的结合活性。利用Py MOL对分子对接结果进行可视化(图7),由示例可见靶点蛋白与活性成分通过氢键能分子间作用力相结合,进一步说明活性成分和靶点蛋白之间具有良好的结合能力。
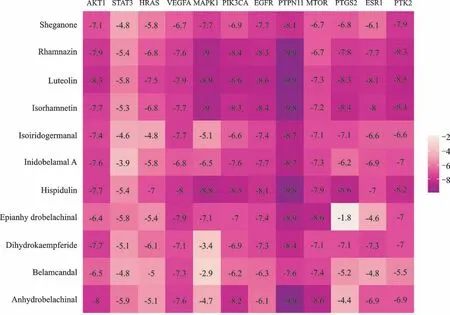
图6 分子对接最低结合能热图Fig.6 Heat map of minimum binding energy for molecular docking
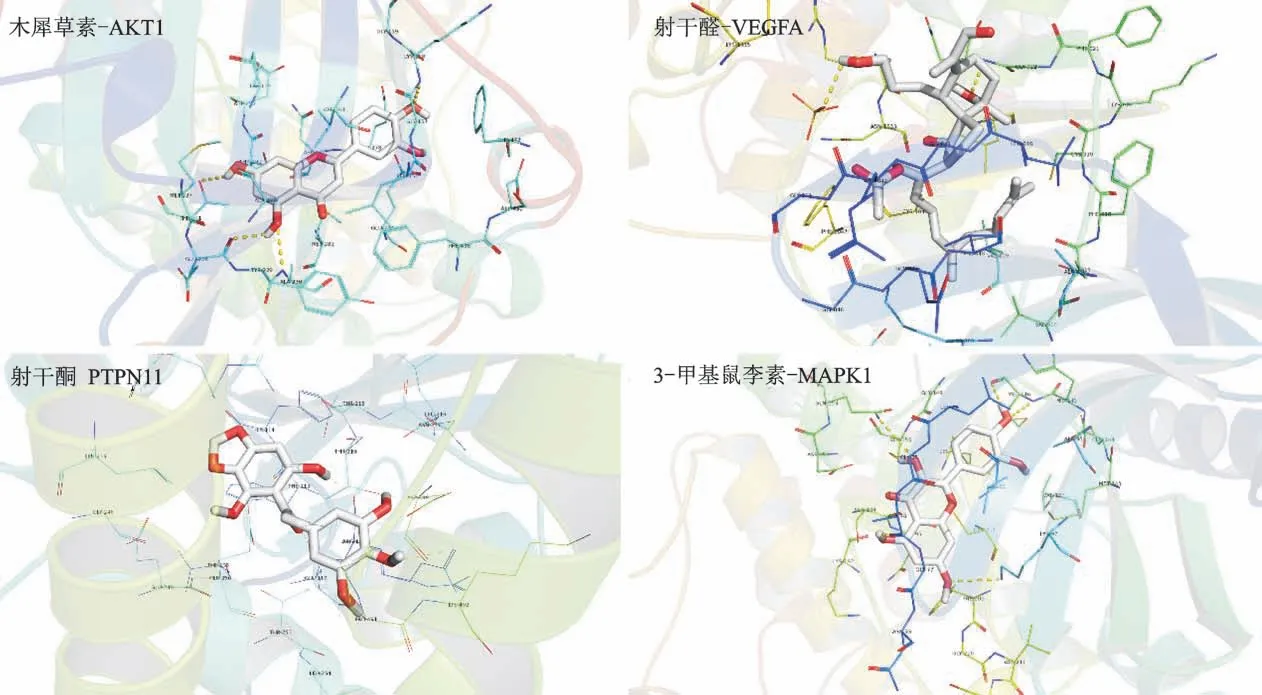
图7 分子对接模式示例Fig.7 Examples of molecular docking models

表2 核心靶点受体蛋白与配体信息Tab.2 Information of core target receptor proteins and ligands
2.7 射干提取物对LN229细胞活力的影响
结果见图8。与空白对照组比较,2~128 mg/m L射干提取物组的U87细胞活力显著降低(P<0.05或P<0.001),且呈浓度依赖性。射干提取物给药量为8 mg/m L和16 mg/m L时,细胞存活率分别为(61±4.58)%和(51.33±4.04)%,给药量为16 mg/mL时有将近半数细胞死亡,因此在进行后续实验时,选取8 mg/mL和16 mg/mL这两个给药浓度。
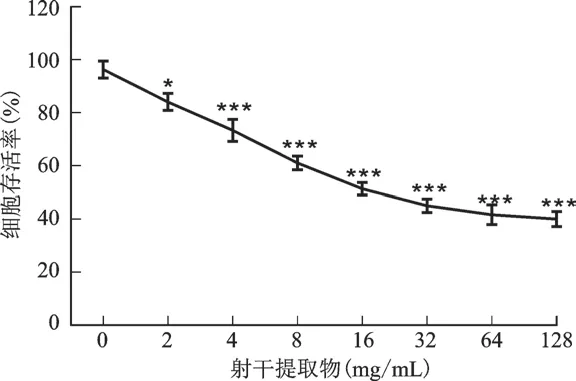
图8 细胞活力实验结果Fig.8 Cell viability experiment results
2.8 射干提取物对U87 细胞VEGF、MMP9 和PI3K/Akt信号通路相关蛋白表达的影响
采用相应浓度的射干提取物干预48 h后,空白对照组和射干提取物8 mg/m L 和16 mg/m L 实验组的U87细胞中VEGF 和MMP9蛋白相对表达见图9。与空白对照组相比,射干提取物8 mg/m L 和16 mg/m L组中U87细胞的VEGF 和MMP9蛋白水平显著降低(P<0.01或P<0.001),并呈现浓度依赖性。空白对照组和射干提取物8 mg/m L 和16 mg/m L实验组的U87 细胞中p-PI3K、PI3K、p-AKT 和AKT 的蛋白表达情况见图10。与空白对照组比较,射干提取物16 mg/m L 组的p-PI3K/PI3K和p-AKT/AKT 比值均显著降低(P<0.01)。
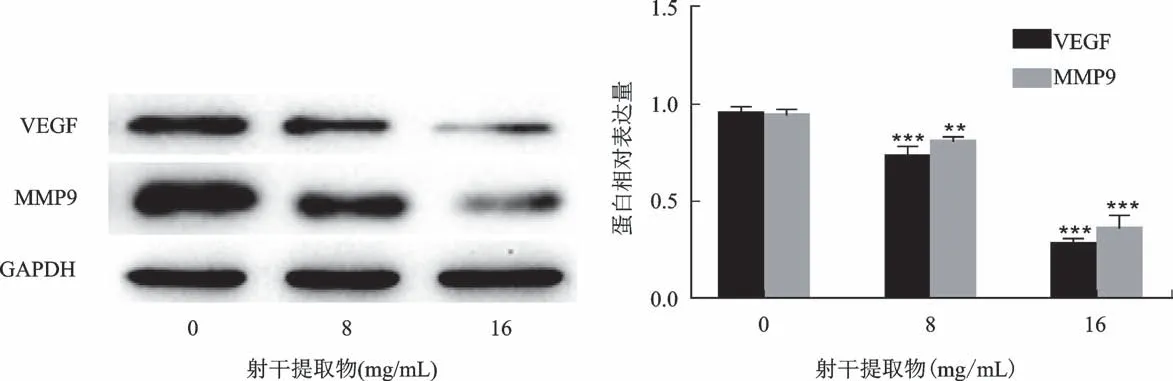
图9 VEGF和MMP9蛋白表达结果Fig.9 The protein expressions of VEGF and MMP9

图10 PI3K/AKT通路相关蛋白表达结果Fig.10 The expressions of PI3K/Akt pathway related proteins
2.9 射干提取物对U87细胞VEGF和MMP9基因mRNA表达的影响
结果见表3,与空白对照组比较,射干提取物8 mg/m L和16 mg/m L给药组的VEGF和MMP9基因mRNA表达显著降低(P<0.001或P<0.000 1)。
2.10 射干提取物对U87细胞早期凋亡的影响
结果见表4,与空白对照组相比,射干提取物8 mg/m L和16 mg/m L 组的早期凋亡率显著增高(P<0.01或P<0.001)。
3 讨 论
近年来射干在抗肿瘤方面的研究逐渐增多。已有研究表明射干能够有效抑制结肠癌[13]、宫颈癌[14]等多种肿瘤细胞的生长,但其对胶质瘤的抑制作用尚未有相关报道,其药效物质基础和作用机制仍待研究。
本研究通过构建“化合物-靶点-疾病”网络筛选出异-德国鸢尾醛、3-甲基鼠李素、高车前素、异鼠李素、射干酮、射干醛等关键药效分子。对PPI网络进行拓扑学分析后发现,AKT1、STAT 3、HRAS、VEGFA等靶点的度值较高,与其相互作用的蛋白较多。相关研究表明[15],AKT1 在β-catenin/Tcf-4 信 号通 路促进恶性转化中发挥重要作用,AKT1可能是脑胶质瘤治疗的潜在靶点,也是防止胶质瘤转移的有效途径。STAT3在胶质瘤中广泛表达,而在瘤周组织及正常组织中的表达通常较低或不表达,STAT3的高表达会促进胶质瘤细胞的存活、增殖、迁移、侵袭等,最终导致恶性肿瘤的发生和发展[16]。RAS 蛋白在脑胶质瘤组织中高表达,并且与胶质瘤恶性程度呈正相关,而低表达的RAS蛋白可抑制胶质瘤细胞生长,促进细胞凋亡[17]。葛全兴等[18]的研究发现,VEGFR2优先表达于CD133人胶质瘤干细胞的细胞表面及恶性脑胶质瘤病灶小血管周围,其增殖、生长能力和致瘤性,可能部分依赖于VEGFR2-Neuropilin-1(NRP1)的信号传递,可能在人脑胶质细胞瘤的增殖和生长过程中发挥一定作用。因此,上述靶点可能在射干治疗脑胶质瘤的过程中发挥重要作用。
GO功能和KEGG 通路富集分析结果显示,射干治疗脑胶质瘤的过程涉及肽基丝氨酸磷酸化、蛋白激酶B信号转导、肽基丝氨酸修改等生物过程和PI3K/Akt信号通路、神经胶质瘤、Rap1 信号通路、VEGF信号通路、MAPK 信号通路、HIF-1 信号通路等通路。PI3K-Akt信号通路广泛存在于细胞中,在细胞的增殖、生长、分化过程中起着中心调控点的作用[19]。Rap1 GTP酶激活蛋白(Rap1GAP)被认为是一种肿瘤抑制基因,在多种恶性肿瘤中发挥抑癌作用[20-21]。MAPK 信息传递系统是调控细胞增殖和分化的重要信号转导通路,能够影响细胞的生长、分化和存活,与肿瘤的发生密切相关[22]。这些信号通路都与肿瘤的发生发展密切相关。
在网络药理学预测结果的基础上,本实验进一步采用射干提取物用于其对人脑胶质瘤细胞U87相关蛋白、mRNA 表达和细胞凋亡的实验研究。实验结果显示,射干提取物能够下调VEGF 和MMP9蛋白表达,通过PI3K/AKT 信号通路抑制U87细胞的增殖,这与网络药理学预测靶点蛋白和通路结果相一致。
综上所述,本研究通过网络药理学方法构建“化合物-靶点-疾病”网络和PPI网络,分析了射干治疗脑胶质瘤的活性成分、靶点以及涉及的生物过程和信号通路,并通过分子对接技术验证了关键药效分子与核心靶点之间具有较好的结合活性,结合实验验证得到了射干对于VEGF、MMP9 蛋白表达和PI3K/AKT 信号通路的作用结果,初步阐述了射干治疗脑胶质瘤的作用机制,说明了作用多成分、多靶点、多通路的特点,为后续研究和临床应用提供了参考。
