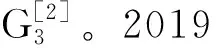阑尾黏液性肿瘤中KRAS基因突变分析
2022-09-08齐长海卢一艳刘文婷吕志勇李珂敏
李 方 侯 芳 齐长海 卢一艳 刘文婷 方 兰 吕志勇 李珂敏
阑尾黏液性肿瘤(appendiceal mucinous neoplasms, AMNs)是一类罕见的异质性阑尾肿瘤的总称,其发病机制尚不清楚。AMNs膨胀性或侵袭性浸润阑尾壁,导致黏液性肿瘤上皮及黏液播散至腹腔形成腹膜假黏液瘤(pseudomyxoma peritonei, PMP)。近年来分子病理学研究证实多种消化系统恶性肿瘤存在KRAS基因突变,使其治疗进入了分子靶向治疗的新时期。国外研究发现,AMNs存在KRAS基因的突变,但中国人AMNs是否存在KRAS基因突变还不清楚。本研究对AMNs组织采用实时荧光定量PCR法检测KRAS基因的突变,揭示AMNs中KRAS基因突变类型及突变率,探讨KRAS基因突变与临床病理特征的相关性,为其靶向治疗提供潜在靶点提供理论依据。
对象与方法
1.研究对象:回顾性收集2019年6月~2021年9月在航天中心医院进行手术切除并经病理证实的AMNs标本62例,其中低级别阑尾黏液性肿瘤(low-grade appendiceal mucinous neoplasms, LAMN)36例,阑尾黏液腺癌(mucinous adenocarcinoma, MAC)26例。62例AMNs患者中有男性22例,女性40 例,男女性别比例为1∶1.82。患者年龄29~79岁,中位年龄为59岁,年龄≤60岁的患者33例,年龄>60岁的患者29例。对入选的病例进行临床病理资料的收集。本研究经笔者医院医学伦理学委员会审批。
2.诊断标准:按照2019年第5版世界卫生组织(WHO)阑尾黏液性肿瘤的诊断标准及2017年美国癌症联合会(AJCC)肿瘤分期,由消化道肿瘤经验丰富的病理医生对以下组织病理学参数进行评估[1,2]:阑尾原发性黏液性肿瘤的类型、继发性PMP级别、脉管及神经侵犯、肿瘤分级、病理分期。将AMNs分为LAMN G1和MAC G2,将AMNs继发性PMP分为低级别PMP G1、高级别PMP G2和高级别PMP G3(高级别PMP伴有印戒细胞成分),如果原发性AMNs与继发性PMP级别不同的情况下,将综合最高的级别确定为该病例的AJCC肿瘤分级:G1(LAMN或低级别PMP)、G2(MAC或高级别PMP G2)和G3(阑尾印戒细胞癌或高级别PMP G3)。
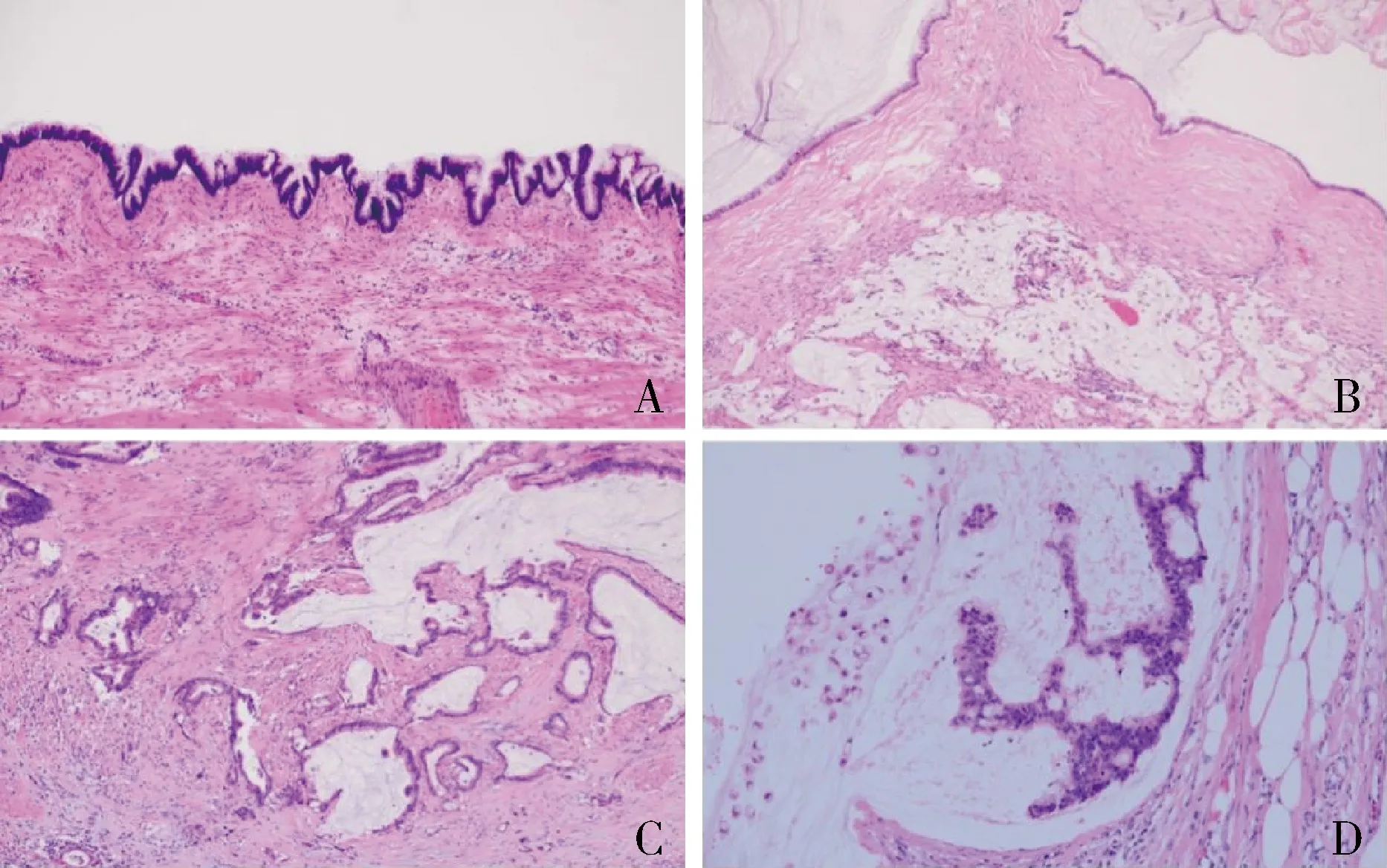
3.方法:选取每例中代表性区域的蜡块,确保肿瘤细胞含量在30%以上,用无菌刀片切取5张10μm厚的连续石蜡切片,置于无菌的1.5ml离心管中。根据核酸提取试剂盒(厦门艾德生物医药科技股份有限公司)说明书步骤提取DNA,并用紫外分光光度计测量DNA浓度。按照人类KRAS基因突变检测试剂盒(厦门艾德生物医药科技股份有限公司)所示,采用探针扩增阻滞突变系统(amplification refractory mutation system,ARMS)在荧光定量PCR仪(型号:ABI 7500)进行扩增。每批次检测均设置阳性和阴性对照。反应循环参数:95℃ 5min;95℃ 25s,64℃ 20s,72℃ 20s,15个循环;93℃ 25s,60℃ 35s,72℃ 20s,31个循环。在第3阶段60℃时收集信号,保存文件。根据各反应扩增曲线判读结果:以无模板对照扩增曲线的最高点为准设定阈值。结果判定:突变阴性:所有反应管均没出现扩增曲线或Ct 值≥阴性临界Ct值;突变阳性:①出现扩增曲线且 Ct≤26;②26 4.统计学方法:应用SPSS 25.0统计学软件对数据进行统计分析。组间比较分析采用χ2检验、连续性校正χ2检验或Fisher精确检验,以P<0.05为差异有统计学意义。 1.临床病理特征: 62例AMNs中LAMN G136例,MAC G226例。12例不伴有PMP,50例伴有PMP,其中29例伴有低级别PMP G1(其中3例伴有无细胞性黏液),21例伴有高级别PMP(高级别PMP G2为15例,高级别PMP G3为6例)。AJCC肿瘤综合分级中, G1为35例,G2为21例,G3为6例。无淋巴结转移的26例,有淋巴结转移的7例。无神经侵犯的58例,有神经侵犯的4例。无脉管侵犯的60例,有脉管侵犯的2例。AJCC病理分期中,0期5例,Ⅱ期6例(Ⅱa期4例,Ⅱc期2例),Ⅲb期1例,Ⅳa期30例,Ⅳb期20例。AMNs及继发性PMP病理形态学改变详见图1。 图1 阑尾黏液性肿瘤及继发性腹膜假黏液瘤的组织病理学改变A.低级别阑尾黏液性肿瘤G1;B.继发性低级别腹膜假黏液瘤G1;C.阑尾黏液腺癌G2;D.继发性高级别腹膜假黏液瘤伴印戒细胞成分G3 (A~C.HE,×100;D.HE,×200) 2.KRAS基因突变类型与突变率:在62例AMNs标本中,共检出KRAS基因突变52例,突变率为83.9%。对KRAS 第2、3、4号外显子均进行检测,本组AMNs病例均为 KRAS的第2号外显子突变,突变类型为12位密码子G12D、G12A、G12V、G12S、G12C,以及13位密码子G13D,其中G12D(35G>A)及G12V(35G>T)突变最为常见,分别占44.2%(23/52)及36.5%(19/52)。2例伴有12位密码子2个位点的突变,包括G12D和G12S、G12V和G12C。KRAS第3、4外显子均未检测到突变。AMNs中KRAS基因突变类型详见表1和图2。 表1 阑尾黏液性肿瘤中KRAS基因突变类型与突变率 图2 KRAS 基因突变类型及扩增曲线A.KRAS基因2号外显子G12D突变;B.KRAS基因2号外显子G12V突变 3.KRAS基因突变与临床病理特征的关系:62例AMNs中,LAMN中 KRAS 基因突变率为88.9%(32/36),略高于MAC中KRAS 基因突变率 76.9%(20/26),但差异无统计学意义(P>0.05)。低级别PMP G1及高级别PMP G2中KRAS基因突变率分别为89.7%(26/29)和80.0%(12/15),高于高级别PMP G3中KRAS基因突变率66.7%(4/6),但差异无统计学意义(P>0.05)。同样,AJCC肿瘤级别G1的KRAS基因突变率为88.6%(31/35),略高于G2(81.0%)及G3(66.7%),但差异无统计学意义(P>0.05)。此外,KRAS基因突变与性别、年龄、有无淋巴结转移、有无脉管侵犯、有无神经侵犯及 AJCC病理分期均无明显相关性(P均>0.05)。KRAS基因突变与临床病理特征的相关性详见表2。 表2 阑尾黏液性肿瘤中KRAS基因突变与临床病理特征的相关性[n(%)] AMNs及继发性PMP的发病机制尚不明确。KRAS基因位于12p12.1,是RAS基因家族的一个原癌基因,该家族还包含HRAS、NRAS等,其中KRAS基因与人类肿瘤的发生、发展关系最为密切。KRAS基因编码的K-ras蛋白是EGFR下游的丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK, 即RAS/RAF/MEK/ERK)信号通路中一个起“开关”作用的关键分子。MAPK信号通路在细胞的增殖、分化、凋亡、转移和代谢等过程中发挥着重要作用。当KRAS基因发生突变时,导致其不依赖上游的EGFR发生自身磷酸化而持续处于激活状态。多种肿瘤存在KRAS基因突变,其中胰腺癌、结直肠癌、肺癌最为常见,结直肠癌KRAS突变率为39.6%~41.3%[4~ 7]。 对于AMNs及PMP中KRAS基因的状态,仅有少数国外研究报道了小样本量病例的分子遗传学改变。Zauber等[8]对31例LAMN的KRAS基因测序结果提示100%的病例出现突变,其中 G12D 和 G12V最为常见(各占42%);并对照了正常阑尾42例,其KRAS基因均为野生型。Alakus 等[9]对10例阑尾源性PMP的全外显子测序及19例PMP热点基因测序结果提示KRAS突变率为89.6%。Noguchi 等[10]对18例PMP进行二代测序结果表明KARS突变率为77.8%。Zhu等[11]按照2017年AJCC阑尾肿瘤分级研究了21例LAMN G1、21例MAC G2及26例印戒细胞癌G3,结果发现其KRAS基因突变率分别为90%、86%、46%。本研究是对中国人AMNs中KRAS基因突变状态的研究,与既往研究报道相似,中国人KRAS基因同样存在高频突变,突变率为83.9%,最常见的位点为12号密码子G12D及G12V,分别占44.2%及36.5%。KRAS基因突变与AMNs类型、继发性PMP级别、AJCC病理分级及分期、有无淋巴结转移、有无脉管及神经侵犯等代表肿瘤恶性度的临床病理参数均无显著相关,提示KRAS基因的高频突变可能是AMNs的早期分子事件,与AMNs的进展及侵袭无关。 关于KRAS基因突变在AMNs疾病发生、发展中的作用机制,目前研究极少。AMNs及PMP显著特征是具有大量黏液性腹腔积液,黏蛋白是其重要成分,包括MUC2、MUC5B、MUC5AC[12]。MUC2、MUC5AC基因与MUC5B和MUC6共同形成MUC基因串,定位于11p15.5。多项体外实验提示MAPK信号通路可能是调控MUC2和MUC5AC过表达的重要机制。Bae等[13]研究证实,在人呼吸道上皮细胞中细菌产物通过MAPK通路诱导MUC5AC过表达。Dilly等[14]研究证实,在分泌MUC2的细胞系LS174T及小鼠腹腔内PMP异种移植模型中,使用MEK抑制剂可以减少MUC2的产生和黏液性肿瘤的生长。 KRAS基因突变在结直肠癌、肺癌患者的研究,已促使个体化治疗进入了分子靶向治疗的新时期。国内外结直肠癌诊治指南中明确提出分子靶向药物的治疗前提需检测KRAS基因突变的状态,KRAS基因突变将导致患者不能从抗EGFR靶向药物的治疗中获益。AMNs及继发性PMP目前的治疗手段匮乏,仅局限于细胞减灭手术及腹腔热灌注化疗。本研究证实中国人的AMNs同样存在高频突变,临床可探索研究使用MEK抑制剂阻断该信号通路,进而抑制黏液的产生,达成治疗PMP的目的。 综上所述,AMNs及继发性PMP是一类罕见的消化系统肿瘤,其发病机制尚不明确。本研究证实中国人AMNs中存在KRAS基因的高频突变,提示KRAS基因突变可能参与了AMNs的发病,临床可探索针对KRAS基因突变的靶向治疗。结 果



讨 论