腺苷A1受体激动剂预处理对大鼠脑缺血再灌注损伤后HIF-1α及GPx1的影响
2022-09-08郭哨恺阴雪妍谭军王露露高振华李明
郭哨恺,阴雪妍,谭军,王露露,高振华,李明
(1.新乡医学院,河南 新乡 453000;2.新乡医学院第三附属医院 神经内二科,河南 新乡 453000)
缺血性脑血管病的特点为发病率高、致残率高和死亡率高。早期治疗是改善预后,降低患者致死风险的关键。常用治疗方法为溶栓、血管内介入等。但上述治疗过程可能造成的脑缺血再灌注损伤(CIRI)也携带一定治疗风险。现阶段,药物预处理可有效改善脑缺血再灌注损伤,改善临床结局,促进患者预后转归。而具体治疗方向上临床以抗应激与抗炎症等为主,如相关指标低氧诱导因子-1α(HIF-1α)可通过调节能量代谢、抗氧化应激、抑制炎症因子的释放等一系列作用达到改善CIRI目的。另外,谷胱甘肽过氧化物酶1(GPx1)可通过抗氧化应激途径改善CIRI。基于以上两项指标对于缺血性脑血管病CIRI的重要影响,本实验针对健康雄性SD大鼠为例,制作大脑中动脉栓塞(MCAO)动物模型,探究腺苷A1受体激动剂环己基腺苷(CHA)预处理的作用价值,以及明确其与HIF-1α、GPx1之间的相关性,旨在为后续相关报道的顺利开展提供依据,现报道如下。
1 材料与方法
1.1 实验动物
选择新乡医学院健康的SD雄性大鼠为研究对象,均来自新乡医学院,共60只,周龄区间7~9周,质量区间250~350 g,所处的饲养环境通风良好,且温度适宜。本研究经河南省新乡市新乡医学院第三附属医院医学研究伦理委员会批准[新医三附院伦审(K2019-006-01)号],并严格遵守动物实验3R原则。
1.2 主要实验试剂及仪器
实验试剂:谷胱甘肽过氧化物酶1抗体(常州市祥泰生物技术有限公司)、环己基腺苷(上海源叶生物科技有限公司)、DAB显色试剂盒(北京索莱宝科技有限公司)、HIF-1α多克隆抗体(北京索莱宝科技有限公司)等。
仪器:Nikon MODEL YS100显微镜(Nikon公司)、United Imaging MR770 MR3.0T超导MRI系统(上海联影医疗科技有限公司)、WCC02大鼠磁共振线圈(上海联影医疗科技有限公司)。
1.3 实验方法
1.3.1 实验分组及建模
分组:共60只健康雄性SD大鼠随机分为以下3组:假手术组(F组,N=20只)、缺血再灌注组(IR组,N=20只)、CHA预处理组(AP组,N=20只),在此基础上,参照缺血再灌注时间(2 h、6 h、24 h、48 h),将各组分为4个亚组,各组5只。
建模:(1)于术前3 d,在同一时间点取0.9%氯化钠注射液2 mg注入F组、IR组。而AP组则注入0.9%氯化钠注射液2 mL+160 μg/kg CHA注射液。(2)在此基础上,依照线栓法,IR组、AP组制备大脑中动脉栓塞(MCAO)模型,术前常规禁食、水12 h。(3)腹腔麻醉,即于颈正中皮肤取一切口,逐层切开其皮肤组织,充分显露左侧颈动脉,包括颈外动脉(ECA)、颈内动脉 (ICA)、颈总动脉(CCA)。(4)从分叉根部结扎ECA,CCA远离分叉处结扎,ICA动脉夹夹闭,确定线栓插口的位置(分叉下方4 mm处左右),插入深度为18 mm左右,直至进入大脑的前动脉,对其中动脉的血流进行阻断。(5)标记线拴尾端,常规缝合,切口均匀涂抹适量红霉素软膏,腹腔注入0.9%氯化钠注射液2 mL,注意在整个操作过程中做好保温工作(以白炽灯照射为主)。(6)2 h后拔出线栓1 cm左右,可见大脑中动脉血供恢复至正常。(7)术后将各组大鼠分别进行单笼饲养,确定无异常即可恢复正常饮食水。
F组的操作与IR相同,但术中无线栓相关操作。
1.3.2 头颅MRI检查
48 h时,各组进行头颅MRI检查,如下:大鼠麻醉,确定麻醉起效后头置于线圈中央,进行T1WI、T2WI像常规扫描,以快速自旋回波序列为主,参数设为TE、TR分 别 为102.24 ms、3 300 ms、扫 描6 min、层 厚2 mm、激励层数3、层间距2 mm、视野及矩阵分别为35 mm×35 mm、矩阵208×216;获取梗死灶各层面图像,将其输送至处理站,经image pro plus 6.0图像处理软件计算。
1.3.3 HE染色
48 h时,各组置入4%多聚甲醛内,固定24 h后取视交叉前后脑组织,厚度为2 mm,置入包埋盒内进行脱水、石蜡包埋处理,最终制成厚度为4 μm的切片,依照HE染色标准化流程,将其制作标本,在光学显微镜下进行观察,采集图片。
1.3.4 HIF-1α及GPx1免疫组化染色方法
各组按时间点取出大脑至培养皿中,切取视交叉前后各脑组织,厚度为2 mm,进行处理,最后完成HIF-1、GPx1免疫组化检测。烤片后晾至室温,二甲苯去蜡,酒精脱二甲苯,在高压锅中行酸性修复液修复,3%的HO孵育,山羊抗兔SABC免疫组化试剂中的A液孵育,按照一定比例加入兔抗大鼠多克隆HIF-1α抗体、兔抗大鼠GPx1多克隆抗体,在4℃条件下后过夜,B液、C液孵育,DAB显色,染色程度由显微镜镜下控制。之后继续使用苏木素、盐酸酒精、梯度酒精、二甲苯分别进行复染、分化、脱水、透明,最后使用中性树胶进行封片,在光镜作用下进行观察,视情况采集图片,注意各切片需要随机取8个400倍的视野,对各视野HIF-α抗体、GPx1的积分光密度值进行计算,工具为图像处理软件,取平均值。
1.4 统计学方法
选择SPSS 22.0统计软件分析数据,变量资料行单因素方差分析,用检验。以检验水平α=0.05为标准,<0.05为差异有统计学意义。
2 结 果
2.1 大鼠头颅MRI结果比较
进行头颅MRI检查,判断左侧大脑中动脉供血区情况,可见F组无异常信号,IR、AP组有异常信号,T1WI图上存在大片低信号影,T2WI图上存在大片高信号影。在T2WI图上,IR组脑梗死体积(168.80±17.58)mm较AP组(57.20±14.45)mm大,差异有统计学意义(=10.966,<0.05)。见图1。
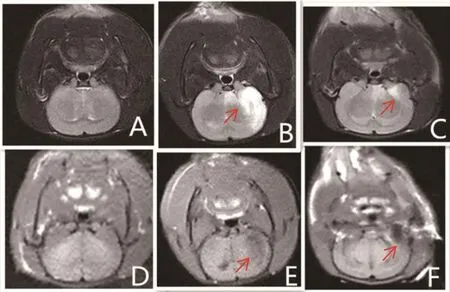
图1 各组大鼠缺血—再灌注损伤48 h后头颅MRI梗死体积
2.2 三组HE染色结果比较
HE染色,可见三组在脑缺血再灌注不同时间点的具体表现,即F组在48 h时的神经细胞结构正常,神经基质无水肿;IR组2 h、48 h时的神经细胞受损严重,如皱缩、核固缩、大小不一;AP组2 h、48 h时的神经细胞部分核固缩。AP组2 h、48 h的神经细胞受损程度较IR组轻。见图2。
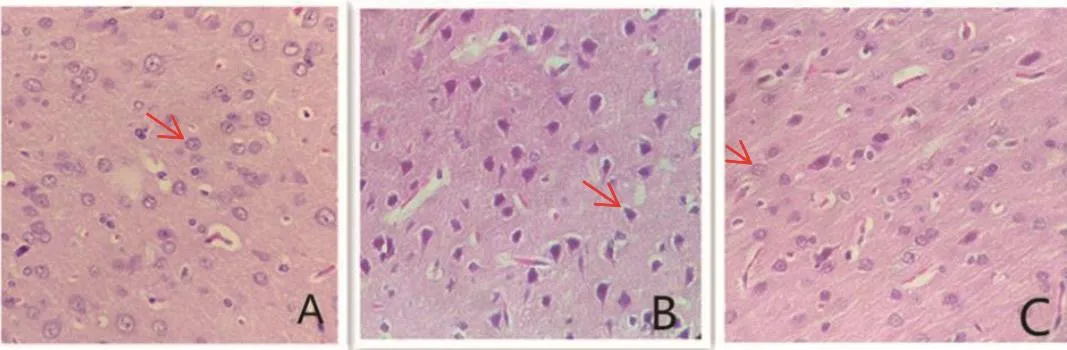
图2 为各组大鼠脑缺血—再灌注损伤后48 h脑组织HE染色(×400)
2.3 三组HIF-1α蛋白表达情况比较
与F组大鼠对比,其他组大鼠在6 h、24 h、48 h的HIF-1α蛋白表达水平相对较高,差异有统计学意义(<0.05);而AP组 大 鼠 在6 h、24 h、48 h的HIF-1α蛋白表达水平均高于IR组大鼠,差异有统计学意义(<0.05);三组大鼠之间2 h HIF-1α蛋白表达水平对比差异无统计学意义(>0.05)。见表1及图3。
表1 三组HIF-1α蛋白表达情况比较(± s )
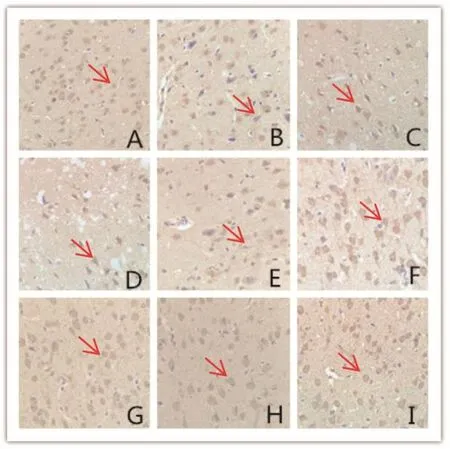
图3 大鼠脑缺血再灌注48 h后F组、IR组、AP组脑组织HIF-1α表达情况(免疫组化法,×400)
2.4 三组GPx1蛋白表达情况比较
F组GPx1蛋白呈高表达,各亚组之间比较,差异无统计学意义(>0.05);2 h时,IR组、AP组的GPx1蛋白表达呈下降趋势发展,24 h降至最低,48 h有所升高,各时间点的GPx1蛋白表达,差异有统计学意义(<0.05)。与F组比较,AP组、IR组在2 h、6 h、24 h、48 h的GPx1蛋白呈低表达,差异有统计学意义(<0.05)。与IR组比较,AP组6 h、24 h、48 h的GPx1蛋白呈高表达,差异有统计学意义(<0.05)。见表2及图4。
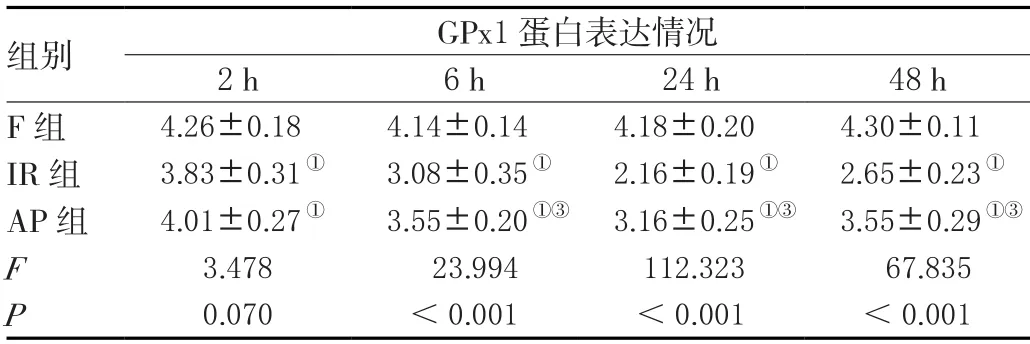
表2 三组GPx1蛋白表达情况比较(X ±s)
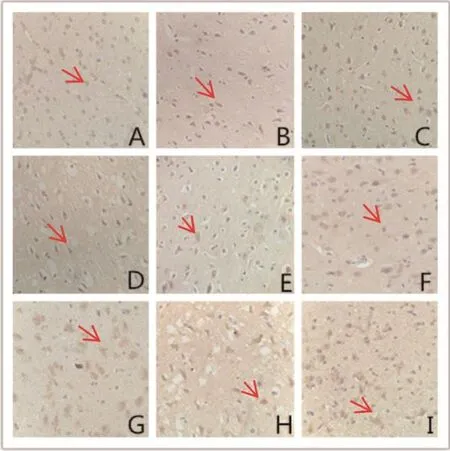
图4 大鼠脑缺血再灌注48 h后F组、IR组、AP组脑组织GPx1表达情况(免疫组化法,×400)
3 讨 论
脑缺血再灌注损伤与多种因素相关,如自由基、细胞内钙含量超常、兴奋性氨基酸毒性等。急性局灶性脑缺血所引发的缺血中心区死亡主要为细胞坏死,现阶段已经明确的是,缺血发生后7 min内,细胞能量可逐渐消耗殆尽,同时膜电位下降,经兴奋谷氨酸受体导致细胞膜Ca通道开放,造成膜结构与DNA损伤。关于脑缺血再灌注损伤的治疗,以抑制炎症级联反应、阻断细胞凋亡为主。目前,药物预处理在临床较为常用,如腺苷A1受体激动剂CPA、ATP敏感性钾通道开放剂KCO、降钙素基因相关肽等。既往有资料显示,医护人员通过短暂缺血预处理后,患者CA1区表达显著升高,同时神经细胞存活数目也较多。除以上预处理方法之外,缺血性神经保护药物在现代临床应用广泛。如钙拮抗剂中的二氢砒啶类药物,尤以尼莫地平为主,这属于特异性阻滞L型钙通道。NMDA受体阻滞剂中,竞争性NMDA受体拮抗剂的磷酸盐等。AMPA受体拮抗剂,可预防钠进入细胞,同时也可预防细胞去极化及其引发的改超载情况。
3.1 腺苷A1受体激动剂预处理对大鼠脑缺血再灌注损伤具有保护作用
目前,已有多项研究指出药物预处理可通过药物激发内源性神经保护因子作用,达到神经保护的目的。根据CHA预处理后大鼠CIRI 48 h组HE染色的结果,分析可以得出AP组大鼠脑组织神经细胞损伤程度较IR组明显减轻,大鼠头颅MRI F组无梗死灶,而AP组梗死灶体积较IR组明显缩小,差异有统计学意义(<0.05)。此结果代表,CHA预处理更有助于降低梗死程度,对于急性缺血性再灌注损伤具有重要意义。而其中腺苷A1受体激动剂预处理可减轻再灌注损伤,此结果可指导促进今后相关治疗(溶栓、血管内介入等)的进一步发展,还可为部分缺血再灌注的神经外科手术患者是否使用前腺苷A1受体激动剂预处理提供指导建议,以保证治疗效果,改善临床结局,降低致残率。
3.2 腺苷A1受体激动剂预处理发挥脑保护作用的机制
上调HIF-1α蛋白的表达:本研究指出,低氧条件下HIF-1α的增加可促进缺血半暗带的再灌注,解除患者脑水肿状态,保护其脑神经。考虑与调节下游靶基因表达有关,机制如下:(1)上调血红素加氧酶1抗氧化酶水平,提高自由基清除率,减少损害程度。(2)促进抗凋亡因子的高表达,以及阻断促凋亡因子的表达。(3)可诱导糖酵解相关酶类的表达,调节脑组织能量代谢。由此可见,HIF-1α作为CRIR的治疗靶点具有一定的优势。本实验指出CHA预处理提高HIF-1α蛋白的高表达。IR组、AP组在2 h时的HIF-1α蛋白增高,24 h达到高峰,48 h有所下降,该结果表示环己基腺苷预处理的作用效果较显著,尤其是在促进受损神经细胞的修复方面,但是对其缺氧状态改善所需时间的减短无作用。在此基础上,结合HIF-1α的脑保护作用,推测腺苷A1受体激动剂的使用具有良好的作用效果,改善再灌注损伤,保护脑神经阻滞,与上调HIF-1α蛋白表达密切不可分。
本研究发现,与缺血再灌注比较,CHA预处理后GPx1蛋白在2 h、6 h、24 h、48 h的表达均增高,这无疑为机体对抗氧自由基损伤提供了更多保障。GPx1蛋白主要生理功能是作为生物酶催化谷胱甘肽(GSH)清除人体细胞胞质、胞膜和胞外的过氧化氢、脂质过氧化物和有机过氧化物等有害代谢产物。腺苷A1受体激动剂更有利于减轻再灌注损伤,避免功能障碍的发生,促进预后转归,考虑与上调GPx1蛋白高表达密切相关。
经上述结果分析,认为缺血再灌注组24 h的HIF-1α、GPx1蛋白达到高峰,24 h以内进行药物治疗可在一定程度上将脑缺血再灌注损伤程度降至最低,以获取更理想的临床疗效。HIF信号级联反应会受到缺氧状态的影响,在缺氧状态下,通常会让细胞持续的细胞分化。HIF-1α在缺血再灌注早期基于缺血或损伤可致水平快速升高,而用药治疗后基于损伤减轻促使其水平明显改变。
综上所述,再灌注损伤发生后的24 h以内可作为最佳治疗时间窗,此阶段采取腺苷A1受体激动剂CHA预处理,可保护患者脑组织神经,考虑到其与调节HIF-1α、GPx1蛋白的高表达有关,为此本研究认为在预处理血管再通后24 h内重复给药是十分重要的,可减轻患者神经功能的缺损程度,促进其预后恢复。
