虾夷扇贝裙边酶解物美拉德反应产物的自由基清除活性
2022-09-07崔小凡杜椅楠孙世广韩佳润阎佳楠姜昕昱李傲婷吴海涛
崔小凡,杜椅楠,孙世广,韩佳润,阎佳楠,姜昕昱,李傲婷,吴海涛
(大连工业大学食品学院 国家海洋食品工程技术研究中心 辽宁大连 116034)
扇贝(Patinopecten yessoensis)属双壳软体动物,具有丰富的营养价值。2018年,中国扇贝的水产养殖总量高达192 万t。近年来,扇贝养殖业发展迅速,在其加工过程中,裙边大多作为副产物被丢弃,造成了严重的资源浪费。
大量研究表明酶解可有效回收水产品副产物的功能成分,其水解产物大多具有良好的抗氧化能力[1],前期研究表明[2],扇贝裙边中富含丰富的蛋白质,可以通过酶解方式来制备其功能性酶解产物。研究发现,虾夷扇贝的肌肉[2]、扇贝边[3]和马氏珠母贝肉的酶解物[4]均具有良好的自由基清除能力。然而,有关虾夷扇贝雄性生殖腺酶解产物抗氧化能力的研究未见报道。
美拉德反应是在加热过程中肽、蛋白质、氨基酸与还原糖之间的反应,其所产生的风味物质会进一步影响食品风味[5]。此外,一些研究表明,美拉德反应可以用来提高大豆蛋白酶解物[6]、海参肠酶解物[7]、鲷鱼鳞多肽[8]和牡蛎酶解物[9]的抗氧化活性。本课题组前期研究发现,美拉德反应有效增强了栉孔扇贝裙边酶解物的羟自由基和ABTS 自由基清除能力[10]。美拉德反应对虾夷扇贝裙边酶解物抗氧化活性的影响有待研究。
本文用虾夷扇贝裙边酶解物和核糖制备美拉德反应产物,探究反应过程中中间体物质的形成,颜色和挥发性化合物的变化。此外,探究酶解物和美拉德反应产物的羟自由基、DPPH 和ABTS 自由基清除能力,为虾夷扇贝裙边蛋白的高值化利用提供试验依据。
1 材料与方法
1.1 原料及主要试剂
虾夷扇贝,购自大连长兴市场;中性蛋白酶,购自南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)和购自美国Sigma-Aldrich 公司;核糖、木瓜蛋白酶、L-酪氨酸、EDTANa2,购自生工生物工程(上海)股份有限公司;二甲基吡咯啉氮氧化物(DMPO),购自阿拉丁试剂(上海)有限公司;2,6-二叔丁基对甲酚(BHT),购自天津光复精细化工研究所;其它试剂均为生化试剂或分析纯级。
1.2 主要仪器与设备
电子顺磁共振波谱仪(ESR),购自德国Bruker BioSpin 公司;气相色谱-质谱联用仪,购自安捷伦(中国)科技有限公司;高速低温离心机,购自HITACHI;精密电子天平,购自美国双杰兄弟(集团)有限公司;精密pH 计,购自上海雷磁仪器厂;酶标定量测定仪,购自TECAN;紫外-可见分光光度计,购自上海光谱仪器有限公司。
1.3 方法
1.3.1 制备虾夷扇贝裙边冻干粉 虾夷扇贝裙边经沸水浴10 min 变性处理后冷冻干燥,粉碎后于-30 ℃保存备用。
1.3.2 SDS-PAGE 分析 参照Zhao 等[11]的方法对虾夷扇贝裙边冻干粉的蛋白质分子质量分布进行分析。用1×上样缓冲液制备蛋白质量浓度为1 mg/mL 的样品溶液,经沸水浴10 min 后摇动12 h,将蛋白质样品(10 μL)加载到聚丙烯酰胺凝胶中(5%的浓缩胶,10%的分离胶)进行分析,浓缩胶电流为7 mA,分离胶电流为15 mA。试验结束后,用考马斯亮蓝G250 染色液对凝胶进行染色,脱色后成像。
1.3.3 制备虾夷扇贝裙边酶解物 采用中性蛋白酶(酶活为204 326 U/g)对虾夷扇贝裙边冻干粉进行酶解,酶解条件为:加酶量3 000 U/g 蛋白、底物质量分数4%、pH 7.0、酶解温度50 ℃,酶解时间分别为0.5,1,2,3 h。酶解后的溶液于沸水浴10 min 后离心4 000×g,10 min,将上清液收集后冷冻干燥,制得不同酶解时间的虾夷扇贝裙边酶解物(SMHs)并通过pH-stat 法计算其水解度(DH)[12],其计算公式如下:

式中,B——保持pH 不变所消耗碱(NaOH)的体积,mL;Nb——碱的物质的量浓度,mol/L;Mp——底物中蛋白总量,g;htot——底物蛋白质中肽键总数,mmol/g,其中本研究中htot为7.5;α——水解过程中α-氨基的解离度,具体计算公式如下:

式中,pH——溶液的酸碱度;pK——电离平衡常数。
1.3.4 制备美拉德反应产物 用去离子水配制20 mg/mL 的酶解物溶液和40 mg/mL 的核糖溶液,将两种溶液按体积比1∶1 混合后调至pH 7.0,分装于4 mL 旋盖玻璃瓶中,然后置于干浴器中在95 ℃条件下加热4 h 或12 h 以获得虾夷扇贝裙边酶解物-核糖美拉德反应产物(MRPs),将美拉德反应产物冷冻干燥后于-30 ℃保存备用。
1.3.5 美拉德反应产物的褐变程度 将制得的美拉德反应产物溶液用去离子水稀释到合适倍数后用紫外分光光度计测定其在波长294 nm (稀释100 倍)和420 nm(稀释5 倍)处的吸光值。
1.3.6 美拉德反应产物挥发性物质组成 取3 mL 美拉德产物原液于10 mL 分析小瓶中,加入20 μL 的内标物(环己酮,100 mg/L) 后通过HSSPME/GC/MS 进行检测,色谱柱为HP-5MS 5%聚苯基甲基硅氧烷30 m×250 μm×0.25 μm,升温程序为:初温35 ℃,保持3 min;以3 ℃/min 的速度升温到70 ℃,以10 ℃/min 的速度升温至200℃,以20 ℃/min 的速度升温至260 ℃,保持5 min;分流进样,载气流量(He)为l.5 mL/min,进样量为1 μL。扫描条件为:全谱扫描:质量扫描范围29~400 amu;电子能量70 eV;传输线温度280 ℃;四极杆温度150 ℃;离子源温度230 ℃。
1.3.7 DPPH 自由基的清除能力测定 利用磷酸盐缓冲溶液(PBS)(pH 6.0,0.1 mol/L)配制不同的样品溶液,取300 μL 样品溶液与200 μL DPPH(200 μmol/L)溶液混合均匀后避光反应30 min,2 000×g 离心10 min 后收集上清,转移至毛细管中,将毛细管的一端用凡士林封口后,放入谐振腔中检测其ESR 波谱,测试条件为:中心磁场强度3 317.71 G,微波功率5.07 mW,微波频率0.44 GHz,调制幅度1.00 G,调制频率为100.00 kHz,时间常数327.68 ms,转换时间160.00 ms。同时以BHT 为对照,DPPH 的清除率(E)的计算公式如下:

式中,ho——将PBS 溶液替代样品溶液后测得ESR 图谱中间最高峰的峰高;hx——样品溶液测得的ESR 图谱中间最高峰的峰高。
1.3.8 羟自由基清除能力测定 参照Wu 等[13]方法对虾夷扇贝酶解物美拉德反应产物的羟自由基清除能力进行检测。利用磷酸盐缓冲溶液(PBS,pH 7.4,0.15 mol/L)配制不同的样品溶液。取样品溶液78 μL,DMPO 溶液(1 mmol/L)5 μL,EDTANa2和FeSO4混合液 (6 mmol/L)10 μL,H2O2(6%)8 μL,混合均匀于40 ℃条件下反应30 min 后转移到毛细管中,将毛细管的一端用凡士林封口后,放入谐振腔中检测羟自由基信号谱图,测试条件为中心磁场强度3 368.99 G,微波功率0.721 mW,微波频率9.44 GHz,调制幅度1.00 G,调制频率为100 kHz,时间常数81.92 ms,转换时间40 ms,同时以维生素C 为对照,羟自由基清除率(E)计算公式如下:

式中,h1——将PBS 溶液替代样品溶液后测得ESR 图谱中第2 个峰的峰高;h2——样品溶液测得的ESR 图谱中第2 个峰的峰高。
1.3.9 ABTS 自由基清除能力测定 参照Han 等[10]的方法进行试验。将过硫酸钾 (2.4 mmol/L)与ABTS 溶液(7.0 mmol/L)按照体积比1∶1 的比例混合均匀后于室温下避光反应12 h 制备ABTS 自由基储备液。使用前以pH 7.4 的PBS 溶液(0.2 mol/L) 为溶剂稀释ABTS 自由基储备溶液至波长734 nm 处吸光值为0.7±0.02。将10 μL 样品溶液与1 mL 稀释后的ABTS 溶液混合避光反应6 min 后在波长734 nm 处测定其吸光值并使用如下公式计算样品的ABTS 自由基清除率(S):

式中,A0——超纯水代的吸光值;As——样品的吸光值。
1.3.10 统计方法 试验数据以平均值±标准差表示。采用http://www.physics.csbsju.edu/stats/t-test.html 在线软件进行student's t 检验,P<0.05 表示结果具有显著性差异。
2 结果讨论
2.1 虾夷扇贝裙边蛋白质分子质量分布
凯氏定氮结果表明,虾夷扇贝裙边冻干粉中含有约77%的蛋白质。由图1可知,虾夷扇贝裙边中蛋白质主要分布于200 ku (肌球蛋白重链),97 ku(副肌球蛋白)和42 ku(肌动蛋白)。肌球蛋白重链和肌动蛋白是水产动物中常见的蛋白质组分,比如竹荚鱼(Trachurus trachurus)[14]和大黄鱼[15]。Nozawa 等[16]发现虾夷扇贝肌肉中的蛋白质组分主要分布在230,210,100 ku 和45 ku。此外,分子质量约为97~110 ku 的副肌球蛋白也广泛存在于海洋动物肌肉中[17],比如章鱼[18]和海参[11]。

图1 虾夷扇贝裙边的SDS-PAGE 分析Fig.1 SDS-PAGE of scallop (P.yessoensis) mantle
2.2 虾夷扇贝裙边的酶解曲线
由图2所示,在酶解前30 min 内水解度快速上升,分别达到了17.33%和8.37%,在30~120 min 缓慢升高,120 min 后趋于稳定。在水解3 h后,虾夷扇贝裙边酶解物的水解度(DH)达到28.95%。Wu 等[13]也发现用中性蛋白酶酶解虾夷扇贝雌性生殖腺3 h 后,其水解度能够达到34.25%,这些结果表明中性蛋白酶对虾夷扇贝裙边具有良好的酶解作用。

图2 虾夷扇贝裙边粉酶解过程中的水解度曲线Fig.2 DH curve of scallop (P.yessoensis)skirt powder in the process of hydrolysis
2.3 虾夷扇贝裙边酶解物-核糖美拉德反应产物的紫外吸光度及褐变程度
美拉德反应产物在波长294 nm 和420 nm 处的吸光值可以分别用来表示美拉德反应中间产物的生成和褐变程度。如图3a 所示,随着加热时间的延长,美拉德反应产物在波长294 nm 下的吸光度显著升高,加热4 h 和12 h 后获得的美拉德反应产物的吸光度是酶解物的3.33 倍和10.67 倍。海参肠酶解物-核糖美拉德反应产物也呈现出了相似的结果[7]。
褐变程度也经常用来表征食物的美拉德反应程度。由图3b 所示,加热时间为0 h 的美拉德反应产物在波长420 nm 处的吸光值仅有0.07,然而,加热4 h 和12 h 后,吸光度显著增加,尤其是加热12 h 后美拉德反应产物的吸光度是未加热的13 倍。Sun 等[19]研究发现,鸡肉副产物的MRPs褐变程度随着加热时间延长而增大。这些结果表明在美拉德反应过程中,有大量的中间产物和褐色物质生成。

图3 虾夷扇贝裙边酶解物-核糖美拉德产物在294 nm(a)、420nm(b)的UV 吸光度Fig.3 The UV-vis spectra of the MRPs of scallop (P.yessoensis) skirt hydrolysates were obtained at 294 nm (a) and 420 nm (b)
2.4 虾夷扇贝裙边酶解物及其美拉德产物挥发性成分分析
利用GC-MS 对酶解物及其美拉德产物的挥发性成分进行分析,结果如表1所示,酶解物中只有25 种挥发性成分,包括13 种醛类、3 种酮类、1种醇类、1 种酸类、1 种酯类、3 种杂环类和3 种烷烃类,而美拉德反应产物中挥发性成分分别达到32 种(美拉德反应4 h)和30 种(美拉德反应12 h),与酶解物相比,经美拉德反应后有1 种醛类、2种酮类、6 种醇类、4 种酯类、11 种杂环类和2 种烷烃类生成。此外不同加热时间获得的美拉德产物,生成的风味物质组成也有差异。由表1可知,杂环化合物的含量随着反应时间的增加而升高,尤其是糠醛(美拉德反应的标志性产物[20])。经美拉德反应4 h 后醇类的种类增加,但继续进行美拉德反应至12 h 时,醇类的种类呈现降低的趋势,这可能是由于长时间的加热导致醇类物质的挥发,使其检出量降低[21]。
醛是虾夷扇贝裙边酶解物及其美拉德产物中的主要挥发性成分。苯甲醛与甜味、果味、焦糖味有关[22]。在虾夷扇贝裙边酶解物及其美拉德产物中共鉴定出了5 种酮,这些酮可以散发出令人愉悦的气味[23]。此外,其它挥发性化合物也可以改善食品的风味,例如苯甲醛(水果味、甜味)和1,1-十二烷二醇(水果味),这些结果表明,美拉德反应可以用来改善虾夷扇贝裙边酶解物的风味。
由表1可知,杂环化合物是12 h 后美拉德反应产物中的主要风味物质,尤其是糠醛,含量最高。Han 等[7]研究发现,糠醛含量与美拉德产物DPPH 自由基清除能力之间的相关系数为0.958。此外,美拉德反应后2H-吡喃-6-羧酰胺2H-吡喃-2-酮的含量也明显增加,这可能也会改善其自由基清除能力[7]。虾夷扇贝裙边酶解物及其美拉德产物的自由基清除能力需要进一步研究。

表1 虾夷扇贝裙边酶解物及其美拉德产物的GC-MS 分析结果Table 1 GC-MS analysis result of the scallop (P.yessoensis) mantle hydrolysates and MRPs

(续表1)
2.5 虾夷扇贝裙边酶解物及其美拉德反应产物的自由基清除能力
2.5.1 羟自由基的清除能力 羟自由基是重要的活性氧,具有很强的氧化能力。进一步通过ESR的方法来检测虾夷扇贝裙边酶解物及其美拉德反应产物的羟自由基清除能力[13]。由图4可知在同一酶解时间下,羟自由基清除能力呈现MRPs-12 h>MRPs-4 h>SMHs 的趋势,并且酶解1 h 以后,酶解物本身的羟自由基清除能力也显著提高。另外,美拉德反应12 h 后获得的反应产物的羟自由基清除能力是酶解物的1.51~1.80 倍。通过酶解3 h 后的酶解物及其相应的美拉德反应产物的ESR信号可以看出,酶解物和美拉德反应产物的ESR信号强度均显著下降,且随着美拉德反应时间延长,信号强度降低的越明显,这与栉孔扇贝裙边酶解物的美拉德反应产物的研究结果一致[24]。这些结果表明,美拉德反应可以有助于提高虾夷扇贝裙边酶解物的羟自由基清除能力。

图4 虾夷扇贝裙边酶解物及其美拉德反应产物的羟自由基清除能力和ESR 图谱Fig.4 Hydroxyl radical scavenging capacity and the ESR spectra of the scallop (P.yessoensis) mantle hydrolysates and MRPs
2.5.2 DPPH 自由基清除能力 图5显示了在不同酶解时间下,虾夷扇贝裙边酶解物及其美拉德反应产物的DPPH 自由基清除能力。低浓度的酶解物在不同酶解时间下DPPH 自由基清除能力均为0%,无明显DPPH 自由基清除能力。然而,经过美拉德反应后,MRPs 表现出了较强的DPPH 自由基清除能力。此外,酶解1~3 h 后的酶解物对应的美拉德产物具有更高的DPPH 自由基清除能力。通过酶解3 h 后的酶解物及其相应的美拉德反应产物的ESR 信号可以看出,酶解物的ESR 信号强度与空白组相比没有明显变化,而美拉德反应产物的ESR 信号强度显著下降,且随着美拉德反应时间延长,信号强度降低的越明显。进一步对虾夷扇贝裙边酶解物及其美拉德反应产物进行冻干后分析,发现其IC50值分别为10.3(SMHs),0.57 mg/mL(MRPs-4 h)和0.37 mg/mL(MRPs-12 h),均高于BHT(0.016 mg/mL)。
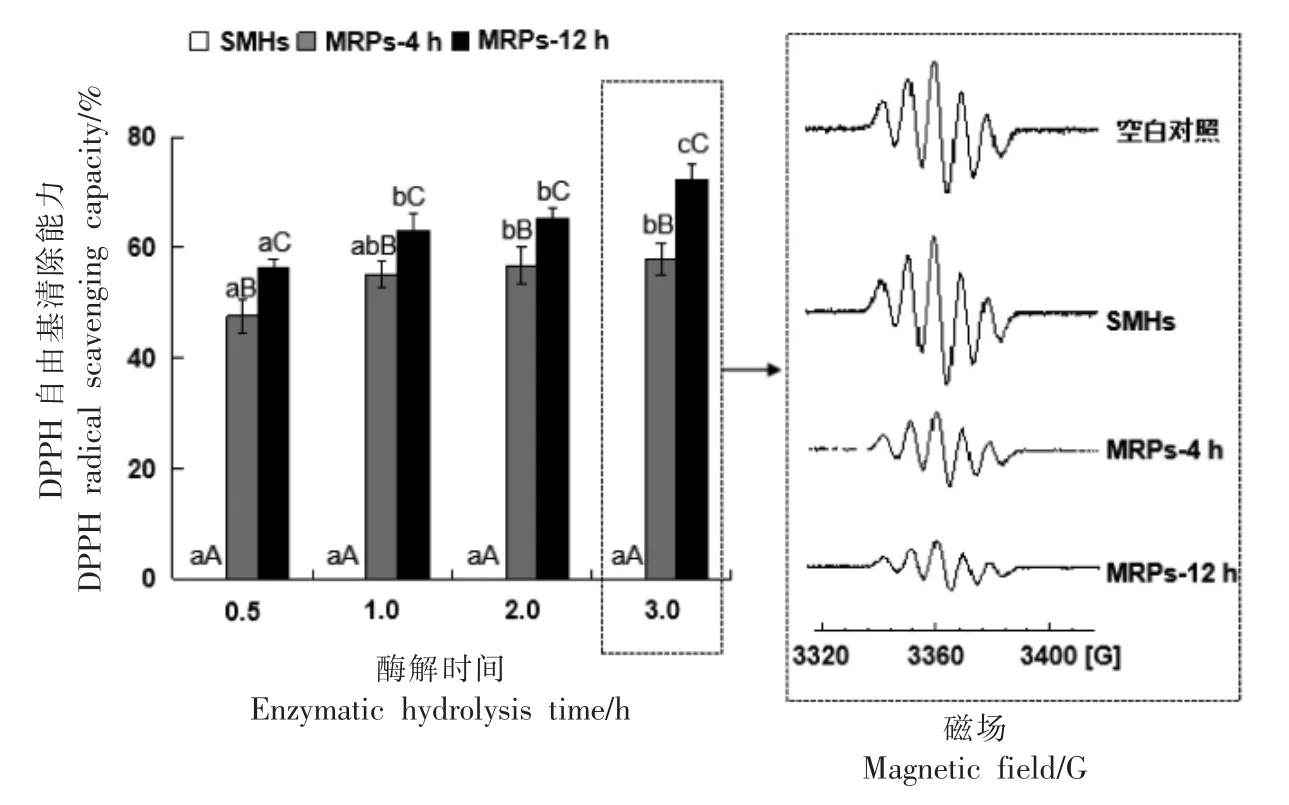
图5 虾夷扇贝裙边酶解物及其美拉德反应产物的DPPH 自由基清除能力和ESR 图谱Fig.5 DPPH radical scavenging capacity and the ESR spectra of the scallop (P.yessoensis)mantle hydrolysates and MRPs
2.5.3 ABTS 自由基的清除能力 图6显示了虾夷扇贝裙边酶解物及其美拉德反应产物的ABTS自由基清除能力。在同一酶解时间下,ABTS 自由基清除能力呈现MRPs-12 h>MRPs-4 h>SMHs的趋势,并且酶解1 h 以后,酶解物本身的ABTS自由基清除能力也显著提高。酶解3 h 后获得的酶解物具有最高的ABTS 由基清除能力(31.64%)。此外,经美拉德反应后,不同酶解时间获得的酶解物的ABTS 自由基清除能力均有了显著提高,其中美拉德反应12 h 获得的酶解物的ABTS 自由基清除能力是酶解物的2.18~2.49 倍,海参肠酶解物-核糖美拉德产物也显示出相似的结果[25]。综上,美拉德反应可以用作提高虾夷扇贝裙边酶解物抗氧化能力的有效方法。

图6 虾夷扇贝裙边酶解物及其美拉德反应产物的ABTS 自由基清除能力Fig.6 The ABTS radical scavenging capacity of the scallop (P.yessoensis) mantle hydrolysates and MRPs
3 结论
美拉德反应后,虾夷扇贝裙边酶解物的中间产物数量、褐变程度和风味物质均有所增加。并且其羟自由基、DPPH 和ABTS 自由基清除能力也得到显著改善。综上,美拉德反应可用于增强虾夷扇贝裙边酶解物的自由基清除能力,而虾夷扇贝裙边酶解物的美拉德反应与自由基清除能力之间的关系尚需进一步研究。
