合并同侧颈内动脉海绵窦段狭窄的颈动脉内膜切除术后脑灌注改变
2022-09-07韩枫许灿陈超旭王翠张建霞王元朔郑军孙晓枫
韩枫 许灿 陈超旭 王翠 张建霞 王元朔 郑军 孙晓枫
脑卒中是目前我国致残致死率极高的疾病,且发病率呈逐年上升趋势。缺血性脑卒中在全部脑卒中中的比例由1991年的38.0%增加到2000年63.2%,增加了66%[1]。颈动脉狭窄是进展性缺血性卒中的独立危险因素之一[2],自20世纪50年代至今,颈动脉内膜切除术(carotid endarterectomy,CEA)已成为治疗颈动脉狭窄的金标准手术技术。CEA能否让更多患者受益,一方面与术后脑灌注改善与否有关,一方面与术后并发症发生率有关。颈动脉起始部(颅外段)狭窄合并同侧海绵窦段(颅内段)狭窄者,由于颅内段动脉狭窄的存在,也许并不能真正改善,如此,则患者受益大大减少,手术指征变窄。此类患者脑灌注情况的科学研究,对于判断手术指征具有重要意义。CTP具有普及率高、时间和空间分辨力高、操作简便、检查时间短、后处理简便、获得数据快等优点,获得的参数较为全面,可以同时获得MTT、TTP、CBF、CBV等参数[3]。是评估脑灌注较好的方式。
1 资料与方法
1.1 一般资料 选取石家庄市第二医院及河北医科大学第二医院2018年6月至2020年1月颈动脉内膜切除术患者52例,男36例,女16例;年龄55~72岁,平均年龄(61.85±6.73)岁,均为症状性重度颈动脉狭窄患者。依据术前CT血管造影检查(CT angiography,CTA)是否存在同侧颈内动脉海绵窦段中度狭窄(定义狭窄标准为:69%≥管径狭窄程度≥50%)将研究对象分为狭窄组(40例)和无明显狭窄组(12例)。见图1、2。
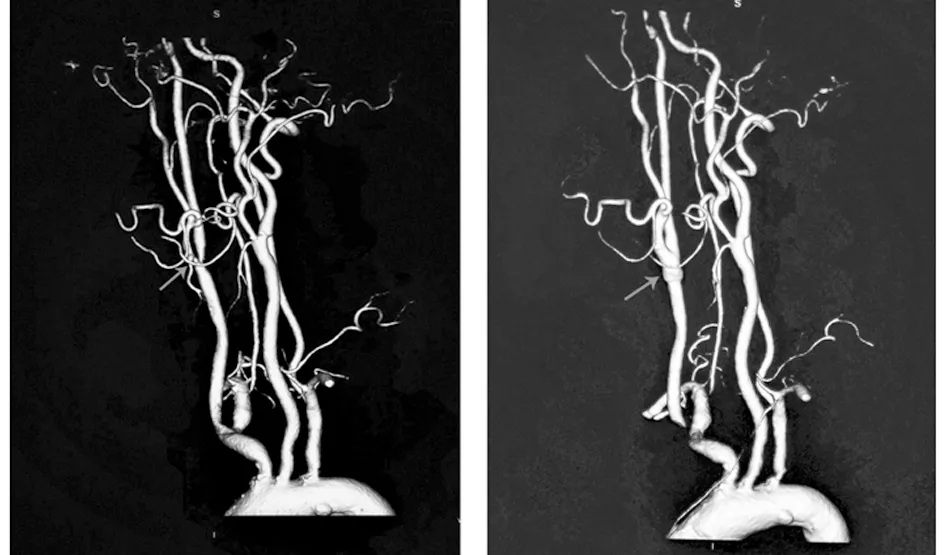
图1 左侧:右侧颈内动脉起始段狭窄之CTA影像;右侧:术后影像(箭头所指处即狭窄部位,可见术后血管管径明显增粗,已恢复正常)
图2 颈内动脉海绵窦段狭窄之CTA影像(箭头所指处即狭窄部位,接近于颈内动脉末段)
1.2 纳入标准 (1)经CTA证实的重度颈内动脉狭窄,狭窄程度参考NASCET协作组标准;(2)有头晕、记忆力下降、短暂性脑缺血发作等症状或脑梗死(至少1个月以前)病史。
1.3 排除标准 (1)存在心源性脑灌注降低风险,如心脏房颤或机械瓣置换术后栓子脱落、心肌梗死、心功能不全;(2)肝肾功能不全导致造影剂或药物代谢异常;(3)存在其他缺血性疾病,如烟雾病等。
1.4 方法
1.4.1 CTP成像方法:2组患者均于术前1周、术后1个月分别行头颅CTP检查。采用美国GE Optima CT680计算机X线断层摄影机(64排)及飞利浦256i计算机X线断层摄影机(128排)。在常规颅脑CT平扫后行CTP扫描,扫描参数如下:管电压:100 kV;管电流:180 mA;管电流乘以时间:80 mAs;层厚5 mm;矩阵:512×512;间隔时间:1 s;扫描时间分别为:16 s及60 s;扫描范围分别为40 mm(以基底节区为中心)及160 mm。造影剂注射方法:应用高压注射器经肘静脉团注含碘造影剂碘海醇50 ml,使用注射速率4.0 ml/s,0.9% 氯化纳溶液30 ml助推,速率4.0 ml/s。
1.4.2 图像处理与数据收集:将采集后的影像数据传输到后处理工作站,利用系统配置的软件进行分析,获得图像。选定患侧皮层下、大脑前动脉供血区、大脑中动脉供血区、基底节区大小15~45 mm的椭圆形区域作为ROI,注意避开血管和脑沟、脑回。手动矫正大脑中线位置,软件于健侧自动对称生成相同形状的大小的ROI作为参照。对于MTT、TTP,取各ROI与对称位置的数值A患与A对。将术前(A患-A对)/A患×100%的值记为Δ术前,将术后(A患-A对)/A患×100%的值记为Δ术后。若Δ术后<Δ术前,认为手术导致MTT、TTP值改变,则合并颈内动脉海绵窦段中度狭窄对手术效果无影响;若Δ术后≥Δ术前,认为手术未导致MTT、TTP值改变,则合并颈内动脉海绵窦段中度狭窄对手术效果有影响。对于CBF、CBV,取各ROI与对称位置的数值A患与A对。将术前(A对-A患)/A患×100%的值记为Δ术前,将术后(A对-A患)/A患×100%的值记为Δ术后。若Δ术后<Δ术前,认为手术导致CBF、CBV值改变,则合并颈内动脉海绵窦段中度狭窄对手术效果无影响;若Δ术后≥Δ术前,认为手术未导致CBF、CBV值改变,则合并颈内动脉海绵窦段中度狭窄对手术效果有影响。
2 结果
2.1 MTT结果 无明显狭窄组术后发生MTT改变者6例,未发生改变者6例;狭窄组术后发生MTT改变者12例,未发生改变者28例。见图3、4,表1。

图3 CEA术后脑灌注改变的CTP影像;左右两图由左至右、由上至下分别显示了CBV、CBF、MTT、TTP,左图为术前,右图为术后,可见手术侧(左侧)的脑灌注发生了改变

表1 狭窄组与无明显狭窄组术后MTT好转情况 例
2.2 TTP结果 无明显狭窄组术后发生TTP改变者7人,未发生改变者12例。狭窄组术后发生TTP改变者12例,未发生改变者21例。见图3,表2。

表2 狭窄组与无明显狭窄组术后TTP好转情况 例
2.3 CBF结果 无明显狭窄组术后发生CBF改变者9例,未发生改变者7例;狭窄组术后发生CBF改变者14例,未发生改变者22例。图3、图4,表3。
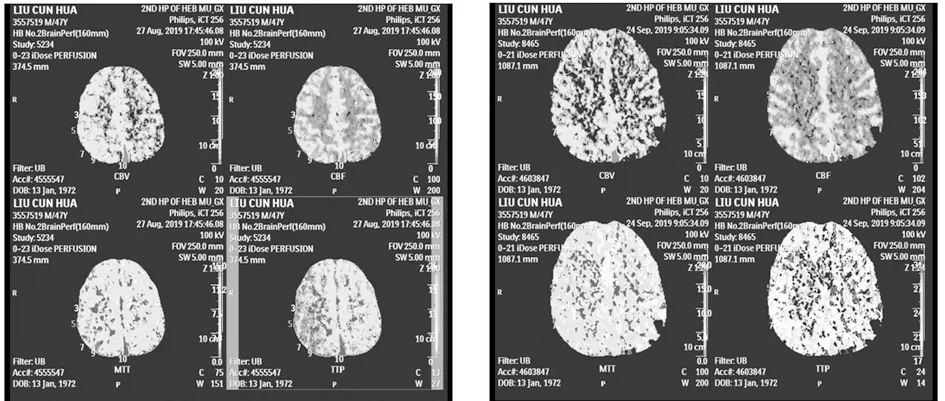
图4 CEA术后脑灌注改变不明显的CTP影像;左右两图由左至右、由上至下分别显示了CBV、CBF、MTT、TTP,左图为术前,右图为术后,可见手术侧(左侧)的脑灌注改善不明显

表3 狭窄组与无明显狭窄组CBF术后好转情况 例
2.4 CBV结果 无明显狭窄组术后发生CBV改变者9例,未发生改变者7例;狭窄组术后发生CBV改变者11例,未发生改变者25例。图3、图4,表4。

表4 狭窄组与无明显狭窄组CBV术后好转情况 例
3 讨论
CEA 手术成为治疗颈动脉狭窄的金标准手术技术,被北美症状性颈动脉内膜切除术试验[4]和欧洲颈动脉外科手术试验[5]等大型临床研究证实。CEA 手术虽是一种可以有效降低缺血性脑卒中发生率,并且安全有效的手术术式,但作为一种“预防性手术”,详尽的术前评估仍是确定手术指征的关键[6]。
CEA术后理论上脑灌注会增加,郑宇等[7]用彩色多普勒成像和经颅多普勒超声观察:CEA术后,颈动脉管径、血流速度恢复正常,患侧的大脑中动脉流速及搏动指数升高,侧支循环关闭。但颈内动脉分为颅外段和颅内段,颅内段按其行程可分为延续的5段:岩段、海绵窦段、膝段、床突上段和终段[8]。通过临床观察,我们发现颈动脉分叉部(颈总动脉末段与颈内动脉起始段)血管狭窄常合并颈内动脉颅内海绵窦段狭窄,在翻阅文献过程中也发现有相同观点,比如颈内动脉起始部血管的狭窄程度与颈内动脉虹吸钙化形态呈显著正相关,颈内动脉虹吸部钙化积分分值越高,颈内动脉起始部血管狭窄的发生率越高,检测颈内动脉虹吸部钙化积分,可以作为头颈部血管狭窄性病变的有效依据[9]。对于这种病变类型,我们常称之为颅内外颈动脉串联性病变(tandem carotid lesions,TCL)或复杂病变。这种颅内外血管同时狭窄的情况在一些糖尿病、高血压病患者中尤为常见,检出率也在逐渐升高。我们发现,很多医生也有相同顾忌,把此类情况列为CEA手术的相对禁忌症。有研究把“排除同侧颈内动脉颅内段重度狭窄或动脉瘤”列为手术适应症[10]。随着我国步入老年化社会,颅内外动脉病变发生率逐渐增加,黄治飞等[11]在缺血性脑卒中患者颅内外脑动脉狭窄的分布及其危险因素分析中,共选取颅内外动脉有狭窄或闭塞病变的155例患者,其中颅内外动脉串联病变者27例,占36%,因此,全面评估颅内外合并动脉狭窄情况非常必要。评价脑灌注的主要技术有CT灌注成像(CT perfusion,CTP)、动态磁敏感增强磁共振灌注成像(DSCPWI)、多普勒超声造影(CEUS)、正电子发射体层成像(PET)、单光子发射计算机断层成像(SPECT)等[3]。而近年来,用CTP评估缺血性脑血管病的手术指征,已成为行业内共识。有研究通过对CEA术后CTP数据与体感诱发电位、微血管多普勒超声等数据进行比较,得出CTP将成为CEA手术的一种重要辅助监测手段结论[12]。袁晖等[13]通过分析CTP在重度症状性颅内动脉狭窄支架成形术前后的变化,得出结论:CTP检查对于重度症状性颅内动脉粥样硬化性狭窄的手术治疗前评估有重要指导意义。王菁等[14],根据入院CTP变化将症状性颅内动脉狭窄患者分为低灌注组与正常灌注组,发现颅内低灌注患者宜选择支架介入术+双抗药物治疗,颅内正常灌注患者宜选择单纯强化药物治疗。以上研究结果均基于对CTP数据进行的分析。
很多学者从不同角度对串联病变的手术方式和效果进行了深入研究。曲乐丰等[15]提出“TCL曲氏分型”(QU classification of TCL),认为颈动脉分叉+颅内段颈内动脉病变的干预指征需同时满足以下几点:(1)症状性颈内动脉狭窄;(2)颅内ICA病变为责任病灶;(3)CTA或DSA等影像学检查明确存在70%以上重度狭窄,且远端存在流出道;(4)头颅CTP明确患侧颅内存在低灌注。手术方式包括CEA+Fogarty导管或HyperForm颅内球囊取栓、CEA+颅内段颈动脉支架成形术、颅外段+颅内段颈动脉支架成形术[15]。对比我们,也是选择了症状性重度颈动脉狭窄的患者,且术前CTP检查证实脑灌注不足。我们的研究结果,合并颈内动脉海绵窦段中度狭窄对CEA手术效果没有影响。可能因为颈内动脉海绵窦段发出的细小分支,包括海绵窦支、硬脑膜支、垂体分支等,均不向大脑实质内供血,所以一般此段血管狭窄不会引起脑梗死,不是脑缺血病变的责任病灶。且颈内动脉海绵窦段狭窄程度为中度,与重度者相比较可能有所不同。张志强等[16]认为,单侧血管颅内外串联病变均需要处理者,一般病变多出现在一侧颈内动脉起始处及同侧大脑动脉处中至重度狭窄。只要患者一般情况较好,能耐受手术,造影剂总量在控制范围之内,可以同时打开2处狭窄血管而不受顾忌。介入治疗后患者干预侧颈动脉重度狭窄开通后,不仅同侧大脑半球供血得到改善,而且因Willis环等脑部复杂的侧支动脉的作用,可在其他脑部动脉发生狭窄或闭塞时能够及时提供相对更多的侧支循环血液供应,故而降低了卒中的发生率[16]。韩金涛等[17]认为,应当积极处理串联病变,因为在低灌注性脑梗死事件中,无法单独区分责任病变,进行同期腔内治疗处理串联病变是安全的。但同时需要术前详细的评估以及完善的手术预案。王涛[18]认为,对于多发狭窄(尤其颅内狭窄)者,首选血管内支架成形术。研究认为,症状性重度颈内动脉海绵窦段狭窄患者经支架置入治疗后,脑缺血症状明显缓解。支架置入术治疗颈内动脉海绵窦段狭窄安全有效。严格筛选患者,特别是考虑病变长度<15 mm,对于减少支架内再狭窄非常有帮助[19]。可以说,以上专家在一定程度上已达成共识,即对于同侧颈动脉颅内颅外段复杂病变的处理,采取血管内治疗方式更安全有效。
此外,对于脑动脉Willis环的代偿作用,研究发现,双侧颈内动脉重度狭窄性病变行一侧颈动脉内膜切除术患者中,前交通动脉开放者术后能同时改善非手术侧的脑灌注,CTP各参数较术前均有改善[20]。用实际数据客观分析,印证了Willis环的代偿作用。
综上,合并颈内动脉海绵窦段中度狭窄的症状性重度颈动脉狭窄患者,仍可单纯行CEA手术,海绵窦段的颈内动脉中度狭窄并不影响术后患侧脑灌注,患者仍可从手术中获益,达到脑血流情况改善、减少缺血性卒中再次发生的目的。
