仙茅苷调控circ_0004104对ox-LDL诱导的血管内皮细胞损伤的影响
2022-09-07姚黎洁张茜
姚黎洁 张茜
动脉粥样硬化(AS)是一种慢性多因素血管疾病,是引起卒中、心肌梗死、外周动脉疾病和冠状动脉粥样硬化性心脏病等心脑血管疾病的重要原因[1]。氧化低密度脂蛋白(ox-LDL)是AS进展的危险因素,其可增加氧化应激和炎性反应,增强内皮细胞凋亡,导致内皮损伤,促进AS发生发展[2]。因此,减轻ox-LDL诱导的血管内皮细胞损伤可能是防治AS的潜在策略。仙茅苷是从仙茅科仙茅属植物仙茅干燥根茎中提取的酚苷类抗氧化剂,具有抗骨质疏松、神经保护等多种生物活性[3,4]。已经证实仙茅苷通过抑制线粒体通透性转换孔(MPTP)开放来降低线粒体介导的凋亡水平,从而保护心肌缺血再灌注损伤[5]。仙茅苷在体内和体外均能减轻实验性脑缺血损伤[6,7]。然而,仙茅苷对ox-LDL诱导血管内皮细胞损伤的保护作用并不清楚。环状RNA(circRNA)是由前体mRNA反向剪切形成的闭环结构RNA分子,其通过翻译蛋白、吸附miRNA、与RNA结合蛋白相互作用等途径参与细胞基本过程,circRNA异常表达与AS进展有关[8]。研究显示冠心病患者中circ_0004104显著上调[9]。circ_0004104可能参与ox-LDL介导的血管内皮细胞凋亡、炎症和氧化应激反应[10]。本研究采用ox-LDL诱导人脐静脉血管内皮细胞(HUVEC)构建AS细胞损伤模型[11],探讨仙茅苷对ox-LDL诱导血管内皮细胞损伤的保护作用,并以circ_0004104为切入点探讨其可能机制,以期为AS治疗提供潜在策略。
1 材料与方法
1.1 材料 HUVEC、Ham’s F-12K培养液、胎牛血清、青链霉素混合液购自武汉普诺赛生物公司;ox-LDL购自杭州华安生物技术有限公司;仙茅苷(纯度98%,货号C3504)购自南京春秋生物工程有限公司;si-NC、si-circ_0004104、pcDNA-circ_0004104购自上海生工生物公司;膜联蛋白V(annexin V)-异硫氰酸荧光素(FITC)凋亡检测试剂盒、增强化学发光试剂盒购自南京诺唯赞生物公司;磷酸甘油醛脱氢酶(GAPDH)兔多抗(ab9485)、B细胞淋巴瘤-2(Bcl-2)兔多抗(ab196495)、山羊抗兔IgG二抗(ab205718)、Bcl相关x蛋白(Bax)兔多抗(ab104156)购自美国Abcam公司;Trizol试剂、Lipofectamine 2000、RevertAid第一链cDNA合成试剂盒购自美国Invitrogen公司;TB Green Premix Ex Taq Ⅱ购自大连宝生物公司。
1.2 方法
1.2.1 细胞培养和分组:HUVEC采用Ham’s F-12K培养液(添加0.1 mg/ml肝素、0.03 mg/ml的内皮细胞生长因子、10%胎牛血清、1%青链霉素混合液)在含95%空气、5%CO2、37℃培养箱孵育,胰蛋白酶消化80%汇合的细胞,1∶2传代。将第3代HUVEC接种24孔板,细胞密度为2×104个/孔,用Lipofectamine 2000将si-NC、si-circ_0004104、pcDNA-circ_0004104分别转染50%汇合的HUVEC,转染48 h收集HUVEC。正常培养的HUVEC标记为对照(con)组;用含 200 μg/ml ox-LDL培养液孵育HUVEC 24 h[11],标记为ox-LDL组;分别用含0.5 μmol/L、5 μmol/L、50 μmol/L仙茅苷的培养液预处理HUVEC 24 h[12],然后给予和ox-LDL组相同的处理,分别标记为ox-LDL+仙茅苷0.5 μmol/L组、ox-LDL+仙茅苷5 μmol/L组、ox-LDL+仙茅苷50 μmol/L组;用含 200 μg/ml ox-LDL培养液孵育转染si-NC、转染si-circ_0004104的细胞,分别标记为ox-LDL+si-NC组、ox-LDL+ si-circ_0004104组;用含50 μmol/L仙茅苷的培养液预处理转染pcDNA-circ_0004104细胞24 h,然后给予和ox-LDL组相同的处理,标记为ox-LDL+仙茅苷50 μmol/L+ pcDNA-circ_0004104组。
1.2.2 流式细胞术检测凋亡率:向各组细胞沉淀中加入1×结合缓冲液调整细胞浓度。分别取5 μl Annexin-V-FITC、5 μl碘化丙啶添加到约含1×105个细胞的500 μl细胞悬液中。避光孵育20 min。上流式细胞仪检测各组HUVEC凋亡率。
1.2.3 Western blot检测Bax和Bcl-2蛋白表达:预冷的PBS冲洗各组HUVEC,加入RIPA缓冲液裂解细胞,提取的蛋白质样品用BCA试剂盒定量。用十二烷基硫酸钠-聚丙烯酰胺凝胶分离各组HUVEC蛋白样品,然后利用湿法转膜装置转移分离的蛋白至聚偏氟乙烯膜上。膜在5%脱脂牛奶缓冲液中封闭2 h,随后与抗GAPDH、Bax、Bcl-2的一抗在4℃孵育12 h,漂洗膜后,将膜与二抗室温孵育2 h。用增强化学发光试剂盒进行显色反应。Image J软件分析目的条带相对于内参的灰度值以表示其表达水平。
1.2.4 试剂盒测定细胞内SOD活性、MDA水平以及LDH释放量:HUVEC处理完毕后,分析收集细胞培养液和细胞沉淀至新的离心管内。参照LDH活性检测试剂盒分析细胞培养液上清中LDH活性以表示LDH释放量。预冷的PBS洗涤细胞沉淀后,按照每5×106个细胞用1 ml提取液比例加入提取液,超声破碎细胞,收集上清置于冰上。参照SOD活性检测试剂盒、MDA检测试剂盒分析HUVEC内SOD活性、MDA水平。
1.2.5 RT-qPCR检测circ_0004104表达:采用Trizol试剂提取细胞RNA样品,用RevertAid第一链cDNA合成试剂盒进行逆转录,用TB Green®Premix Ex TaqTMⅡ扩增cDNA进行RT-qPCR。反应体系包括2×TB Green® Premix Ex TaqTMⅡ为10 μl,上游引物0.8 μl,下游引物0.8 μl,20×ROX Reference Dye 0.4 μl,cDNA模板2 μl,灭菌水6 μl。circ_0004104的相对表达水平以2-ΔΔCt法计算,GAPDH为内参。circ_0004104上游引物5’-AGACCTGTGACCTGGAC AATG-3’,下游引物5’-GTGCA CTTTGTGGCAAAGAA-3’;GAPDH上游引物5’-AAGAAGG TGGTGAAGCAGG C-3’,下游引物5’-GTCAAAGGTGGAGGAGTGGG-3’。
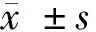
2 结果
2.1 仙茅苷对ox-LDL诱导的HUVEC凋亡的影响 与con组比较,ox-LDL组HUVEC凋亡率、Bax蛋白表达显著升高(P<0.05),Bcl-2蛋白表达显著降低(P<0.05);与ox-LDL组比较,ox-LDL+仙茅苷(0.5、5、50 μmol/L)组HUVEC凋亡率、Bax蛋白表达显著降低(P<0.05),Bcl-2蛋白表达显著升高(P<0.05)。见图1,表1。
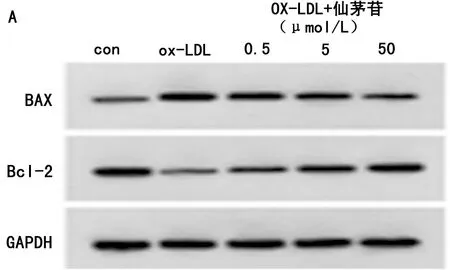
图1 仙茅苷对ox-LDL诱导的HUVEC凋亡的影响;A 仙茅苷对ox-LDL诱导的HUVEC中Bax、Bcl-2蛋白表达的影响;B 仙茅苷抑制ox-LDL诱导的HUVEC凋亡
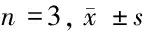
表1 仙茅苷对HUVEC凋亡的检测
2.2 仙茅苷对ox-LDL诱导的HUVEC中SOD、MDA水平以及LDH释放的影响 与con组比较,ox-LDL组HUVEC中SOD活性低(P<0.05),MDA水平、LDH释放量升高(P<0.05);与ox-LDL组比较,ox-LDL+仙茅苷(0.5、5、50 μmol/L)组HUVEC中SOD活性升高(P<0.05),MDA和LDH降低(P<0.05)。见表2。
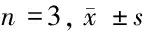
表2 仙茅苷对HUVEC中SOD活性、MDA水平以及LDH释放的影响
2.3 下调circ_0004104对ox-LDL诱导的HUVEC凋亡及SOD、MDA、LDH的影响 与ox-LDL+si-NC组比较,ox-LDL+si-circ_0004104组HUVEC凋亡率、Bax蛋白表达、MDA水平、LDH释放量显著降低(P<0.05),Bcl-2蛋白表达、SOD活性显著升高(P<0.05)。见表3,图2。
表3 下调circ_0004104对HUVEC凋亡及SOD、MDA、LDH的检测
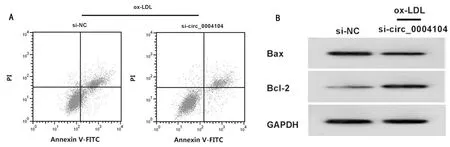
图2 下调circ_0004104对ox-LDL诱导的HUVEC凋亡的影响;A 下调circ_0004104抑制ox-LDL诱导的HUVEC凋亡;B 下调circ_0004104对ox-LDL诱导的血管内皮细胞中Bax、Bcl-2蛋白表达的影响
2.4 仙茅苷对ox-LDL诱导的HUVEC中circ_0004104表达的影响 与con组比较,ox-LDL组HUVEC中circ_0004104相对水平显著升高(P<0.05);与ox-LDL组比较,ox-LDL+仙茅苷(0.5、5、50 μmol/L)组HUVEC中circ_0004104相对水平显著降低(P<0.05)。见表4。
表4 仙茅苷对HUVEC中circ_0004104表达的检测
2.5 上调circ_0004104逆转仙茅苷对ox-LDL诱导的HUVEC凋亡及SOD、MDA、LDH的影响 与ox-LDL组比较,ox-LDL+仙茅苷 50组HUVEC凋亡率、Bax蛋白表达、MDA水平、LDH释放量显著降低(P<0.05),Bcl-2蛋白表达、SOD活性显著升高(P<0.05);与ox-LDL+仙茅苷 50组比较,ox-LDL+仙茅苷 50+pcDNA-circ_0004104组HUVEC凋亡率、Bax蛋白表达、MDA水平、LDH释放量显著升高(P<0.05),Bcl-2蛋白表达、SOD活性显著降低(P<0.05)。见图3,表5。
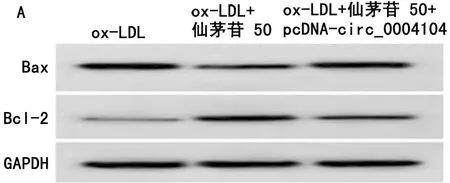
图3 上调circ_0004104可减弱仙茅苷对ox-LDL诱导的HUVEC凋亡的作用;A 上调circ_0004104可减弱仙茅苷对ox-LDL诱导的HUVEC中Bax、Bcl-2蛋白表达的作用;B 上调circ_0004104可减弱仙茅苷对ox-LDL诱导的HUVEC凋亡抑制作用
表5 上调circ_0004104逆转仙茅苷对HUVEC凋亡及SOD、MDA、LDH的作用
3 讨论
本研究探讨仙茅苷对ox-LDL诱导HUVEC损伤的保护作用,结果表明ox-LDL处理使HUVEC凋亡率、MDA水平、LDH释放量升高,SOD活性降低,这与井汶等[13]报道结果吻合。Bax和Bcl-2是参与细胞凋亡调控的关键蛋白,Bax可促进MPTP形成和细胞色素c释放发挥凋亡促进作用,而Bcl-2具有抗凋亡作用,研究发现仙茅苷通过上调海马神经元Bcl-2表达、下调Bax表达,抑制神经元凋亡,进而改善老年痴呆模型大鼠空间学习记忆功能[14]。本研究中仙茅苷预处理显著降低ox-LDL诱导HUVEC中Bax表达水平,增加Bcl-2表达水平,与仙茅苷的抗凋亡作用吻合。氧化应激是AS的一个关键特征,其可破坏内皮功能,进一步诱导内皮细胞凋亡。研究指出仙茅苷通过抑制过度氧化应激和心肌细胞凋亡来改善H2O2诱导心肌细胞损伤。仙茅苷还可增加抗氧化酶活性,抑制脂质过氧化,减少细胞凋亡,抑制H2O2诱导的HUVEC损伤[15]。本研究发现仙茅苷可降低ox-LDL诱导的MDA水平,抑制LDH释放,提高SOD活性,表明仙茅苷可改善抗氧化防御系统,抑制ox-LDL诱导HUVEC氧化应激损伤。
研究发现circRNA表达参与AS发展的病理生理过程,包括血管内皮细胞功能改变,例如circRNA INK4位点反义非编码RNA(circANRIL)可减轻AS大鼠血管内皮损伤、氧化应激和炎性反应[16];circ_0003204靶向miR-370-3p抑制ox-LDL诱导的内皮细胞增殖、迁移和管状形成[17]。因此,circRNA具有作为AS治疗靶点的潜力。本研究发现ox-LDL处理后HUVEC中circ_0004104水平显著增加,这与前人报道结果[10]一致。目前,关于circ_0004104的报道较少,Yue等[18]指出胃癌中circ_0004104表达上调,抑制circ_0004104表达可降低胃癌细胞体外增殖和转移能力,抑制谷氨酰胺代谢,抑制胃癌进展。circ_0004104通过TGF-β途径促进心肌纤维化在持续性房颤中发挥潜在调控作用[19]。仙茅苷预处理显著降低ox-LDL诱导HUVEC中circ_0004104水平,提示仙茅苷可能通过抑制circ_0004104表达发挥作用。与Zhang等[10]报道一致,本研究显示抑制circ_0004104表达可降低ox-LDL诱导的HUVEC凋亡和MDA水平,抑制LDH释放,提高SOD活性。为证实仙茅苷的抗凋亡、抗氧化应激损伤依赖于circ_0004104表达下调,本研究将pcDNA-circ_0004104转染HUVEC,结果表明,过表达circ_0004104明显减弱仙茅苷对ox-LDL诱导HUVEC凋亡和氧化应激损伤的保护作用,这进一步证实仙茅苷对ox-LDL诱导HUVEC损伤的保护作用是通过下调circ_0004104表达实现的。
总之,本研究证实仙茅苷通过下调circ_0004104表达可减轻ox-LDL诱导的HUVEC凋亡和氧化应激损伤,这为仙茅苷在防治AS中的应用提供实验证据。
