EBV及PD-L1在局部晚期鼻咽癌中的研究进展
2022-09-07罗丽华张思佳向东华易俊林
罗丽华 张思佳 向东华 易俊林
作者单位:445000 恩施 1恩施土家族苗族自治州中心医院肿瘤科;100021 北京 2中国医学科学院肿瘤医院放疗科;430021 武汉 3华中科技大学同济医学院附属协和医院肿瘤中心
鼻咽癌(nasopharyngeal carcinoma,NPC)发病率具有明显的地域特色,高发区主要分布在我国南方、东南亚和北非等国家和地区[1]。NPC发病隐匿,初诊时70%~80%的患者已为局部晚期[2]。在复发/转移性NPC患者中,以PD-1/PD-L1免疫检查点抑制剂为靶点的免疫治疗取得了良好的临床获益。在以单药免疫检查点抑制剂作为复发/转移性NPC挽救治疗的KEYNOTE-028[3]、NCI-9742[4]、POLARIS-02[5]、SHR-1210[6]及CAPTAIN[7]研究中,有效率达20%~30%,显示出了较好的抗肿瘤效应。在此基础上,免疫治疗联合化疗进一步提高了复发/转移性NPC的疗效,包括CAPTAIN-1st[8]和 JUPITER-02[9]等多项临床研究已经证实“免疫治疗+”模式能使更多的NPC患者获益。然而,尽管单药免疫检查点抑制剂或联合化疗治疗复发/转移性NPC取得了一定疗效,但仍然只有部分患者从中获益,因此在临床实践中筛选出这部分获益人群尤为重要,而寻找特异性的生物标志物成为当前研究的重点方向之一。
既往研究已证实NPC发病与EB病毒(epstein-barr virus,EBV)感染密切相关,90%以上的高发区NPC患者血浆EBV DNA呈阳性,尤其是局部晚期NPC患者因肿瘤负荷大,外周血中EBV DNA检出率和拷贝数往往较高[10]。NPC的病理学特征主要表现为肿瘤病变周围及瘤内免疫细胞高度浸润,其中EBV诱导的鼻咽非角化癌与EBV阴性NPC相比PD-L1呈过表达,提示NPC的肿瘤微环境(tumor microenvironment,TME)处于免疫抑制状态[11]。目前已有研究探索EBV DNA拷贝数及PD-L1表达与肿瘤免疫微环境的关系及其作为筛选和指导局部晚期NPC治疗决策指标的可能性,本文结合国内外相关文献就此进行综述。
1 鼻咽癌的肿瘤微环境
TME主要由肿瘤细胞、周围的免疫和炎症细胞、肿瘤相关的成纤维细胞、附近的间质组织、微血管及各种细胞因子和趋化因子构成,是一个复杂的综合系统[12]。TME可以分成以免疫细胞为主的免疫微环境和成纤维细胞为主的非免疫微环境[13]。在肿瘤发生发展过程中,肿瘤细胞和TME往往是相互作用的,两者共同介导了肿瘤的免疫耐受,TME中的免疫逃逸机制为恶性肿瘤的侵袭、转移、治疗抵抗及复发等提供了有利条件[14]。目前所知的肿瘤免疫逃逸机制主要包括肿瘤的直接免疫逃逸和肿瘤微环境介导的免疫逃逸。NPC的发生发展与其肿瘤细胞的免疫逃逸密切相关,其中与NPC相关的肿瘤的直接免疫逃逸主要包括肿瘤细胞表面MHC-Ⅰ类分子表达下降或缺失[15-17]、肿瘤细胞缺乏共刺激分子[18]以及Fas/FasL系统介导的免疫逃逸[19]。与NPC相关的TME介导的免疫逃逸则包括肿瘤相关免疫抑制分子和肿瘤相关免疫抑制性细胞[20]。在常规病理检查中,肿瘤中免疫细胞浸润极为常见,癌巢也通常被免疫细胞包绕[21]。GONG等[22]对14例NPC或鼻咽部淋巴结增生(nodular lymphoid hyperplasia,NLH)患者进行单细胞测序分析,发现T细胞和B细胞是NPC免疫微环境中最主要的免疫细胞类型,但其中1例分化型NPC患者表现为骨髓和B细胞浸润异常,提示NPC分化程度可能影响TME免疫细胞浸润;耗竭型和免疫抑制T细胞表型的富集是NPC微环境的肿瘤特异性表现。免疫检查点分子PD-1及其配体PD-L1对肿瘤免疫逃逸和免疫治疗至关重要,在NPC中,免疫检查点分子的上调如PD-L1表达上调是关键的免疫逃逸机制[11]。除此之外,NPC还存在其他关键的免疫逃逸机制,如EBV通过慢性免疫激活显著塑造NPC的TME,最终影响肿瘤进展和治疗结果。
1.1 EBV与鼻咽癌的肿瘤微环境
NPC是与EBV感染密切相关的恶性肿瘤,NPC的TME中存在大量浸润性白细胞,其中中性粒细胞[23]、自然杀伤(natural killer,NK)细胞[24]、单核细胞[25]和树突状细胞(dendritic cells,DCs)[26]代表EBV感染的第一道防线。EBV与其主要包膜糖蛋白gp350结合到中性粒细胞表面并刺激抗病毒细胞因子的产生,包括IL-1α、IL-1β、IL-8和巨噬细胞炎症蛋白1(macrophage inflammatory protein-1,MIP-1)[27-28]。由 于 EBV 的gp85-gp25-gp42复合物可以直接与NK细胞上的HLA-Ⅱ类分子结合[29]。因此,NK细胞是EBV感染的潜在靶点。EBV的dUTP焦磷酸酶通过MyD88依赖性激活NF-κB诱导巨噬细胞表达并分泌TNF-α、IL-1β和IL-6[30-31]。对于单核细胞,除了由活化的巨噬细胞产生的炎性细胞因子外,EBV还刺激干扰素诱导蛋白-10(IFN-inducible protein-10,IP-10)、MIP-1、单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)及IL-8等趋化因子的产生[32-33]。NPC细胞常表达EBV抗原如潜伏性膜蛋白1(latent membrane protein 1,LMP1)、潜伏性膜蛋白2(latent membrane protein 2,LMP2)、EB病毒核抗原1(epstein-Barr nuclearantigen1,EBNA1)等,EBV相关的NPC细胞则表达CD4+T细胞、CD8+T细胞的靶蛋白,这些靶蛋白可诱导免疫细胞浸润到癌组织中,进而参与形成肿瘤免疫微环境,并在肿瘤早期发挥免疫监视作用[34-35]。TME处于依赖于肿瘤期别的动态演变过程中,肿瘤细胞突破机体自身免疫监视,TME会呈现免疫抑制状态。EBV感染的NPC通过激活特定的机制形成和塑造有利于肿瘤自身生长的环境。LIU等[36]研究发现EBV感染诱导了人单核细胞来源的巨噬细胞(monocyte-derived macrophages,MDMS)中的IDO表达,从而抑制了T细胞增殖并损害了CD8+T细胞毒活性。该研究结果提示EBV诱导巨噬细胞IDO表达并导致巨噬细胞极化为促肿瘤形态,从而抑制T细胞的抗肿瘤功能,最终促进免疫抑制微环境形成。此外,肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)与EBV感染的NPC细胞共存也代表了NPC独特的TME,它参与了肿瘤早期的免疫防御[37]。有研究显示,EBV编码的病毒产物可改变宿主细胞信号,从而促进肿瘤的发展和进展[38]。而随着EBV病毒基因产物的大量增加,淋巴细胞调控失衡会导致后期的免疫逃逸及肿瘤的发生发展[37]。在细胞间,EBV感染的肿瘤细胞通过分泌细胞因子和趋化因子或通过释放肿瘤外泌体来抑制间质细胞,从而抑制免疫监视和促进转移[39]。EBNA1是EBV编码的核抗原,在EBV基因组的维持和复制中起关键作用[35]。HUO等[40]研究发现EBNA1作为肿瘤加速剂通过TGFβ1-SMAD3-PI3K-AKT-c-JUN-miR-200a-CXCL12-CXCR4轴增强Treg细胞的趋化迁移而促进NPC的免疫逃逸。ZHAO等[41]对19例EBV DNA阳性NPC患者组织和7例非恶性鼻咽活检组织中约104 000个细胞进行单细胞测序,同时分析了NPC细胞、EBV DNA、间质和免疫细胞的转录组学数据,发现NPC细胞具有上皮/免疫细胞双重特征,且与不良预后有关。肿瘤细胞的双重特征也与CD8+T细胞表面共抑制受体的表达呈正相关[42]。此外,具有双重特征的肿瘤细胞能抑制T细胞产生IFN-γ,造成肿瘤免疫抑制微环境[36]。ALIYAH等[43]回顾性(n=27)和前瞻性(n=23)收集了50例NPC组织标本,发现在EBV相关NPC的TME中,M2型巨噬细胞的存在与Treg细胞相关,且两种类型细胞都与肿瘤大小和临床分期紧密联系。总之,EBV通过促进EBV感染细胞的生长和防止细胞凋亡来影响TME,还会通过调控众多细胞信号转导通路及免疫效应分子来抵消宿主免疫而促进NPC的免疫逃逸。
1.2 PD-L1与鼻咽癌免疫微环境
NPC的肿瘤免疫微环境非常复杂。TIL中包括CD4+T、CD8+T和CD57+NK细胞等,这些细胞起到免疫监视和杀伤肿瘤细胞作用[44]。TME中也存在抑制肿瘤免疫反应的成分,如髓源性抑制细胞(myeloidderived suppressor cells,MDSCs)增加,PD-L1过表达,以及与T细胞耗竭和失能相关的各种共刺激因子包括细胞毒性T淋巴细胞相关抗原4(CTLA-4),淋巴细胞激活基因3(LAG-3),T细胞免疫球蛋白和ITIM结构域(TIGIT)以及T细胞免疫球蛋白和黏蛋白结构域(TIM3)等的表达[45-46]。NPC的TME呈现免疫抑制状态,其中免疫检查点PD-1/PD-L1通路是非常重要的免疫抑制机制。肿瘤细胞表面常表达PD-L1,当其与肿瘤浸润T淋巴细胞上的PD-1结合时可导致T细胞功能耗竭,从而出现免疫抑制状态[47]。免疫检查点PD-1/PD-L1通路的调控非常复杂,肿瘤细胞膜上PD-L1表达可以是一种适应性免疫现象,也可以是一种内源性的癌基因事件[48]。PD-L1的调节机制有肿瘤抑癌基因PTEN基因突变或丢失,促癌基因PI3K通路激活,AKT/mTOR、NF-κB和MAPK信号通路下调等,当PD-L1的表达依赖于某些致癌信号通路激活或者不依赖于T细胞浸润时,通常被认为是一个不良预后因素[42,49]。PD-L1的表达也可以通过T细胞分泌的IFN-γ诱导的JAK2/STAT1信号通路进行调节,当PD-L1表达由外部信号导致时,其CD8+T细胞浸润会增加,此时IFN-γ诱导的PD-L1表达可能是一种对抗适应性免疫系统的机制[50]。DENG等[51]分析了212例NPC患者,发现NPC中肿瘤细胞的PD-L1表达率较高,表达率达61.3%,而且在PD-L1表达患者肿瘤中CD68+巨噬细胞(P=0.001)和CD163+巨噬细胞(P<0.0001)密度明显高于PD-L1阴性表达者,CD68+巨噬细胞和CD163+巨噬细胞的密度与PD-L1表达呈正相关且与预后相关,其中PD-L1高表达和CD163+巨噬细胞密度高的患者预后较好。ONO等[52]分析了66例NPC的TME与其预后的关系,同样发现肿瘤细胞表达PD-L1和高CD8+TIL密度患者具有较好的预后,肿瘤细胞表达PD-L1和低CD8+TIL密度提示患者预后差。由此可见,PD-L1可能介导了NPC的免疫逃避,但是单个分子PD-1或PD-L1表达可以表现为不同的病理生理意义及不同的预后价值,因此免疫微环境还需要进行综合评估。
2 EBV及PD-L1在鼻咽癌中的作用
2.1 EBV基因与PD-1/PD-L1免疫检查点通路
有研究[34]发现EBV诱导的LMP1和IFN-γ通路共同调控NPC的PD-L1表达,PD-L1在EBV阳性NPC细胞中的表达高于EBV阴性NPC细胞,而诱导外源性和内源性LMP1均可增加PD-L1的表达。该研究还发现LMP1通过STAT3、AP-1和NF-κB信号通路上调PD-L1,而PD-L1通过与免疫细胞上的PD-1结合抑制人体免疫系统反应,逃避人体免疫系统监视与杀伤,从而促进肿瘤细胞生长[34]。因此,同时阻断LMP1致癌通路和PD-1/PD-L1免疫检查点可能成为治疗EBV阳性NPC患者的一种潜在手段。此外,PD-L1的其他组合表达(如MHC-Ⅱ和PD-L1)也被提示能更好地筛选出NPC免疫治疗获益人群,值得进一步深入研究。
T细胞抗原受体与抗原呈递细胞上的MHC分子结合后,T细胞可以识别和消除癌细胞并执行免疫监视功能。然而,肿瘤细胞通过各种机制逃避免疫监视[53-54]。例如,肿瘤细胞表现出高PD-L1表达,并在T细胞表面与PD-1相互作用,以阻止肿瘤抗原特异性T细胞的有效激活,从而导致肿瘤免疫逃逸[55]。PD-L1表达受转录前、转录、翻译和翻译后修饰过程的多层次调节,其中转录调节因子,如HIF1α、STAT1/STAT3、NF-κB、IRF1/IRF3、c-Myc及BRD4等均可与PD-L1启动子结合并上调PD-L1的表达[56]。EBV编码44种成熟的miRNA,WANG等[57]发现EBV-miR-BART11和EBV-miR-BART17-3p可上调EBV相关NPC的PD-L1表达并分别抑制FOXP1和PBRM,从而增强PD-L1的转录,进而促进肿瘤免疫逃逸,这为EBV相关肿瘤的免疫治疗提供了潜在靶点。EBV还能编码多种circRNA。GE等[58]研究发现EBV编码的circBART2.2在NPC中高度表达且在体外和体内上调PD-L1表达并抑制T细胞功能,而circBART2.2可能通过结合RIG-I的解旋酶结构域并激活转录因子IRF3和NF-κB促进PD-L1的转录,从而导致肿瘤免疫逃逸。LI等[59]发现溴结构域和末端外抑制剂JQ1能优先抑制EBV阳性NPC细胞的生长,JQ1在NPC细胞,尤其是EBV阳性细胞中通过c-Myc依赖性地诱导细胞凋亡,减少细胞增殖并增强放射敏感性,此外JQ1还下调NPC中PD-L1的表达。
尽管目前的研究显示EBV基因可以调节PD-L1在肿瘤细胞上的表达,但血浆中EBV DNA的拷贝数或浓度与PD-L1表达的关系及其与预后的关系尚未明确。HU等[60]在198例患者中分析了外周血单核细胞中EBV DNA浓度和肿瘤组织浸润T淋巴细胞上的PD-L1表达与预后的关系,分别以外周血EBV DNA对数值1.98 log IU/mL以及15%肿瘤组织浸润T淋巴细胞PD-L1表达作为区分临界值,结果发现,高外周血EBV DNA浓度和低TIL上的PD-L1表达亚组患者是高危患者,低外周血EBV DNA浓度和高TIL上的PD-L1表达亚组患者是低危患者,且高危组和低危组5年无进展生存(progression-free survival,PFS)率差异显著(0%vs91.9%,P<0.001)。然而,也有研究得出不同的结果,如ZHOU等[61]分析了99例NPC患者中PD-L1的表达,尽管发现PD-L1可能是NPC患者的潜在预后生物标志物,但是未发现PD-1/PD-L1的表达水平与血浆EBV DNA拷贝数之间的相关性,因此未来仍需要进一步研究阐明PD-1/PD-L1轴诱导的免疫抑制过程中EBV状态的潜在机制。
2.2 EBV DNA及PD-L1与鼻咽癌治疗疗效的相关性
血浆EBV DNA拷贝数能反映肿瘤负荷,与NPC分期及治疗疗效密切相关。俞霞等[62]比较了152例初诊NPC和675例健康体检者血浆EBV DNA情况,结果显示血浆EBV DNA诊断晚期NPC的灵敏度达88.8%,且伴随分期的升高,EBV DNA阳性率呈上升趋势。在临床分期基础上,有研究显示EBV DNA拷贝数与治疗疗效密切相关,ZHANG等[63]发现治疗前EBV DNA>4 650 copies/mL时,诱导化疗在总生存期(overall survival,OS)、无病生存期(disease free survival,DFS)和无远处转移生存(distant metastasis-free survival,DMFS)率上均获益。LU 等[64]发现除了血浆EBV DNA水平,治疗前肿瘤体积也是NPC肿瘤控制和生存的独立预后因素,但血浆EBV DNA的预后意义优于肿瘤负荷,其中肿瘤负荷较大和EBV DNA拷贝数较低的患者预后较好。也有研究发现将治疗前的血浆EBV DNA合并到NPC的分期系统中,对生存具有更好的预测作用。LEUNG等[65]根据治疗前的血浆EBV DNA水平,将Ⅱ期NPC患者分为中低和高EBV DNA组,结果显示中低EBV DNA组患者的5年生存率显著高于高EBV DNA组(90%vs63%)。因此,血浆EBV DNA可用于预测NPC患者的治疗疗效,也可作为综合治疗方案制定和实时调整的可靠指标。
近年来,以PD-1/PD-L1免疫检查点抑制剂为主的免疫治疗给复发/转移性NPC的治疗带来了突破。免疫检查点单药作为复发/转移性NPC二线或二线以上的挽救治疗,有效性达到20%以上[3-5,7]。近年两项随机、双盲、安慰剂对照、国际多中心的Ⅲ期临床研究证实了免疫治疗联合化疗作为复发/转移性NPC一线治疗的疗效[5,9]。其中,WANG等[5]发起的POLARIS-02研究探索了特瑞普利单抗用于一线治疗失败后的复发/转移性NPC患者的疗效和安全性。该研究入组190例患者,结果ORR达20.5%,中位OS达17.4个月,且PD-L1阳性患者ORR更高(27.1%),PD-L1阴性患者也同样有近20.0%的ORR,表明PD-L1表达阴性人群同样获益。此外,基线EBV滴度<10 000 IU/mL、基线LDH水平≤2×ULN及PD-L1阳性患者更有可能从特瑞普利单抗治疗中获益。该项临床研究提示血浆EBV DNA水平和PD-L1的表达在一定程度上可预测NPC的免疫治疗疗效。MAI等[9]发起的另一项JUPITER-02研究是一项随机、双盲、安慰剂对照、国际多中心的Ⅲ期临床研究,旨在比较特瑞普利单抗联合吉西他滨/顺铂与安慰剂联合吉西他滨/顺铂作为组织学/细胞学证实的复发性或转移性NPC患者一线治疗的疗效和安全性。该研究共纳入289例患者,结果显示:特瑞普利单抗联合化疗组的中位PFS显著改善,中位PFS为11.7个月,高出安慰剂组3.7个月,患者的无进展生存时间明显延长;特瑞普利单抗联合化疗组1年PFS率为49.4%,近半数患者超1年未发生疾病进展,比安慰剂联合化疗组提高了21.5%;中位缓解持续时间为10.0个月,比安慰剂组的5.7个月延长近1倍,说明联合组具有更持久的缓解。亚组分析显示,不论患者年龄、性别、体力状况、复发或转移、EBV DNA定量情况以及PD-L1表达阴性或阳性,在特瑞普利单抗联合化疗组均能观察到PFS的改善。免疫检查点抑制剂单独或联合化疗在复发和转移性NPC治疗中的作用以及PD-L1表达与疗效的相关性在更多的临床研究中也显示了同样的结论(表1)。总之,以上临床研究结果提示血浆EBV DNA水平和PDL1的表达在一定程度上可帮助判断NPC免疫治疗疗效,但目前可用于证实EBV DNA水平及PD-L1表达与NPC治疗疗效相关性的临床证据仍有限,两者在NPC治疗中确切的作用尚无定论,需更多后续研究阐明。
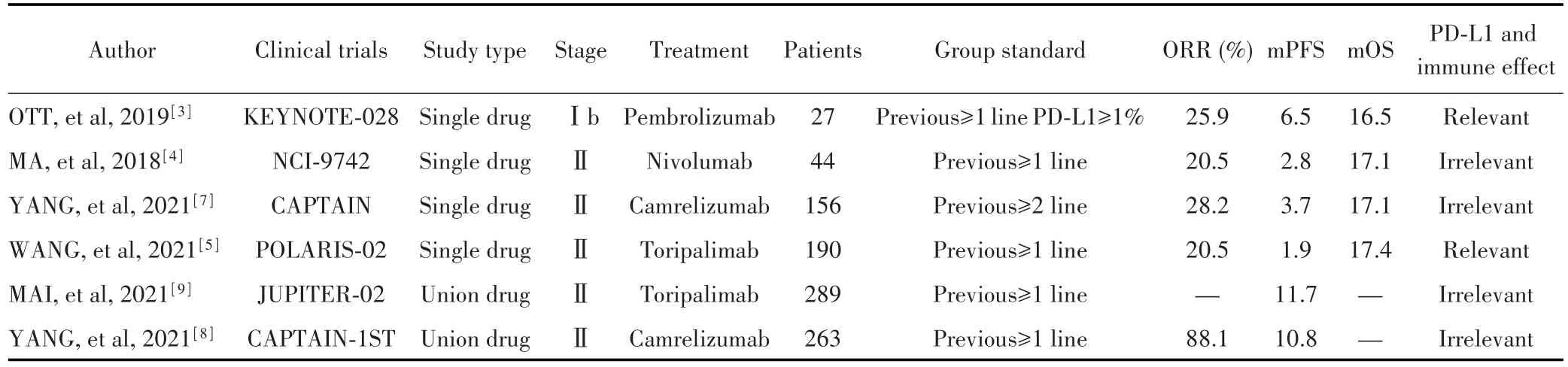
表1 复发/转移性鼻咽癌免疫治疗相关临床试验Tab.1 Clinical trials of immunotherapy for recurrent/metastatic nasopharyngeal carcinoma
3 小结
随着调强放疗技术的普及和综合治疗的应用,NPC患者的局部控制率达90%以上,5年生存率超过80%,与其他实体肿瘤相比,疗效甚是鼓舞。然而仍有10%~20%的患者在放疗后局部复发或远处转移,特别常见于局部晚期NPC患者。越来越多的研究显示免疫治疗在晚期NPC治疗中具有良好的前景,因此对患者进行个体化评估,深入了解不同免疫治疗方式及其联合治疗方式,给患者带来最大获益成为目前重要的研究方向。近年来,EBV DNA及PD-L1表达作为有效利器在NPC的诊断、治疗及预后中展现出潜在临床应用价值,两者与NPC的免疫微环境也显示了密切的关系,因此未来继续深入研究并明确两者在NPC发生发展中的作用,有望将其作为潜在生物标志物对NPC进行分子分型,从而为筛选免疫治疗优势人群以及指导晚期NPC患者的精准治疗提供新思路。
