Rho/ROCK信号通路在肿瘤中的研究进展
2022-09-07陈敬廉韦昕捷唐卫中
陈敬廉 韦昕捷 唐卫中
作者单位:530021 南宁 广西医科大学附属肿瘤医院胃肠外科;广西结直肠癌临床研究中心
Rho是Rho GTP酶主要的成员之一[1],在肌动蛋白细胞骨架组织调节、微管动力学调控、基因转录、肿瘤转化、细胞周期进展等生物学过程中发挥着关键作用[2]。Rho相关卷曲螺旋蛋白激酶(Rho-associated coiled-coil kinase,ROCK)属于丝氨酸/苏氨酸蛋白激酶AGC家族,是经典的Rho下游效应分子,主要参与肌动蛋白-肌球蛋白的收缩和肌动蛋白细胞骨架的动态调节[3]。活化的Rho通过结合并激活ROCK参与细胞形态发生、运动、分裂、极性、增殖、迁移和黏附等生命活动,同时在多种疾病发生发展中具有重要影响,包括心血管疾病[4]、呼吸系统疾病[5]、肾脏疾病[6]、血液系统疾病[7]、神经系统疾病[8]及自身免疫性疾病[9]等。目前越来越多的研究指出,Rho/ROCK信号通路也积极参与肿瘤恶性生物学行为的调节和肿瘤微环境(tumor microenvironment,TME)的塑造[10-11]。本文就Rho/ROCK信号通路在肿瘤及肿瘤微环境中的相关研究进展作一综述,为后续作用机制的挖掘及肿瘤治疗新靶点的开发提供思路。
1 Rho/ROCK信号通路概述
Rho GTP酶是Ras超家族中的重要组成部分,目前主要包括3个亚家族,即Rho(RhoA、RhoB和RhoC)、Rac(Rac1、Rac2和Rac3)和Cdc42(Cdc42Hs和G25K)[12]。Rho可与GTP结合后活化,继而活化下游分子,当结合的GTP水解成为GDP时,则重新成为非活化状态,这种动态平衡受鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)、GTP酶活化蛋白(GTPase activating protein,GAP)和鸟嘌呤核苷酸解离抑制剂(guanine nucleotide dissociation inhibitor,GDI)调节[13]。此外,Rho也受翻译后修饰的调控,如磷酸化、泛素化和SUMO化[14]。ROCK包含ROCK1(又称为ROCKβ或p160-ROCK)和ROCK2(又称为ROCKα或p164-ROCK)两种亚型,分别位于18号染色体(18q11.1)和2号染色体(2p24)。ROCK蛋白结构包括5个结构域,其中1个含有激酶结构域、1个含有Rho结合结构域(RBD)的卷曲螺旋结构域、1个含有富含半胱氨酸结构域(CBD)的PH(pleckstrin-homology)结构域[15]。Rho GTP与RBD的结合改变了抑制性折叠结构,有助于释放激酶结构域,导致ROCK的激活[16]。ROCK在多种组织中表达,包括肺、肝、脾、肾、脑、心脏和睾丸等[17],并在不同的亚细胞结构发挥作用[18-19]。除了作用于细胞骨架和细胞调亡、生长、迁移、代谢等细胞生物学行为,ROCK本身作为激酶还可以通过磷酸化下游分子来调节细胞功能[20-21]。Rho/ROCK信号通路积极参与生理和病理过程,在肿瘤中的作用主要体现在对肿瘤发生发展、侵袭、迁移及TME的塑造方面,其在肿瘤中的调控作用及相关机制见图1。
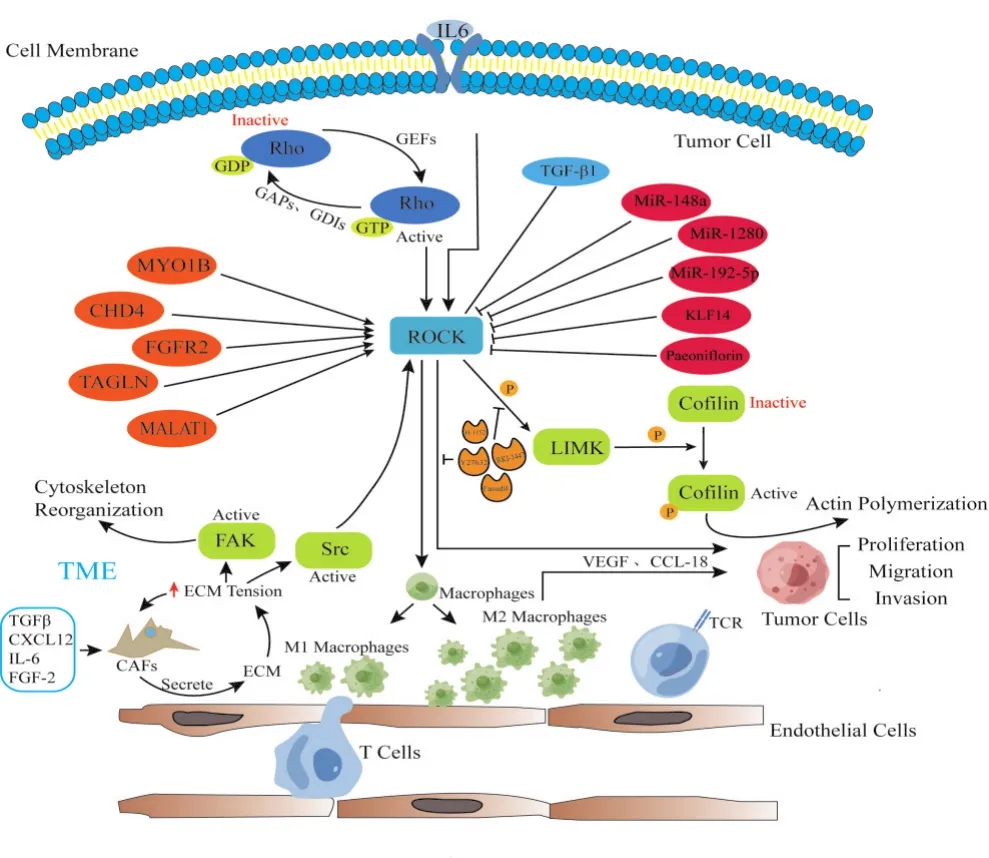
图1 Rho/ROCK信号通路在肿瘤中的调控作用及机制示意图Fig.1 Schematic diagram of the regulatory role and mechanism of Rho/ROCK signaling pathway in tumors
2 Rho/ROCK信号通路调控肿瘤
2.1 Rho/ROCK信号通路在肿瘤发生发展中的调控
Rho/ROCK信号通路在肿瘤发生发展中的作用是学界关注的焦点之一。有充分证据表明,正常细胞转化为肿瘤细胞归根结底是细胞信号调控机制发生紊乱造成。肿瘤在形成的过程中存在异常的信号转导,且信号转导异常对肿瘤的发生是必要的。目前研究显示肿瘤中存在Rho/ROCK的过度表达和过度激活,而近年来不少研究聚焦Rho/ROCK信号转导异常如何调控肿瘤进展。例如,ROCK1蛋白在乳腺癌[22]、小细胞肺癌[23]、骨肉瘤[24]等肿瘤中的表达水平较癌旁组织异常增高,在肝细胞癌[25]、结肠癌[26]、膀胱癌[11]等肿瘤中ROCK2表达水平较正常组织增高,其功能是产生及维持肿瘤的恶性表型。ROCK蛋白在肿瘤组织中高表达可导致ROCK信号在肿瘤中过度激活,进而活化下游的信号级联通路,从而作用于靶细胞,促进肿瘤的发生与发展。肿瘤组织中ROCK异常表达也与肿瘤的不良预后密切相关,如乳腺癌中ROCK1过度表达与肿瘤分级的提高和总生存率的降低有关[22];骨肉瘤中ROCK1过表达与总生存率降低有关[24];膀胱癌中ROCK1过表达与患者不良预后相关[27]。由此可见,干预肿瘤组织中ROCK蛋白的表达或可在改善不良预后方面提供新思路。
激活Rho/ROCK往往是上游信号级联的一部分,上游信号分子又可以导致Rho/ROCK信号异常激活,进而介导肿瘤的发生和发展,如染色质解旋酶DNA结合蛋白 4(chromodomain helicase DNA binding protein 4,CHD4)通过激活RhoA/ROCK信号通路调控非小细胞肺癌细胞增殖[28];转胶蛋白(transgelin,TAGLN)通过RhoA/ROCK信号通路介导了卵巢癌的进展[29];成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)融合和突变通过激活Rho/ROCK途径而不是传统的丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)途径促进肝内胆管细胞癌的发生[30];在弥漫性胃癌(diffuse gastric cancer,DGC)中15%~25%发现了RhoA突变,但这种突变对酶活性以及信号传导的影响,在后续的机制及信号传导研究中未得出一致看法[31],因此该突变体参与肿瘤的具体机制仍需进一步研究。
2.2 Rho/ROCK信号通路在肿瘤侵袭和迁移中的调控
转移是肿瘤患者死亡的主要原因之一,肿瘤转移是一个复杂的过程,需要细胞骨架重建的参与。研究表明,Rho/ROCK信号通路的激活在肿瘤细胞侵袭和迁移中有重要作用[17]。在多种肿瘤如乳腺癌、结肠癌、胰腺癌、前列腺癌、骨肉瘤等[32-38]均发现ROCK1高表达与其侵袭和迁移的生物学特性密切相关。CAMPBELL等[32]研究发现,RhoA/ROCK可驱动白细胞介素6(interleukin-6,IL-6)介导的肌动蛋白极化过程,并导致肿瘤转移。TGF-β1可促进肿瘤迁移、侵袭和增殖等恶性生物学行为,而TGF-β1和ROCK1的结合可激活TGF-β1诱导的LIMK2/Cofilin磷酸化和下游应力纤维的形成[39]。在前列腺癌中,LIMK活性下调会减弱肿瘤侵袭能力,而LIMK活性增强则会导致更强的侵袭能力,从而促进细胞增殖和迁移[37]。在此基础上,ZHANG等[40]研究发现ROCK1抑制剂Y-27632能通过影响上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)过程,减少血管生成拟态(vasculogenic mimicry,VM),进而抑制TGF-β1诱导的肿瘤细胞迁移、侵袭和增殖能力,表明ROCK1在肿瘤侵袭和迁移中具有重要作用。除了诱导LIMK/Cofilin磷酸化外,活化的ROCK也可通过肌动蛋白细胞骨架重组发挥其在细胞迁移中的作用。在结肠癌中,肌球蛋白IB(myosin IB,MYO1B)通过激活RhoA/ROCK/FAK信号通路促进纤维肌动蛋白重排和焦点黏附增强细胞转移能力[41]。在胶质母细胞瘤中,芍药苷通过降低RhoA的活性,减少ROCK1的激活,进而调节肌动蛋白细胞骨架重组,从而抑制细胞迁移和侵袭[42]。
此外,非编码RNA虽然不编码蛋白质,但可作为信号分子在Rho/ROCK调控肿瘤侵袭、迁移过程中发挥重要作用。如CAI等[43]研究发现,敲除长链非编码RNA(lncRNA)MALAT1显著降低了RhoA、ROCK1和ROCK2的蛋白表达水平,抑制了骨肉瘤中肌动蛋白重排与细胞骨架的重塑,从而抑制了骨肉瘤细胞的迁移能力,表明MALAT1主要通过RhoA/ROCK途径促进骨肉瘤转移。在胃癌与膀胱癌研究中,miR-148a、miR-1280可直接靶向ROCK1的3′UTR,进而显著抑制肿瘤细胞的转移能力[44-45]。在结肠癌中,肠道微生物群代谢产物通过RhoA-ROCK-LIMK2途径上调miR-192-5p从而抑制结肠癌细胞的增殖、迁移和侵袭[46]。综上所述,Rho/ROCK信号通路的激活在肿瘤侵袭和迁移中的作用机制因细胞类型而不同,但其激活与肿瘤的恶性生物学行为密切相关,其作为肿瘤转移的治疗靶点具有很好的前景。
2.3 Rho/ROCK信号通路调控TME
TME主要包括肿瘤细胞、肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)、免疫细胞、周细胞、脂肪细胞、间充质干细胞、内皮细胞和脂肪细胞等细胞成分,以及由细胞外基质(extracellular matrixc,ECM)、细胞因子、趋化因子等组成的非细胞成分。在健康状态下,机体微环境维持正常组织的稳态,可以抑制肿瘤的发生及发展[47-48]。在肿瘤中,微环境平衡被打破,形成的TME与癌细胞相互作用并影响疾病的进展和转归[49]。Rho/ROCK信号通路除了可影响肿瘤细胞的恶性生物学行为,对TME中其他细胞也有一定的调控作用。
2.3.1 Rho/ROCK信号在CAFs调节细胞外基质中的作用 CAFs是一类高度异质性的基质细胞群,同时也是TME最重要的组成部分之一。CAFs能被肿瘤细胞分泌的因子如 TGFβ、CXCL12、IL-6、FGF-2等激活[50-53]。而活化的CAFs较正常组织成纤维细胞收缩性高,并能分泌出大量的生长因子和ECM成分,包括纤连蛋白、层黏连蛋白、骨膜蛋白、胶原蛋白、Tenascin C、Osteopontin、基质金属蛋白酶等[54],从而促进肿瘤的恶性生物学行为和ECM重塑[55]。ECM的变化进一步激活CAFs,进而导致更多的ECM分泌,然后使ECM的机械刚度增强,从而形成一个正向反馈循环,最终促进肿瘤进展及致使基质变硬。而基质变硬可使整合素聚集,导致焦点黏附激酶(focal adhesion kinase,FAK)和 Src激活[56]。活化的 Src又可激活ROCK1[57],然后使肌动蛋白聚集和肌动蛋白收缩力增加,进而重塑细胞骨架,影响细胞周期、细胞极性,并进一步促进肿瘤的侵袭表型。在乳腺癌上皮细胞中,ROCK1选择性激活蛋白激酶-R样内质网激酶,进而使CAFs聚集并持续活化[58]。
2.3.2 Rho/ROCK信号通路调控TME中的免疫细胞Rho/ROCK信号通路对TME中的免疫细胞的调控主要是针对T细胞和巨噬细胞。在获得性免疫中,T细胞是杀伤肿瘤的主要细胞。Rho/ROCK信号是T细胞通过LFA-1附着到细胞间黏附所必需的,而这是由ROCK1底物肌球蛋白轻链(myosin light chain,MLC)的磷酸化和激活所介导的[59]。此外,RhoA在跨内皮迁移中的重要作用也已被学者证实[60]。T细胞的功能受T细胞受体(T cell receptor,TCR)调节,而RhoA/ROCK信号可以影响TCR的功能。Rho功能对胸腺细胞的发育至关重要,可调节胸腺细胞的分化,进而影响T细胞的发育成熟[61]。RhoA位于前TCR复合体的下游,前TCR控制T细胞增殖和分化的信号转导途径涉及蛋白酪氨酸激酶,Rho被证实在Src激酶p56lck下游起作用,而且是激活的p56lck驱动前T细胞分化所必需的[62]。然而,对于RhoA/ROCK信号在将T细胞群极化为1型辅助性T细胞(Th1)或2型辅助性T细胞(Th2)中的作用,目前存在相互矛盾的报道。如有研究报道T细胞中RhoA的耗竭会抑制Th2分化,但不会影响Th1分化[62]。也有研究表明,RhoA可通过效应器ROCK激活TCR介导的Th1(IL-2和IFN-γ)和Th2(IL-33)细胞因子的产生[63]。总之,目前 RhoA/ROCK信号通路对TME中的Th1分化的影响尚未明确,因此仍需更多的研究进一步确认,这有助于阐明其是否诱导Th1分化后发挥抗肿瘤作用,并促使机体处于Th1细胞占优势的良好抗肿瘤状态。
巨噬细胞是一种具有高度可塑性和多能性的免疫细胞,其根据微环境在促炎症(M1)和抗炎症(M2)表型之间转化,其中在癌症中慢性炎症环境会引导巨噬细胞向抗炎的M2样表型分化[64]。不同类型的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)既能为机体提供保护,又能帮助肿瘤细胞免疫逃逸,抵抗T细胞的攻击。如部分TAM亚群可以清除肿瘤细胞,而部分TAM则会释放出支持肿瘤生长和诱导免疫抑制环境的介质[65]。LITTLE 等[66]研究发现,M2a TAMs可协同利用VEGF和CCL-18促进乳腺癌细胞迁移和侵袭,而通过使用ROCK1抑制剂Y-27632或GSK42986A预处理可减弱VEGF/CCL-18和M2a诱导的迁移和侵袭能力。CHU等[67]研究发现,过表达KLF14的乳腺癌细胞中M2巨噬细胞的极化明显减少,且KLF14可通过调节SOCS3/Rho/ROCK/STAT3信号通路抑制乳腺癌细胞的侵袭和M2巨噬细胞的极化,并减少IL-10和TGF-β等炎症抑制因子分泌,从而减弱抗肿瘤免疫作用的抑制,进而抑制肿瘤进展。
3 Rho/ROCK信号通路在肿瘤治疗中的应用
Rho/ROCK信号通路失调参与了肿瘤的发生发展及侵袭、迁移过程,在TME中也扮演着重要的角色,因此以Rho/ROCK为靶点或可为肿瘤预防、控制肿瘤进展及肿瘤治疗药物开发提供新的策略。既往研究已经证实了Rho/ROCK抑制剂在体外和体内癌症模型中的治疗效果,目前较为典型的ROCK抑制剂是Y-27632[68]。在体外模型中,Y-27632可抑制乳腺癌[69]、结直肠癌[70]、肝细胞癌[71]及非小细胞肺癌[72]细胞增殖,并降低乳腺癌和结直肠癌细胞的迁移能力[70,73]。在小鼠体内模型中,Y-27632可抑制肝癌和乳腺肿瘤的生长和转移,在小鼠肝癌模型中还可促进肿瘤细胞凋亡以及抑制MMP9的表达[71];在乳腺肿瘤模型中也可抑制肿瘤进展,并增强CD4+和CD8+T细胞浸润[73]。除了Y-27632,目前多种新型的高特异性小分子ROCK抑制剂也正在研发及验证中。如体外实验已证实法舒地尔可以有效地抑制胶质瘤细胞的增殖[74]。RKI-1447可显著抑制结直肠癌细胞生长并促进细胞凋亡,并通过细胞骨架相关的线粒体功能障碍及细胞生物能量破坏抑制结直肠癌进展;RKI-1447还可通过抑制ROCK并选择性阻断ROCK依赖信号传导,抑制乳腺癌的生长、迁移和侵袭[75]。H-1152可以降低结直肠癌细胞中P38的磷酸化进而抑制肿瘤细胞的迁移和侵袭[76]。然而,ROCK抑制剂靶向治疗尚未被批准用于癌症患者的治疗,但相信在进行充分的临床前试验后,有望成为下一代靶向治疗肿瘤转移的药物。
4 小结与展望
Rho/ROCK信号通路与肿瘤发生发展、肿瘤细胞的侵袭和迁移及TME的调控密切相关。目前研究显示,肿瘤中存在Rho/ROCK过度表达和过度激活,且其异常高表达不仅可以促进肿瘤的发生,也可以调节细胞肌动蛋白,重塑细胞骨架,从而促进肿瘤转移。除了影响肿瘤细胞的恶性生物学行为,Rho/ROCK信号通路在TME调控中也发挥着不可替代的作用,如通过在CAFs中调节细胞外基质以及调控免疫细胞等促进肿瘤进展。此外,基于Rho/ROCK信号通路的作用,目前众多学者研发了相应的靶向药物,现有的ROCK抑制剂也对肿瘤进展表现出良好的改善作用,但这些药物主要处于肿瘤的实验研究阶段,并未真正应用于临床治疗。因此,研发新型化合物阻断Rho/ROCK通路中关键蛋白与蛋白之间的结合,或通过结构生物学解析出ROCK蛋白关键结构域并予以针对性阻断,可能为肿瘤治疗中靶向Rho/ROCK信号通路的新型抑制剂研发提供新的方案。
