Wnt/β-catenin信号通路在博来霉素诱导的系统性硬化症小鼠模型血管重塑中的作用
2022-09-07彭一琳
彭一琳, 夏 强, 刘 韧, 王 燕, 吴 锐
(南昌大学第一附属医院风湿免疫科, 南昌 330006)
系统性硬化症(systemic sclerosis,SSc)是一种以免疫系统的异常激活、血管受损以及新生血管生成和重塑异常,最终导致皮肤和多脏器广泛纤维化为特征的自身免疫性疾病[1]。该病的全球患病率在21/100万~600/100万范围内,发病率为8/100万~56/100万[2]。广泛的血管病变及全身多脏器的进行性纤维化逐渐导致器官正常结构和功能的丧失,这是系统性硬化症高致死率的重要原因[3]。虽然关于系统性硬化症的研究日益增多,但其发病机制仍尚不清楚。目前,临床上仍然缺乏有效药物控制SSc的疾病进展。因此,深入研究系统性硬化症的发病机制,找到有效治疗靶点,具有重要临床意义。
Wnt/β-catenin信号通路作为一种高度保守的经典信号通路,分为经典Wnt途径(canonical pathway)、非典型平面细胞极性途径(planarcell polarity pathway)和非经典Wnt信号/钙通路(Wnt/Ca2+pathway)。其在发育过程参与调节多种细胞功能,控制着发育的各个方面,包括细胞增殖、纤维化、凋亡、细胞迁移和发育过程中的细胞极性以及调节干细胞的多功能性[4]。近年来证实,Wnt通路在疾病纤维化及血管增殖中发挥着重要的作用。研究显示,Wnt通路可以和TGF-β通路相互作用,共同促进SSc纤维化的发生发展[3,5-7],但Wnt通路在SSc的血管病变中的作用尚无报道。因此,本文从SSc皮肤微血管Wnt通路入手,探讨Wnt通路在SSc血管病变中的作用,以期为系统性硬化症血管病变提供新的治疗靶点。
1 材料与方法
1.1 仪器与试剂
主要仪器:赛默飞高速冷冻离心机-Legend Micro21R;赛默飞智能凝胶电泳系统-iBrightTMCL1000;尼康倒置显微镜-Eclipse CI-L;美国伯乐Q-PCR仪-CFX96;Servicebio组织碾磨机-KGA317。主要试剂:Solarbio品牌的博来霉素(125 mg/1.25 mL);Proteintech品牌的β-联蛋白(β-catenin)、平滑肌(smooth muscle)、Wnt5A、col1A1一抗抗体;Proteintech品牌的山羊抗兔IgG HRP、山羊抗小鼠IgG HRP二抗;Invitrogen的ECL发光显影液;Proteintech品牌的DAB显色液和柠檬酸钠缓冲液;中杉金桥的免疫组化试剂盒;凯基生物的全蛋白质提取试剂盒和BCA蛋白定量试剂盒等。
1.2 博来霉素配制与实验动物分组方案
博来霉素工作液配制:用移液枪吸取博来霉素 100 μL(125 mg/1.25 mL)原液于10 mL PBS中混匀,配制成浓度为1 mg/mL的博来霉素工作液,放置于4 ℃保存。原液置于冰箱-20 ℃保存。
18只Balb/C小鼠:6~8周龄,雌性,SPF级,购自湖南斯莱克实验动物有限责任公司,体重约20±2 g,在南昌大学动物科部饲养,环境适应本实验要求,通风性好,光照交替,温度22±2 ℃,相对湿度40%~70%,进食水与食物每日更换,每日清洗笼具。将小鼠按数字标记随机分为3组,每组6只,分别为对照组、模型组、治疗组。
对照组:用1 mL注射器在小鼠背部皮下注射无菌PBS 100 μL,前4次依次注射于方框的四角,第5次注射于方框中心,以此循环28 d,每周观察小鼠皮下注射部位皮肤变化。
模型组:连续用1 mL注射器在小鼠背部皮下注射浓度为1 mg/mL的博来霉素溶液100 μL 28 d,注射方式同上,每周观察小鼠皮下注射部位皮肤变化。
治疗组:连续用1 mL注射器在小鼠背部皮下注射浓度为1 mg/mL的博来霉素溶液100 μL 28 d,同时腹膜内注射iCRT3(5 mg/kg·d),皮下注射方式同上,每周观察小鼠皮下注射部位皮肤变化。
1.3 小鼠眼球采血及血清分离
抓取小鼠双耳及颈后皮肤,固定小鼠尾部。将小鼠左侧前肢固定于心脏部位并轻柔按压小鼠腹部及取血侧眼部皮肤,使眼球充血突出,用弯头镊夹取眼球,迅速摘取眼球侧置于50 mL离心管上。轻柔按压小鼠心血管部位,以加快心泵血速度。将所取血液标本置于37 ℃水浴锅中1 h,再置于4 ℃冰箱内过夜。观察到血液凝固后,于4 000 r/min 离心10 min,取上清于干净的EP管中,分装后保存于-20 ℃,以备后续实验(避免反复冻融)。
1.4 小鼠处死及标本采集
最后1次给药后第2 d,剔除目标区域皮肤组织毛发并进行眼球取血,采用颈椎脱臼法处死小鼠,75%酒精消毒3次,移入超净台中并固定于动物手术台上,剪取适量皮肤组织,取部分皮肤组织置于4%多聚甲醛中固定进行组织学鉴定,剩余皮肤组织进行微血管提取,分装于5 mL EP管中于-80 ℃保存,以备后续进行动物组织蛋白质及RNA提取。
1.5 小鼠皮肤微血管提取方法
将所得新鲜皮肤组织置于含预冷PBS的培养皿中,用预冷PBS清洗3次,用无菌眼科剪将所取标本铺平,小心剔除皮下脂肪层,将皮肤组织剪成1 mm×1 mm大小,并移至15 mL离心管中。加入5 mL 0.1% I型胶原酶,37 ℃震摇消化1 h后,于4 ℃,3 000 r/min 离心10 min。弃上清,加入5 mL含10%胎牛血清的高糖DMEM培养基重悬,3 000 r/min 离心5 min,弃上清,加入5 mL PBS重悬,经100 μm尼龙膜滤网过滤组织上清液,用5 mL PBS加压冲洗3次,将尼龙膜上的微血管片段冲洗收集;4 ℃,3 000 r/min 离心5 min后弃上清,加入15%葡聚糖T500溶解混匀,再经25 000 r/min 离心5 min后弃上清,加入20%葡聚糖T500溶解混匀,25 000 r/min 离心5 min,收集沉淀物分装置于-80 ℃保存,以备后续实验。
1.6 HE染色
将固定的组织通过包埋、切片、干燥等步骤制得组织切片,将玻片置于70 ℃烤箱中烘烤60 min(融蜡),再将玻片置于二甲苯Ⅰ、Ⅱ各放置10 min(脱蜡);玻片置于100%酒精、95%酒精、85%酒精各5 min,再用自来水缓慢冲洗3次,1 min/次(水化);再将玻片放置于苏木素染色约40 s,用自来水缓慢冲洗3次,2 min/次;将玻片放入1%盐酸酒精分化3 s(反复提浸3次,1 s/次),自来水缓慢冲洗3次,将玻片置于碳酸锂中返蓝2 s,再将玻片置于流水中漂洗15 min,用伊红溶液染色约5 min,玻片置于85%酒精、95%酒精、100%酒精、100%酒精各5 min(脱水),将玻片置于二甲苯Ⅰ、二甲苯Ⅱ各10 min(透明)。通风处自然晾干后中性树胶封片,显微镜观察。
1.7 Masson染色
将组织切片置于烤箱中融蜡,再进行脱蜡,用配制的 Weigert 铁苏木素染色液染色 5~10 min,再用酸性乙醇分化液分化 5~15 s,水洗;Masson蓝化液返蓝3~5 min,水洗;蒸馏水洗 1 min。丽春红品红染色液染色 5~10 min,用弱酸工作液洗1 min,再用磷钼酸溶液洗 1~2 min,用配置好的弱酸工作液洗1 min。滴加适量苯胺蓝染色液 1~2 min,用配置好的弱酸工作液洗1 min。使用95%乙醇快速脱水,无水乙醇脱水3次,每次5~10 s。二甲苯透明3次,每次1~2 min。最后用中性树胶封固。
1.8 免疫组化染色
将组织切片玻片置于80 ℃烤箱中烘烤30 min(融蜡);将烤好的玻片置于二甲苯Ⅰ、Ⅱ各放置10 min(脱蜡),置于100%酒精、95%酒精、85%酒精各5 min,自来水缓慢冲洗数遍(水化);将玻片置于蒸馏水中漂洗1 min,置于PBS缓冲液中;在迷你不锈钢锅中加入500~1 000 mL柠檬酸钠缓冲溶液(pH 6.0)中加热至沸腾,迅速将装好玻片的金属架置于锅中,使玻片位于液面以下,盖上高压锅盖并加上气阀,待高压锅喷气时开始计时2~3 min。结束后关闭电磁炉,室温静置15 min,去掉锅盖静置2 min后取出玻片,用PBS漂洗2 min×3次;每张玻片加入50 μL左右的酶标山羊抗小鼠/兔IgG聚合物,37 ℃孵育20 min;PBS缓冲液漂洗3次;将漂洗好的玻片用油笔画圈,加入稀释好的一抗,置于4 ℃冰箱过夜。次日取出,复温20 min,PBS洗3遍,加二抗(PV-6000),室温孵育30 min;PBS洗3 min×3次,DAB显色(5~8 min),根据镜下染色情况终止反应,流水缓慢漂洗玻片5~10 min;苏木素染液复染20~40 s,自来水漂洗3次,显微镜下观察染色深浅。1%盐酸酒精分化1 s,自来水漂洗3次,2 min/次,再将玻片置于返蓝液中2 s,流水慢速漂洗5 min;置于85%酒精、95%酒精、100%酒精、100%酒精各1 min(脱水);置于二甲苯Ⅰ、二甲苯Ⅱ各2 min(透明);最后将玻片置于通风出自然风干,中性树胶封片后镜下观察。
1.9 ELISA检测
根据试剂盒说明书,从复温好的试剂盒中取出适量板条。空白孔加标准品和标本通用稀释液,其余相应孔中加标本或不同浓度标准品(100 μL/孔),用封板胶纸封住反应孔,37 ℃孵箱孵育90 min。提前20 min准备生物素化抗体工作液。洗板5次,在空白孔中加入生物素化抗体稀释液,其余孔中加入生物素化抗体工作液(100 μL/孔)。用新封板胶纸封住反应孔,置于37 ℃温箱中1 h,洗板5次。在空白孔中加入酶结合物稀释液,其余孔中加入酶结合物工作液(100 μL/孔)。用新封板胶纸封住反应孔,置于37 ℃温箱中避光孵育30 min。提前打开酶标仪预热,设置好检测程序。洗板5次。每个孔中加入显色底物100 μL,37 ℃温箱中避光孵育15 min。每孔中加入反应终止液100 μL后,用酶标仪测量每孔在450 nm处读数。根据标准品孔的酶标仪读数及其浓度,做出标准曲线及公式。将标本孔的酶标仪读数带入公式中,算出对应的细胞因子浓度。
1.10 Western印迹分析
采用Western印迹检测皮肤微血管Wnt5A、β-联蛋白、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Ⅰ型胶原蛋白α1(recombinant collagen type Iα 1,col1A1)的蛋白质表达水平。所得微血管沉淀从-80 ℃取出,根据组织量加入适量裂解液(1 mL 裂解缓冲液+ 蛋白酶抑制剂1 μL+磷酸酶抑制剂10 μL+PMSF 10 μL),静置30 min,于4 ℃ 12 000 g离心30 min。取上清液并采用BCA法测定总蛋白质含量。上清液与蛋白质上样缓冲液混匀煮沸冷却,取总量为30 μg的蛋白质点样至浓缩胶中,经电泳、转膜等步骤,获得含有蛋白质条带的PVDF膜,经过5%脱脂奶粉封闭2 h、一抗孵育过夜、TBST洗3×10 min、二抗摇床孵育1 h、再次TBST洗3×10 min,采用ECL发光液显影并使用Image J软件进行灰度值分析。
1.11 q-PCR检测
将所得微血管组织放入1.5 mL无核酶EP管中,匀浆器充分匀浆后加入1 mL Trizol,用Trizol法进行总RNA提取。根据逆转录和扩增试剂盒进行引物逆转录和扩增。目的基因β-联蛋白(β-catenin)及内参基因GAPDH的引物设计见Table 1。
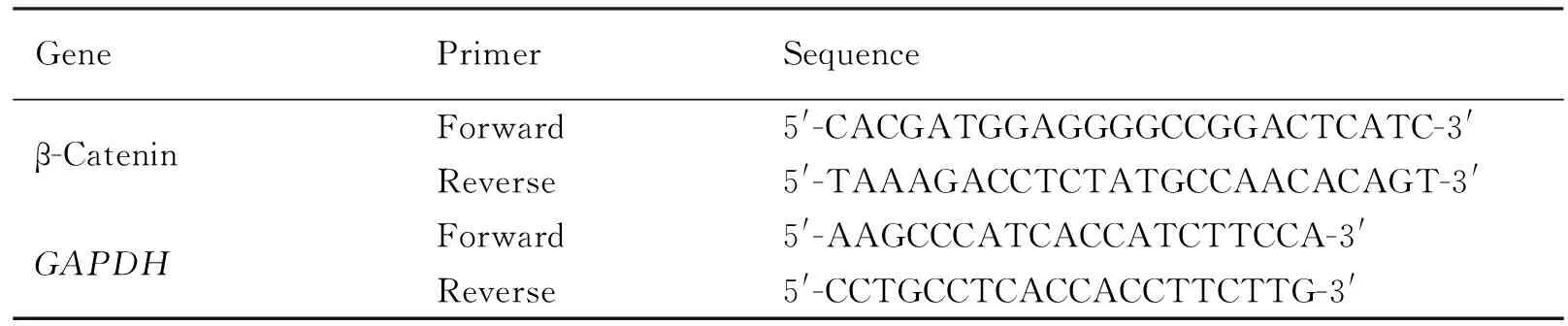
Table 1 q-PCR Primer sequence
1.12 统计学分析
本实验中均以均数±标准差表示各数据,使用统计软件GraphPad 5.01进行统计分析,经检验后如数据符合正态分布同时又符合方差齐性时,采用单因素方差分析(ANOVA)比较组间的差异,当数据不满足方差齐性,组间多重比较采用Dunnett-t检验,设定P<0.05时有统计学意义。
2 结果
2.1 博来霉素可成功诱导系统性硬化症小鼠模型
通过每日皮下注射博来霉素诱导Balb/c小鼠系统性硬化症模型,连续28 d。随着BLM注射天数的增加,小鼠皮下注射点周围皮肤逐渐变紧变硬,进针阻力感较正常组稍有增加,皮下注射区域毛发生长速度较对照组明显减慢;对照组小鼠皮下注射区域的皮肤色泽正常,弹性未见明显异常,同时皮肤也未出现变紧变硬;治疗组的情况则处于模型组和对照组之间。
造模完成后,通过对3组小鼠皮肤组织进行HE染色。结果显示,模型组小鼠皮肤真皮层明显增厚,皮下脂肪及附属器减少和消失,对照组皮肤无明显增厚,皮下脂肪饱满,附属器未见明显减少,治疗组小鼠皮肤状态改变介于两者之间。通过Masson染色发现,模型组小鼠皮肤真皮层明显增厚,胶原纤维增生明显,治疗组小鼠皮肤真皮层也有增生的胶原纤维,但较模型组少,对照组小鼠皮肤胶原纤维增生不明显。对3组小鼠皮肤进行α-SMA免疫组化染色发现,模型组小鼠皮肤中微血管明显增厚,呈肌化性改变,微血管α-SMA染色阳性面积、深度都较对照组明显加重,治疗组小鼠经iCRT3抑制Wnt通路后,皮肤中α-SMA表达量较模型组明显减少,与对照组相比无明显变化。HE染色、Masson染色和IHC染色结果均说明,BLM诱导Balb/c小鼠系统性硬化症模型建模成功,且经iCRT3抑制Wnt通路后,能够减少皮肤胶原纤维的增生,减缓皮肤病变程度(见Fig.1)。
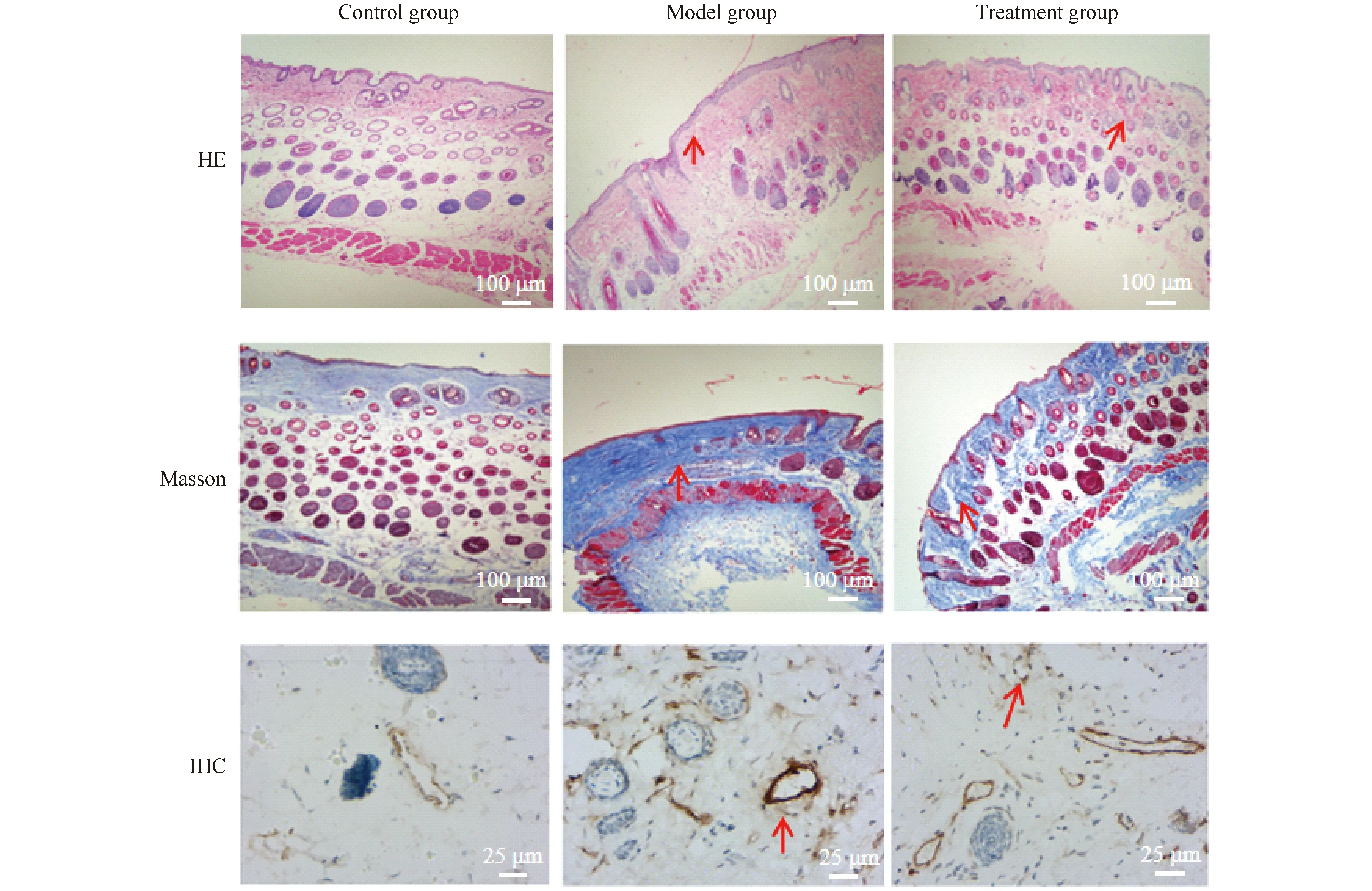
Fig.1 Bleomycin can successfully induce the mouse model of systemic sclerosis through the identification of mouse skin histopathology Totally 18 BALB/c mice were randomly divided into three groups. The control group was subcutaneously injected with sterile PBS 100 μL. The model group was injected subcutaneously with bleomycin (BLM) 100 μL at a concentration of 1 mg/mL on the back. In the treatment group, BLM of 100 μL (1 mg/mL) was injected subcutaneously combined with iCRT3 (5 mg/kg·d) intraperitoneal injection. The skin changes at the subcutaneous injection site of mice were observed every week. After 28 days, the skin tissues of mice were collected and subjected to staining of HE (scale bar=100 μm), Masson (scale bar=100 μm) and IHC (scale bar=25 μm)
2.2 三组小鼠血清中IL-17、IL-6的含量
通过ELISA方法对取得的各组小鼠血清进行IL-17和IL-6含量测定。结果显示(Fig.2),经BLM诱导的皮肤纤维化模型(模型组)血清中IL-17及IL-6的含量较对照组明显升高(P<0.05);在经iCRT3处理后的小鼠血清中IL-17及IL-6含量较模型组明显降低,差异有统计学意义。
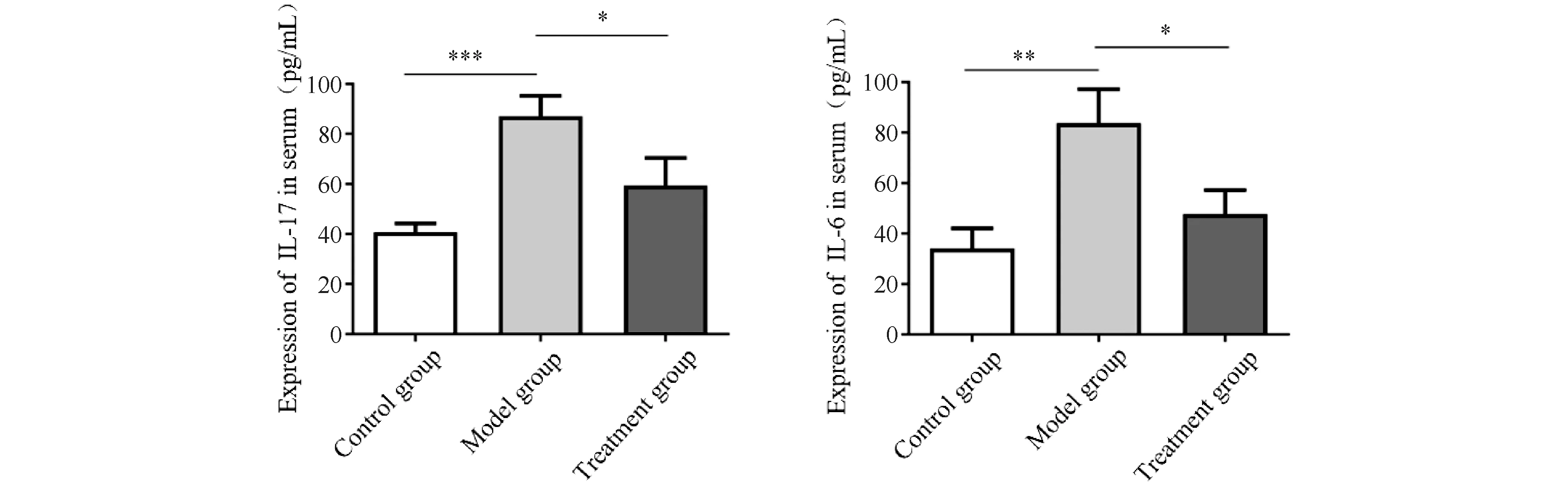
Fig.2 Changes of IL-17 and IL-6 levels in the serum of mice in each group After modeling, the serum of mice in each group was obtained and the contents of IL-17 and IL-6 in the serum of mice in each group were measured by ELISA. n=6; *P<0.05, **P<0.01, ***P<0.001
2.3 Wnt/β-catenin信号在系统性硬化症小鼠模型皮肤微血管中存在异常激活现象
为了进一步探讨Balb/c小鼠模型皮肤微血管是否存在Wnt通路的异常激活,本文分别从转录水平和蛋白质水平对皮肤微血管Wnt/β-catenin信号通路相关分子进行研究。采用实时PCR来检测β-联蛋白的表达(见Fig.3)。结果显示,BLM模型组小鼠皮肤微血管的β-联蛋白的mRNA表达水平较对照组小鼠皮肤明显增高(P<0.05);而经iCRT3处理后的小鼠(治疗组)皮肤微血管中β-联蛋白 mRNA相较模型组的表达量明显降低,差异有统计学意义(P<0.05)。
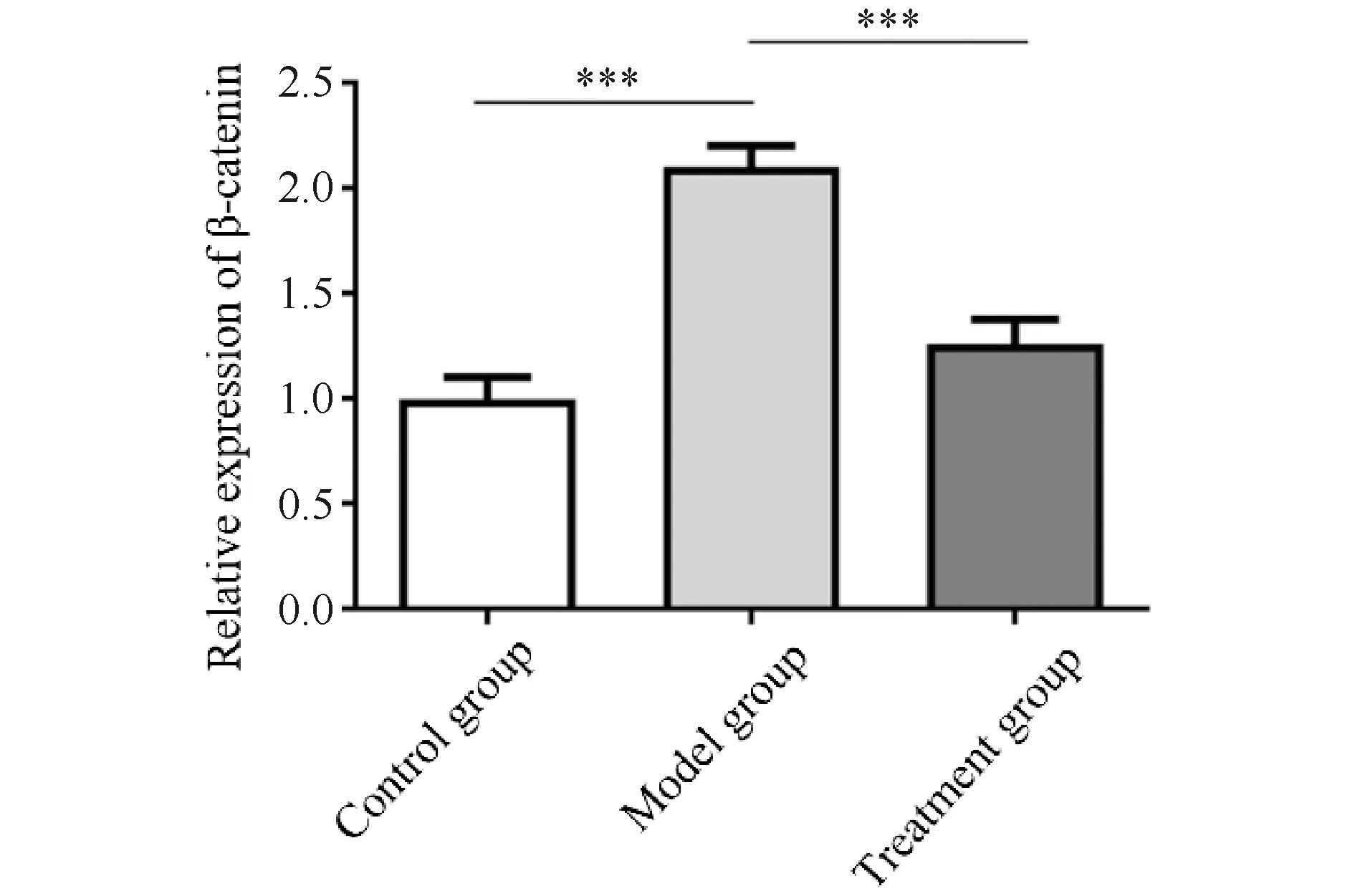
Fig.3 Real time PCR was used to detect the expression of β-catenin Total RNAs from mouse skin microvessels were extracted by Trizol and the levels of β-catenin in each group were detected by PCR. n=6; ***P<0.001
对于蛋白质水平的变化,根据Western印迹结果(Fig.4)显示,模型组小鼠皮肤微血管中col1A1及α-SMA蛋白质表达量较对照组小鼠明显增加,差异有统计学意义(P<0.05),这也从蛋白质水平印证了本文造模是成功的。在经iCRT3处理后的小鼠皮肤微血管中,col1A1及α-SMA表达量较模型组同样明显减少(P<0.05)。结果提示,抑制Wnt通路能有效减少微血管纤维化相关蛋白质的表达,减轻血管壁的细胞外基质沉积及纤维化重塑。同时,本文也对Wnt通路相关蛋白质β-联蛋白及Wnt5A进行检测发现,模型组β-联蛋白及Wnt5A蛋白质表达量较对照组明显增加,而治疗组β-联蛋白及Wnt5A较模型组蛋白质表达量有所下降,差异有统计学意义(P<0.05)。
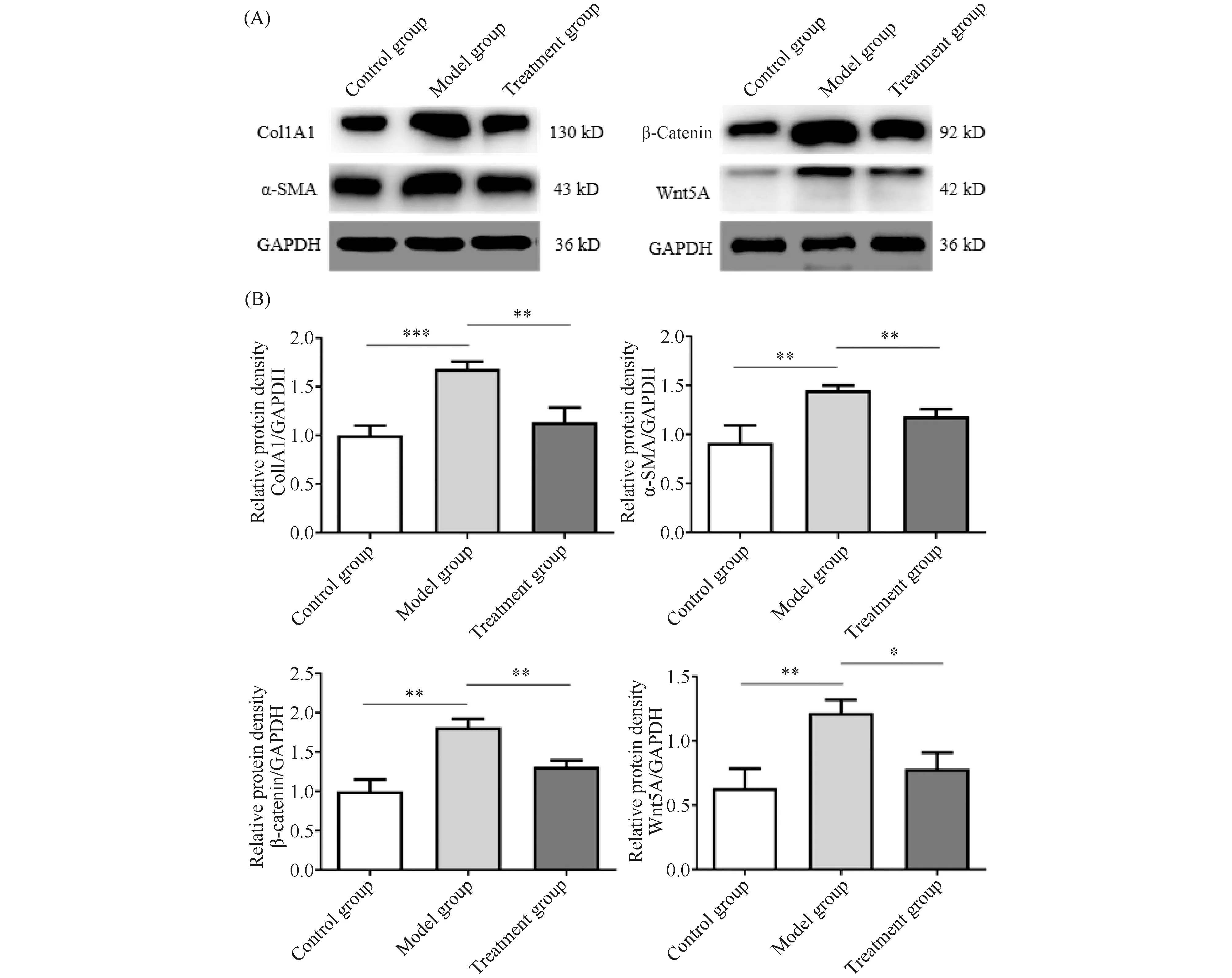
Fig.4 Relative protein expression of α-SMA, col1A1, β-catenin and Wnt5A in mouse skin microvessels The protein levels of col1A1, α-SMA, β-catenin and Wnt5A in the skin microvessels of mice in each group were extracted and detected by Western blot. GAPDH was used as a loading control. n=6; *P<0.05, **P<0.01, ***P<0.001
3 讨论
博来霉素诱导系统性硬化的小鼠模型可追溯至1999年,Yamamoto等[8]的报道。该研究发现,通过在小鼠背部皮肤局部注射BLM可以诱导皮肤纤维化样表现,与系统性硬化症皮肤表现非常类似。例如,皮肤变紧变硬、真皮层明显增厚、胶原增生,脂肪层显著减少、被纤维组织包绕,胶原含量增多,并伴有明显的炎症反应。该学者还对比了不同品系小鼠在局部注射博来霉素后的皮肤纤维化情况,发现所有品系的小鼠在局部注射博来霉素后,均能诱导皮肤纤维化改变[9-10]。
因此,我们选择更为经济、来源更为广泛、造模方式更为成熟的Balb/C小鼠作为实验造模对象。通过在小鼠背部皮下注射BLM来诱导小鼠系统性硬化症模型,在对小鼠连续4周皮下注射BLM后,取皮肤病理组织进行观察(见Fig.1),小鼠皮肤表皮层及真皮层均明显增厚,脂肪层明显变薄,皮脂腺及毛囊萎缩、数目减少,胶原纤维增生、增粗,同时出现炎症细胞浸润,这与SSc患者皮肤病理结果表现非常类似,也与Yamamoto等所报道的实验模型小鼠皮肤改变一致[8,10],说明本文成功地在Balb/C小鼠中诱导了SSc皮肤纤维化模型。模型组小鼠真皮层微血管也出现明显增厚,呈肌化性改变,微血管α-SMA染色阳性面积、深度都较对照组明显加重(见Fig.1),说明BLM诱导皮肤纤维化发生的同时,也伴随皮肤微血管病变。
系统性硬化症的血管病变往往发生在疾病的早期,甚至常常早于纤维化的发生。持续性炎性损伤、促血管生成因子和抗血管生成因子之间的失衡、内皮细胞、周细胞以及成纤维细胞的异常激活、血管内膜增厚,最终导致SSc血管病变,血管狭窄和闭塞、组织缺血、纤维化,器官功能障碍[11-14]。但迄今,SSc血管病变的初始事件仍不清楚,结构性和功能性血管异常之间的相互关系复杂,病理机制也尚不明确。
以往有研究证实,Wnt通路在SSc的纤维化进展中发挥重要病理作用[3,5-7],尚无研究报道Wnt通路在SSc血管病变中的作用。但研究证实,经典Wnt通路可参与血管病变,是血管形成和成熟的主要驱动力[15],可促进内皮细胞分化和增殖[16-17]。在BLM诱导的小鼠皮肤纤维化模型中,皮肤Wnt 蛋白上调(见Fig.4),α-SMA免疫组化(见Fig.1)结果提示,微血管肌化性改变明显,α-SMA阳性染色明显加深,而在经iCRT3抑制剂治疗后的小鼠皮肤免疫组化显示,α-SMA阳性表达较减低。本文的研究提示,Wnt通路的异常激活参与了BLM诱导的系统性硬化小鼠的皮肤血管病变的发生。
白细胞介素-6(IL-6)是一种经典的促炎细胞因子,具有多种生物学效应。研究已证实,IL-6可诱导成纤维细胞产生TGF-β,促进SSc皮肤和脏器的纤维化[18-20]。有研究显示,Th17细胞的比例、IL-17A表达水平在SSc中明显升高,可诱导成纤维细胞生长和胶原合成,参与了SSc纤维化的发生发展,与疾病活动度、毛细血管扩张等均有相关性[16,21-22]。本研究显示(见Fig.2),Wnt通路抑制剂可使BLM诱导的SSc小鼠模型血清IL-6及IL-17表达水平下降(P<0.05),提示Wnt通路可能是通过直接或间接的方式下调细胞因子IL-6及IL-17表达,干预BLM诱导的小鼠血管病变的进展。
综上所述,本研究在BLM诱导的SSc小鼠模型中成功地验证了Wnt/β-catenin通路在小鼠皮肤微血管中存在异常激活现象。抑制Wnt通路可以改善BLM诱导的SSc小鼠皮肤纤维化及血管病变,这为SSc治疗提供了新的研究思路与方向。但本研究不足之处在于未从细胞水平,例如内皮细胞及血管周细胞来观察Wnt/β-catenin通路改变,今后将进一步探讨Wnt通路在SSc血管病变的细胞分子机制。
