多聚嘧啶区结合蛋白1通过调控基因的可变剪接促进胆管癌细胞的生长、迁移及侵袭能力
2022-09-07曹鹏博周钢桥
张 静, 程 敏, 金 倩, 曹鹏博, 周钢桥,*
(1)河北大学 生命科学学院生物学系,河北, 保定 071002;2)军事科学院 军事医学研究院辐射医学研究所,蛋白质组学国家重点实验室,国家蛋白质科学中心(北京), 北京 100850;3)南京医科大学 公共卫生学院流行病学系, 南京 211166;4)徐州医科大学 肿瘤生物治疗研究所,江苏, 徐州 221002)
胆管癌(cholangiocarcinoma, CCA)是一种难治且高危的恶性肿瘤,一般被分为肝内胆管癌、肝门区胆管癌和肝外胆管癌三种类型[1]。在全球范围内,CCA发病率表现出地理差异,东方地区的发病率远高于西方[2]。这些差异可能反映了地理和遗传风险因素的重要性[3]。我国是世界上CCA发病率最高的国家之一[4]。由于目前缺乏很好的早期检测和诊断方法,大部分CCA患者被发现时多为中晚期,手术切除术仍是目前CCA唯一有效的治疗手段。然而,由于CCA易向胆管壁浸润,并侵袭周围血管、神经及淋巴组织等,因此手术切除率很低,患者总体预后较差[5, 6]。即使部分患者能够实施手术切除,术后复发的概率仍然很高。因此,研究CCA的发生发展规律,探寻新的治疗靶标和预后指标,对于提高CCA的防诊治水平具有重要意义。
多聚嘧啶区结合蛋白1(polypyrimidine tract-binding protein 1, PTBP1)是核不均一核糖核蛋白质家族(heterogeneous nuclear ribonucleoprotein, HnRNP)中的一员[7]。已有研究表明,PTBP1可以在转录后水平发挥作用,调控信使RNA(messenger RNA, mRNA)的可变剪接(alternative splicing, AS)、多聚腺苷酸化、亚细胞定位、稳定性和翻译等过程[8, 9]。真核转录物的可变剪接是一种普遍存在的基因表达调控机制,是指通过不同的剪接方式对前体mRNA中的外显子和内含子进行组合,产生不同的mRNA剪接异构体的过程[10]。不同的剪接异构体之间的差异可能会影响mRNA的亚细胞定位、稳定性或翻译等过程,增加蛋白质组的复杂性,从而极大地拓展基因功能的多样性[11]。作为可变剪接调控因子,PTBP1蛋白具有4个与RNA结合的结构域,可直接结合RNA,调控mRNA的可变剪接过程,使剪接异构体编码不同功能的蛋白质,从而影响肿瘤细胞的增殖、迁移和侵袭能力[12, 13]。例如,在膀胱癌细胞中,PTBP1通过调节MACF1的可变剪接过程,促进膀胱癌细胞的增殖[14];在晚期肝癌临床模型中,PTBP1可参与EXOC7的剪接过程,调控衰老相关分泌表型,从而促进肝癌的进展[15]。然而,PTBP1通过调控可变剪接影响胆管癌进展的研究迄今尚未有报道。本研究旨在通过探索PTBP1对胆管癌细胞的生长、迁移和侵袭能力的影响,并检测其调控的可变剪接事件,以期初步揭示其在胆管癌进展中的作用及潜在机制。
1 材料与方法
1.1 细胞系和载体
人胆管癌细胞系RBE和HuH28均来自本实验室细胞库;用于基因过表达的克隆载体pLVX-Puro购自北京擎科生物科技有限公司;用于敲低PTBP1基因的siRNA片段由金拓思生物科技有限公司合成。
1.2 主要试剂
siRNA转染试剂riboFECTTMCP购自广州锐博生物公司;CCK-8检测试剂盒购自北京庄盟国际生物基因科技有限公司;Transwell小室(353097)和Invasion小室(354480)均购自美国BD-Biocoat;SYBR Green 荧光定量试剂盒购自美国Kapa;RIPA(强)细胞/组织蛋白质裂解液及RNA提取试剂盒均购自北京康为世纪生物科技有限公司;PCR试剂购自上海TOYOBO生物科技有限公司。
1.3 细胞培养
实验所用培养基均为含10% FBS和1%青、链霉素双抗的(dulbecco’s modified eagle’s medium, DMEM),人胆管癌细胞系RBE和HuH28的培养条件为37 ℃、5% CO2,并保持一定的湿度。
1.4 构建稳定过表达PTBP1的胆管癌细胞系
分别将慢病毒包装质粒pMD2.G、pSPAX2与目的质粒(pLVX或pLVX-PTBP1)按1∶2∶3的比例共转染于HEK293T细胞系,8 h后更换为正常培养基继续培养,48 h时收集富含病毒颗粒的细胞培养上清液,用0.45 μm滤器过滤以除去细胞碎片。取1 mL含有病毒颗粒的上清液与1 mL 含10% FBS的培养基混匀,并加入5 μg/mL的Polybrene感染RBE和HuH28,48 h时加入终浓度为2 μg/mL嘌呤霉素进行筛选。
1.5 siRNA的转染
设计和合成2条针对PTBP1基因的siRNA片段(分别为:siPTBP1-1,5′-GCACAGTGTTGAAGA TCAT-3′;siPTBP1-2,5′-GCGTGAAGATCCTGTTCAA-3′),将siRNA和转染试剂室温孵育15 min,制成转染复合物,转染至RBE和HuH28细胞中,37 ℃、5% CO2培养48 h。
1.6 Western印迹分析
配制10%浓度的SDS-PAGE胶进行上样、电泳、转膜、5%脱脂牛奶封闭70 min、4 ℃过夜,孵育一抗、TBST洗膜、室温孵育二抗90 min、TBST洗膜,最后进行显影。PTBP1抗体(32-48 000;1∶1 000)购自美国Invitrogen;GAPDH抗体(60004-1-Ig;1∶2 000)购自美国Proteintech;鼠源二抗(CW0102M;1∶1 000)购自北京康为世纪生物科技有限公司。
1.7 实时荧光定量PCR(qRT-PCR)
按照试剂盒说明书进行细胞总RNA的提取。再取500 ng RNA逆转录为cDNA,以2 μL cDNA为模板,进行实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)扩增实验(详细引物信息见Table 1)。所有样本均设3个重复,以GAPDH基因为对照,使用△△Ct法对mRNA定量结果进行归一化处理。所有PCR实验均进行熔解曲线分析,以排除非特异性扩增。
1.8 细胞生长能力的检测
在细胞生长实验中,取对数生长期细胞,按2 000个/孔细胞量接种于96孔板中。待细胞贴壁后,吸弃原有的培养基,加入100 μL含10% CCK-8试剂的无双抗DMEM培养基,培养箱中孵育90 min后测定450 nm处的光密度值(A450)。每隔24 h重复检测1次,连续观测5~6 d。在细胞平板克隆实验中,同样取用对数生长期细胞,按700个/孔细胞量接种于6孔板中。培养10~15 d,期间每隔3 d换液1次,敲低组每隔3 d瞬转1次siRNA,以维持细胞中PTBP1的低表达状态。待出现肉眼可见的克隆时,终止培养,4%多聚甲醛固定30 min,0.5%结晶紫溶液染色15 min。最后,洗净并晾干平板,对克隆进行拍照、计数和统计分析。
1.9 细胞迁移和侵袭能力的检测
采用Transwell实验检测细胞的迁移能力。取对数生长期细胞,无血清DMEM饥饿处理12 h。饥饿完毕后,用无血清DMEM重悬细胞,稀释成3 × 105个/mL。在Transwell小室内加入200 μL上述细胞悬液,在小室外加入800 μL含20% FBS的培养基,继续培养24~40 h,4%多聚甲醛固定小室30 min,0.5%结晶紫染色10 min。最后,洗净并晾干小室,在显微镜下随机选取3个不同的视野,对穿过小室的细胞进行拍照、计数和统计分析。采用Invasion实验检测细胞的侵袭能力。基本步骤同上述的Transwell法,不同之处在于所铺细胞量为Transwell实验的2倍,培养箱中培养30~48 h后,取出小室固定、染色、清洗、拍照和计数统计。
1.10 转录物组测序及基因表达定量分析
提取敲低PTBP1及对照组的胆管癌细胞RBE中的RNA,由北京贝瑞和康生物技术有限公司在Illumina HiSeq X Ten平台上采用150碱基对(base pair, bp)的双端配对策略进行转录物组测序(RNA-seq)。随后,采用FastQC软件对测序数据进行质量评价,并利用trim-galore去除低质量的数据和接头序列[16]。以Genome Reference Consortium Human Build 38(GRCh38/hg38)基因组序列为参考,采用salmon对通过质量评估的测序数据进行序列比对和定量[17]。并利用DESeq[18]软件进行基因差异表达分析,采用Benjamin-Hochberg(BH)方法对其进行多重检验校正,将敲低PTBP1前后log2[fold change] > 0.3及P< 0.05的基因定义为显著差异表达基因。最后,使用Metascape[19]网站对显著差异表达基因进行功能富集分析,以鉴定PTBP1在胆管癌中影响的生物学过程和/或信号通路。
1.11 转录物组的可变剪接分析
基于前述转录物组测序数据,采用SUPPA2[20]鉴定PTBP1可能参与调控的可变剪接事件。首先,本文使用Wilcoxon符号秩检验比较了对照组和敲低组剪接事件的剪入百分比(percent spliced in, PSI)差异。再采用BH方法进行多重检验校正。本文将剪接事件平均∣ΔPSI∣ > 0.1且P< 0.05的剪接事件定义为显著差异的可变剪接事件。
1.12 半定量PCR法检测基因的剪接亚型
提取各组细胞的总RNA,通过逆转录反应获得cDNA,对cDNA进行半定量PCR实验。利用Primer3[21]网站,将基因上游引物设计在被剪接的外显子之前,将下游引物设计在被剪接的外显子之后,详细引物信息见Table 1。PCR反应条件为:94 ℃预变性3 min后开始如下循环:94 ℃变性反应30 s,62 ℃退火反应30 s,72 ℃延伸反应30 s,经过30个循环,72 ℃继续延伸5 min,最后将反应产物置于4 ℃短暂保存。用1.2%琼脂糖凝胶电泳检测PCR产物,在220 V电压和120 mA电流下电泳约25 min。最后,使用Tanon Gel Image System仪器对凝胶电泳条带进行观察并拍照,并采用Tannon Image(版本1.1)软件对剪接亚型进行定量分析。
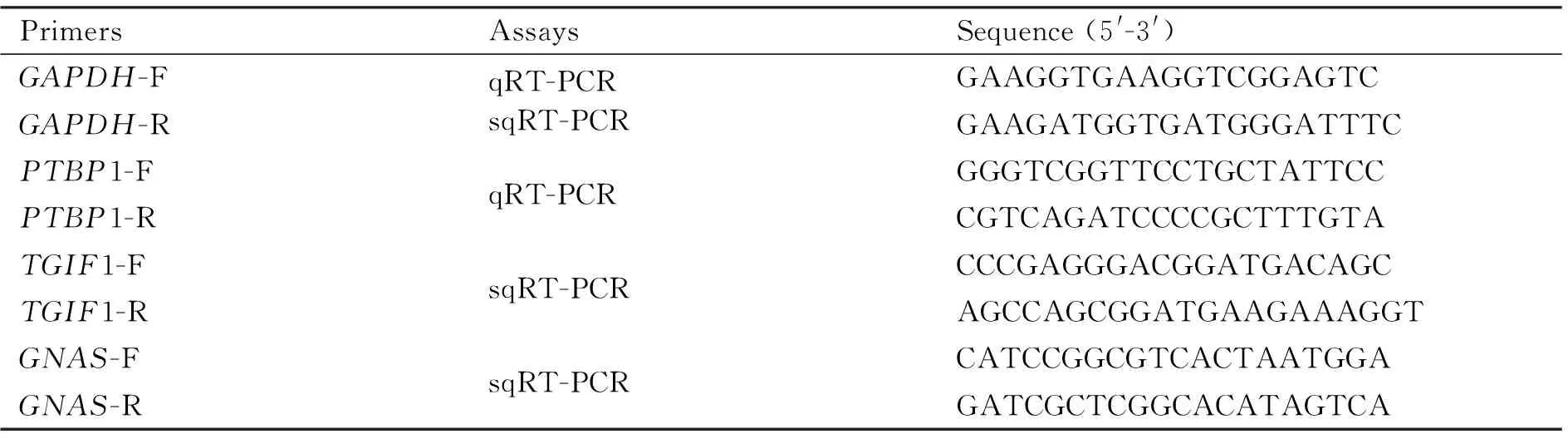
Table 1 The sequences of primers for PCR assays
1.13 转录物在胆管癌和癌旁组织中的表达差异分析
首先,从TCGA数据库(https://portal.gdc.cancer.gov/)下载获得胆管癌患者(包括 36 例胆管癌组织和9例邻近非肿瘤组织)的 RNA转录本数据。再使用Wilcox.test分别比较了TGIF1-L、TGIF1-S、GNAS-L及GNAS-S转录物在胆管癌和癌旁组织中的表达差异。
1.14 统计学分析
癌和癌旁组织间PTBP1的差异表达分析采用双侧t检验。所有实验均重复至少3次。在所有统计学检验中,P< 0.05视为具有显著性意义。所有统计学检验采用SPSS(版本16.0)统计软件完成,数据的可视化采用GraphPad(版本8.0.2)完成。
2 结果
2.1 多聚嘧啶区结合蛋白1在胆管癌组织中显著上调表达
本研究采用基因表达谱交互分析(gene expression profiling interactive analysis, GEPIA)(http://gepia.cancer-pku.cn/detail.)平台[22],在TCGA的31种癌组织及其相应癌旁组织中分析了PTBP1 mRNA的表达水平。结果显示,约1/3癌症类型的癌组织中PTBP1的表达均显著高于对应的癌旁非肿瘤组织(Fig.1A)。其中,PTBP1在胆管癌组织中的mRNA表达水平显著高于癌旁组织(P< 0.05; Fig.1B)。因此,本文推测,PTBP1可能在胆管癌中发挥癌基因的功能。
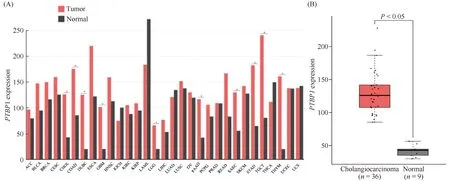
Fig.1 Expression of PTBP1 mRNA in cancer tissues and the matched non-tumor tissues (A) The mRNA expression levels of PTBP1 in 31 types of tumor tissues and adjacent non-tumor tissues from TCGA. (B) GEPIA database was used to obtain the PTBP1 expression levels in cholangiocarcinoma tissues (n = 36) and the matched normal tissues (n=9). ACC, adrenocortical carcinoma; BLCA, bladder urothelial carcinoma; BRCA, breast invasive carcinoma; CESC, cervical squamous cell carcinoma and endocervical adenocarcinoma; CHOL, cholangiocarcinoma; COAD, colon adenocarcinoma; DLBC, diffuse large B-cell lymphoma; ESCA, esophageal carcinoma; GBM, glioblastoma multiforme; HNSC, head and neck squamous cell carcinoma; KICH, kidney chromophobe; KIRC, kidney renal clear cell carcinoma; KIRP, kidney renal papillary cell carcinoma; LAML, acute myeloid leukemia; LGG, brain lower grade glioma; LIHC, liver hepatocellular carcinoma; LUSC, lung squamous cell carcinoma; OV, ovarian serous cystadenocarcinoma; PAAD, pancreatic adenocarcinoma; PCPG, pheochromocytoma and paraganglioma; PRAD, prostate adenocarcinoma; READ, rectum adenocarcinoma; SARC, sarcoma; SKCM, skin cutaneous melanoma; STAD, stomach adenocarcinoma; TGCT, testicular germ cell tumors; THCA, thyroid carcinoma; THYM, thymoma; UCEC, uterine corpus endometrial carcinoma; UCS, uterine carcinosarcoma. *P < 0.05
2.2 多聚嘧啶区结合蛋白1促进胆管癌细胞的生长能力
为了进一步研究PTBP1在胆管癌发生发展过程中的生物学功能,本文通过慢病毒包装的方法构建了稳定过表达PTBP1的胆管癌细胞株,通过转染特异性靶向PTBP1的siRNA,构建了瞬时敲低PTBP1的胆管癌细胞株。本文采用qRT-PCR及Western印迹检测以验证PTBP1的过表达和敲低效果。结果显示,在RBE和HuH28细胞中,与对照组(pLVX)相比,过表达(pLVX- PTBP1)组中PTBP1在mRNA和蛋白质水平的表达均显著增加,证明成功构建了稳定过表达PTBP1的细胞株(Fig.2A);与对照组(siCtrl)相比,敲低(siPTBP1-1和siPTBP1-2)组中PTBP1 在mRNA和蛋白质水平的表达均显著降低,证明成功抑制了内源性PTBP1的表达(Fig.2B)。进一步采用CCK-8实验评价PTBP1对胆管癌细胞生长能力的影响。结果显示,与对照组相比,过表达PTBP1可显著促进RBE和HuH28细胞的生长能力(P< 0.01; Fig.2C),而敲低PTBP1则显著抑制RBE和HuH28细胞的生长能力(P< 0.001; Fig.2D)。此外,本文还通过细胞平板克隆实验,以检测PTBP1对胆管癌细胞克隆生长能力的影响。结果显示,过表达PTBP1可显著促进RBE和HuH28细胞的克隆生长能力(P< 0.001; Fig.2E),而敲低PTBP1则显著抑制RBE和HuH28细胞的克隆生长能力(P< 0.001; Fig.2F)。这些结果表明,PTBP1促进胆管癌细胞的生长能力。
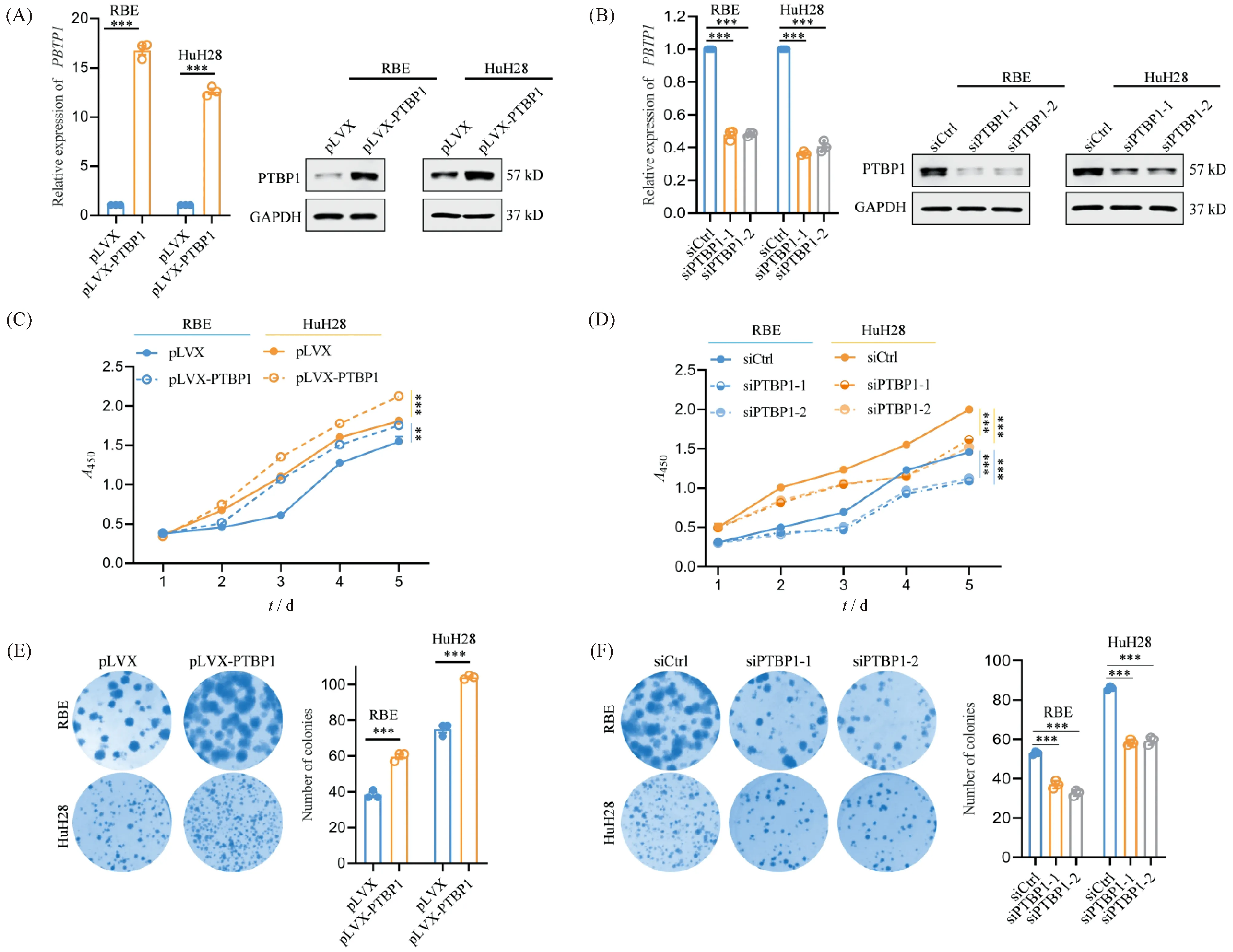
Fig.2 PTBP1 promotes the growth ability of CCA cells in vitro (A, B) Left: Relative expression levels of PTBP1 in RBE and HuH28 cells expressing pLVX, pLVX-PTBP1, siCtrl or siPTBP1, detected by qRT-PCR assays. Right: The protein levels of PTBP1 in RBE and HuH28 cells expressing pLVX, pLVX-PTBP1, siCtrl or siPTBP1, detected by Western blot assays. (C, D) The CCK-8 assays were used to evaluate the growth abilities of RBE and HuH28 cells upon PTBP1 overexpression (C) or knockdown (D). (E, F) The cell growth capacity was assessed by colony formation assays in RBE and HuH28 cells upon PTBP1 overexpression (E) or knockdown (F). The cells were seeded in 6-well plates for 15 days followed by staining and quantification. Data are shown as mean ± SEM (standard error of mean) of three independent experiments, two-tailed Student t test. **P < 0.01, ***P < 0.001
2.3 多聚嘧啶区结合蛋白1促进胆管癌细胞的迁移和侵袭能力
为评价PTBP1是否影响胆管癌细胞系的迁移及侵袭能力,本文在胆管癌细胞RBE和HuH28中稳定过表达和瞬时敲低PTBP1,进行Transwell迁移(Fig.3A, B)和Invasion侵袭(Fig.3C, D)实验。结果显示,PTBP1过表达可显著促进胆管癌细胞的迁移和侵袭能力(P< 0.001),而敲低PTBP1则显著抑制胆管癌细胞的迁移和侵袭能力(P< 0.001)。上述结果表明,PTBP1促进胆管癌细胞的生长、迁移及侵袭能力,在胆管癌进展中可能发挥癌基因的功能。
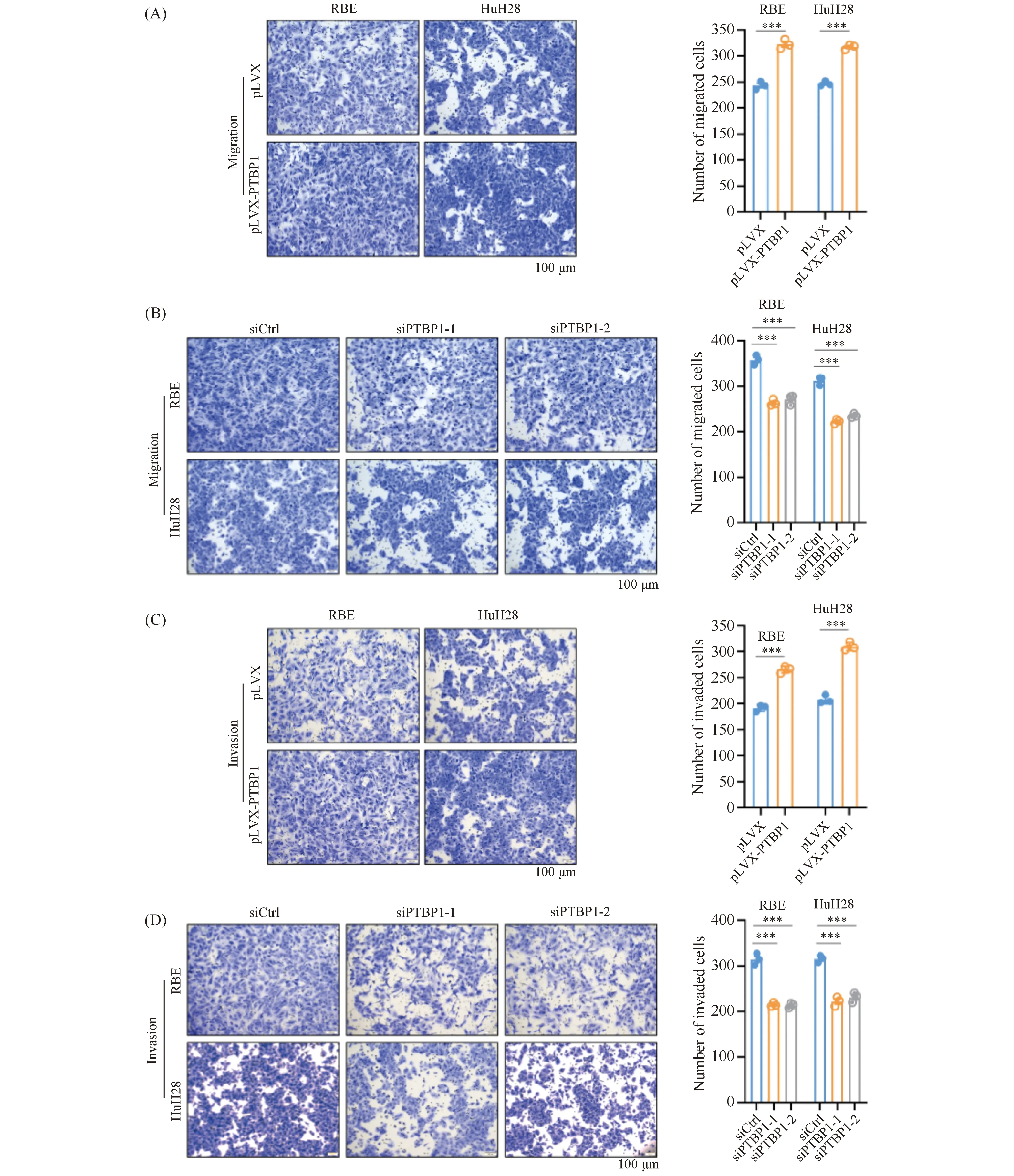
Fig.3 PTBP1 promotes the migration and invasion abilities of CCA cells in vitro (A, B) Transwell assays were applied to detect the migration ability of CCA cells with overexpression or knockdown of PTBP1. (C, D) Invasion assays showed the effect of PTBP1 on the invasion ability in RBE and HuH28 cells. Representative images of migratory or invasive cells on the membrane were presented in the left panel. Scale bar, 100 μm. Data are shown as mean ± SEM (standard error of mean) of three independent experiments, two-tailed Student t test. ***P < 0.001
2.4 多聚嘧啶区结合蛋白1参与调控多条肿瘤相关信号通路
为探索PTBP1促进胆管癌进展的作用机制,本文在RBE细胞中特异性地敲低PTBP1并进行RNA-seq实验。主成分分析(principal component analysis, PCA)结果显示,对照组细胞的转录物组与敲低PTBP1组细胞的转录物组显著分散并各自成群(Fig.4A)。差异表达基因分析显示,敲低PTBP1显著上调87个基因的表达,下调120个基因的表达(Fig.4B, C; Supplementary Table 1)。随后,本文分别对上调表达基因和下调表达基因进行功能富集分析。结果显示,PTBP1负调控的基因显著富集于p53信号通路、铁死亡及DNA损伤诱导的细胞衰老过程等抑癌信号通路(Fig.4D),提示PTBP1可能通过抑制p53等抑癌信号通路来发挥促癌功能。此外,本文发现PTBP1正调控的基因显著富集于胆固醇代谢、细胞周期、Rho GTP酶、TGF-β及Hippo等促癌信号通路(Fig.4E),提示在胆管癌恶化过程中,PTBP1可能通过激活多条促癌信号通路,从而促进胆管癌的进展。
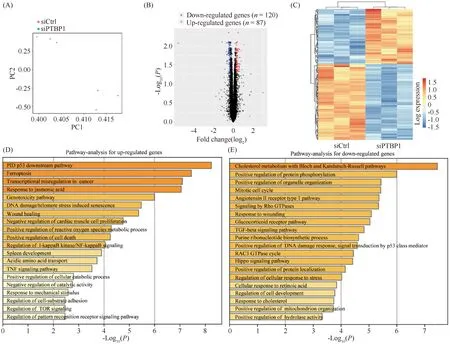
Fig.4 PTBP1 regulates multiple cancer-associated signaling pathways (A) The principal component analysis (PCA) plot showed that the control and PTBP1-depleted RBE cells were clearly separated. PC, principal component. (B) The volcano plot showed the differentially expressed genes (log2[fold-change] > 0.3, P < 0.05) in PTBP1-depleted RBE cells compared to control cells. (C) The heatmap of the 207 differently expressed genes. (D, E) Functional enrichment analyses of up-regulated genes (D) and down-regulated genes (E) in PTBP1-depleted RBE cells
2.5 多聚嘧啶区结合蛋白1调控基因的可变剪接过程
已有研究表明,PTBP1可作为剪接因子发挥重要的生物学功能[9]。为进一步深入研究PTBP1促进胆管癌细胞恶性进展的作用机制,本文基于上述RNA-seq数据,系统分析了敲低PTBP1所诱导的差异可变剪接事件。可变剪接事件主要分为7种基本类型:外显子跳跃(skipped exon, SE)、可变5′剪接位点(alternative 5′ splicing site , A5)、可变3′剪接位点(alternative 3′ splicing site , A3)、互斥可变外显子(mutually exclusive exons, MX)、内含子保留(retained intron, RI)、可变初始外显子(alternative first exon, AF)和可变终末外显子(alternative last exon, AL)剪接事件(Fig.5A)[11]。本文的分析结果显示,敲低PTBP1导致159个可变剪接事件发生显著变化(P< 0.005, ∣ΔPSI∣ > 0.1; Fig.5B-D; Supplementary Table 2)。
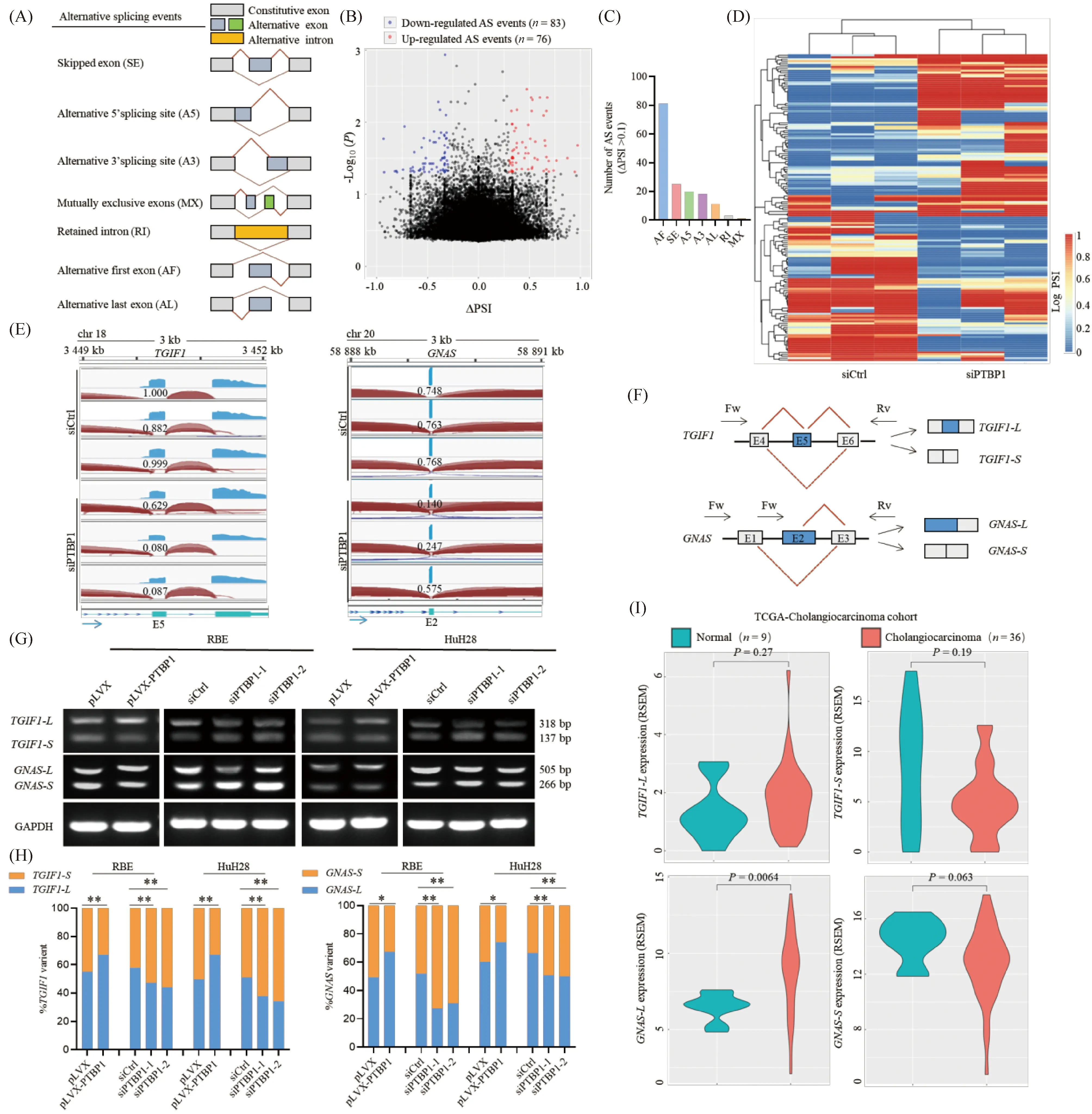
Fig.5 PTBP1 promotes oncogenic splicing of TGIF1 and GNAS (A) Schematic diagrams of the main types of alternative splicing events. Exons are represented by boxes, and diagonal lines indicate alternative splicing (AS) events. (B) The volcano plot shows significantly aberrant AS events (∣ΔPSI∣ > 0.1, P < 0.05) in PTBP1-depleted RBE cells compared to control cells. (C) Number of splicing events detected for 7 kinds of AS events regulated by PTBP1. (D) The heatmap of significantly aberrant AS events regulated by PTBP1. (E) Knockdown of PTBP1 promotes the skipping of TGIF1 exon 5 and GNAS exon 2 retention determined by RNA-seq analyses in RBE cells. The PSI values are indicated for each sample. (F) Schematic diagrams of alternative splicing events within TGIF1 and GNAS. Exons (boxes) and introns (lines) are indicated. (G) Semi-quantitative PCR assays of in vitro splicing shows regulatory effects of PTBP1 on the exon 5 skipping of TGIF1 and the exon 2 retention of GNAS in RBE and HuH28 cells. (H) Densitometric analyses of the splicing assays shown in (E). (I) Expression of TGIF1-L, TGIF1-S, GNAS-L and GNAS-S transcripts in cholangiocarcinoma tissues (n=36) and the matched non-tumor tissues (n=9). PSI, percent spliced in; E, exon; Fw, forward; Rv, reverse. RSEM, RNA-seq by expectation-maximization. *P < 0.05, **P < 0.01
事实上,已有研究证实,剪接因子可通过调控可变剪接事件变化来影响p53[23]、铁死亡[24]、胆固醇代谢[25]、细胞周期[26]、Rho GTPase[27]、TGF-β[28]及Hippo[29]等多种信号通路,从而促进肿瘤的进展。在PTBP1调控的159个可变剪接事件中,本文首先关注了SE剪接事件中综合排名前10位的基因。结果发现,其中包含了TGF-β信号通路活性抑制基因TGIF1(Fig.5E, F)[30]。已有研究表明,TGIF1基因经过可变剪接过程可产生12种剪接异构体[31]。本文发现,在RBE细胞中敲低PTBP1,TGIF1的5号外显子发生跳跃,导致TGIF1-L亚型向TGIF1-S亚型转换。随后,采用半定量PCR实验证实,PTBP1在胆管癌细胞RBE和HuH28中可抑制TGIF1的 5号外显子的SE事件,从而诱导TGIF1-S亚型向TGIF1-L亚型的转换(Fig.5G, H)。TGIF1-S已被报道在口腔鳞癌细胞中低表达,可能发挥抑癌功能[32]。
本文重点关注了分布最为广泛的AF剪接事件。在综合排名前10位的基因中,发现了与p53通路相关的基因GNAS(Fig.5E, F)[33]。GNAS被证实存在多个转录物,而这些转录物的产生大多数是由于外显子1和外显子2的剪接所引起[34]。本文结果发现,在RBE细胞中敲低PTBP1,GNAS的2号外显子剪接异构体(GNAS-L)向1号外显子剪接异构体(GNAS-S)转换。进一步采用半定量PCR方法证实,在胆管癌细胞中,PTBP1参与调控GNAS的2号外显子的AF事件,诱导GNAS-L亚型的表达(Fig.5 G, H)。已有研究表明,GNAS-L包含RAS同源结构域,参与调控G蛋白质激活及GTP酶活性,是肿瘤潜在的治疗靶点[35]。与此一致的是,通过分析TCGA胆管癌转录组数据集发现,TGIF1-L和GNAS-L亚型均在胆管癌组织中上调表达,而TGIF1-S和GNAS-S亚型均在胆管癌组织下调表达(Fig.5I)。由于样本量较小,个别组间差异显著性处于阈值临界。随着样本量的增加,此差异可能趋于显著。综上所述,PTBP1作为剪接因子参与调控了多个促癌可变剪接事件,引起多条肿瘤相关信号通路的紊乱,从而促进胆管癌的恶性进展。
3 讨论
胆管癌是一种致死率极高的癌种,治疗方案非常有限,以手术治疗为主,但复发风险极高[36]。目前,胆管癌的确切病因尚不明确,可能与胆道结石、酒精性肝病、非特异性肝硬化、遗传因素及慢性胆管炎等相关[37]。近年来,胆管癌的发病率呈逐年上升的趋势,通常患者在病程晚期时才被确诊,导致患者较低的治愈率[38]。因此,鉴定胆管癌相关基因并探索其致病机制,对胆管癌的防诊治具有重大意义。
HnRNP蛋白质家族是广泛表达的一类RNA结合蛋白质,参与mRNA的转运、代谢、剪切及表达等过程的调控,进而影响多种肿瘤的发生发展过程[39, 40]。作为hnRNP蛋白质家族中的一员,PTBP1已被证明在多种肿瘤组织中上调表达,且其高表达与患者的不良预后显著相关[41]。但其在胆管癌中的生物学功能一直未见报道。本研究中发现,PTBP1在胆管癌组织中上调表达,细胞学水平的功能研究证实,PTBP1可以促进胆管癌细胞的生长、迁移及侵袭,提示PTBP1在胆管癌的发展中可能作为癌基因而发挥功能。
已有多项研究显示,PTBP1可调控多个肿瘤相关基因的可变剪接过程,进而影响肿瘤细胞的生物学行为[9]。例如,PTBP1可通过调控PKM2的可变剪接而影响Warburg效应[42]。Warburg效应是癌细胞特异性的能量代谢过程,已被公认是癌症的一个关键特征[43]。事实上,许多基因对肿瘤的影响之所以不能简单用“致癌”或“抑癌”来定义,正是因为这些基因可通过可变剪接过程,产生结构特性和生物学功能不同、甚至相反的剪接异构体[44, 45]。探索肿瘤中的可变剪接事件可为肿瘤的防治,以及药物的研发提供新的线索。
为揭示PTBP1在胆管癌中发挥促癌功能的机制,本文利用转录物组测序发现,PTBP1可广泛地参与转录物组的可变剪接调控,最终干扰p53、铁死亡、DNA损伤诱导的细胞衰老、胆固醇代谢、细胞周期、Rho GTP酶、TGF-β及Hippo等多条肿瘤相关信号通路。其中,p53是著名的抑癌基因,参与调控周期阻滞、凋亡和代谢等生物学过程[46]。在绝大多数肿瘤细胞中p53会发生突变,引起基因组不稳定性,从而增强癌细胞的增殖能力及耐药性[47]。已有报道发现,PTBP1可通过介导EXOC7等基因的可变剪接来调控肿瘤细胞衰老相关分泌表型(senescence-associated secretory phenotype, SASP)[15]。此外,有研究报道,在肝细胞癌中,高表达的长非编码RNA MEG3可结合PTBP1,诱导并促进SHPmRNA的降解,从而破坏胆固醇稳态并诱导肝硬化[48]。TGF-β信号通路在癌症进展中具有关键作用,由配体、受体、胞内信号转导分子SMAD蛋白质等组成[49]。当通路中任一元件发生异常时,均可引起信号转导过程紊乱,从而导致肿瘤的恶性进展[50]。
本文通过实验证实了PTBP1可调控TGF-β信号通路相关基因TGIF1及p53信号通路相关基因GNAS的可变剪接事件。已有研究表明,在肝癌细胞中TGIF1的表达异常可诱导胆固醇代谢过程发生紊乱,从而促进肿瘤的进展[51]。在结直肠癌细胞中,TGIF1表达上调并促进TGF-β信号通路相关蛋白质的表达,从而促进肿瘤的恶性进展[52]。在胰腺导管腺癌中,p53基因的缺失可诱导GNAS发生突变,从而促进肿瘤的恶性进展[33]。GNAS是迄今为止多数垂体腺瘤的唯一分子标记物,经过可变剪接过程产生多个转录物;而不同转录物之间的转换可引起cAMP通路失调,从而促进垂体腺瘤的进展[34]。然而,TGIF1与GNAS基因可变剪接体之间的转换在肿瘤进展中的详细功能至今未被揭示。也未有研究报道,PTBP1调控TGIF1与GNAS可变剪接事件的潜在肿瘤生物学功能。这提示,PTBP1促进胆管癌具体的作用机制、其参与调控的可变剪接事件、诱导TGF-β及p53等信号通路紊乱的机制仍有待进一步地深入研究。
总之,本文新发现了PTBP1在胆管癌中可能发挥癌基因的功能,并初步探索了其在胆管癌进展中的机制线索。未来我们将进一步探索PTBP1在胆管癌发生发展过程中的肿瘤生物学功能和其分子机制。
