促红细胞生成素产生肝细胞受体A2(EphA2)SAM结构域对激酶结构域的脂质体结合能力与激酶活性的调控研究
2022-09-07陈倩苟
吴 霞, 陈倩苟, 王 玥, 刘 伟
(深圳北京大学香港科技大学医学中心生物医学研究所,深圳市神经结构生物学重点实验室,广东, 深圳 518036)
促红细胞生成素产生肝细胞受体(erythropoietin-producing hepatocellular receptor, Eph receptor)是单次跨膜的受体酪氨酸激酶 (receptor tyrosine kinase, RTK),对细胞的形态、黏附、运动、增值、生存与分化等生理过程发挥重要的调控作用[1]。根据其结合Ephrin配体的特异性,可将Eph受体分为EphA与EphB两个亚型,EphA受体亚家族包含9个成员(EphA1-EphA8、EphA10),EphB受体亚家族包含了5个成员(EphB1-EphB4、EphB6)。Eph受体结构均十分相似,由胞外段、跨膜区和胞内段3部分组成。胞外段包含了配体结合位点(ligand binding domains,LBD),半胱氨酸密集区(cysteine rich domain,CRD),又称sushi区,以及2个Ⅲ型丝连蛋白质重复区(fibronectin Ⅲ repeats,FN Ⅲ)。跨膜区为一段主要由亮氨酸重复序列形成的疏水区组成[2]。胞内段由一段包含YxxxxxY (YVDPHTY in EphA2, 589-595) 的近膜段序列(juxtamembrane segment,JMS)、酪氨酸激酶结构域(tyrosine kinase domain)、SAM(sterile-alpha motif)结构域以及PBM(PDZ domain binding motif)组成(Fig.1A)[3, 4]。
Eph受体的表达异常和突变与众多疾病,包括白内障、癌症(例如前列腺癌、乳腺癌)等密切关联。在EphA2受体中,包括T940I在内的14个错义突变可诱导白内障的产生[5, 6]。免疫组化研究发现,EphA2受体与乳腺癌关系密切,74.80%的乳腺癌组织存在EphA2受体的高表达[7]。此外,EphA2受体的G391R突变在非小细胞肺癌中增强了肿瘤细胞的生存和侵袭能力[8]。而EphA3在小细胞肺癌中则表现为一个抑癌因子,过表达EphA3能促进细胞凋亡及诱导G0/G1期阻滞,并降低肿瘤细胞的化疗耐药性[9]。
研究发现,受体酪氨酸激酶的激酶结构域可通过与细胞膜结合,调控其激酶活性。例如,表皮生长因子受体 (epidermal growth factor receptor, EGFR)的相关研究表明,其近膜端、酪氨酸激酶结构域与细胞膜的结合对EGFR的受体活性有着重要的调控作用[10-12];EphA2胞外段的FN-Ⅲ2及胞内段的酪氨酸激酶结构域与细胞膜的结合会分别引起胞外、胞内段蛋白质构象的改变[13, 14]。而EphA2的胞内段除了激酶结构域以外,还存在与之相邻的SAM结构域。研究表明:SAM结构域对激酶结构域的激酶活性存在抑制作用[16,17],但是其对激酶结构域与细胞膜结合以及由此带来的激酶活性的影响并不清楚。在此项研究中,本文采用牛的大脑提取物进行了脂质体的构建以模拟细胞膜的脂质环境,测试了EphA2的酪氨酸激酶结构域在有无SAM结构域的情况下结合脂类的能力差异,并探索了磷酸化后的激酶-SAM串联结构域对膜结合能力的变化,以及细胞膜对EphA2胞内段激酶-SAM串联结构域的激酶活性的影响。
1 材料与方法
1.1 分子克隆
将从小鼠cDNA文库中PCR获取的EphA2 (NCBI accession number:NP_034269.2)不同片段的cDNA序列, 包括 EphA2激酶结构域(EphA2 KD, aa 571~901), EphA2 激酶-SAM串联结构域 (EphA2 CT, aa 571~977),分别插入pET32 M.3C载体以及预装GST-PTP1B (NCBI accession number:NP_002818.1, aa 1-301) cDNA的pET-duet-1载体。克隆质粒经大肠杆菌DH5α转化、复制,获得上述质粒,并经测序验证。
1.2 蛋白质表达与纯化
将表达质粒转入Rosetta(DE3)菌株 (Novagen),37 ℃条件下平板培养8 h,挑单克隆点接入10 mL培养基,在37 ℃摇床摇菌过夜后放大至1 L培养基,培养至浊度为0.6~0.8,降温至16 ℃,加入终浓度为100 μmol/L的硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG) 诱导培养16~18 h。
离心收菌后用40 mL 结合缓冲液 (20 mmol/L Tris-HCl, pH7.5,500 mmol/L NaCl,5 mmol/L咪唑)重悬菌液,用高压均质仪(上海永联)在600~700 MPa压力下4 ℃匀浆破碎2 min,收集菌液。将细菌细胞裂解液在高速离心机(Beckman)中以48 384 g的速度离心20 min。取上清加入Ni2+-Sepharose 6 Fast Flow (Cytivia)亲和层析柱料上,结合15 min。用30 mL 结合缓冲液洗1次,用20 mL 冲洗缓冲液 (20 mmol/L Tris-HCl, pH 7.5,500 mmol/L NaCl,30 mmol/L咪唑)洗2次,加入15 mL 洗脱缓冲液(20 mmol/L Tris-HCl, pH 7.5,500 mmol/L NaCl,500 mmol/L咪唑),孵育15 min,将蛋白质从填料中洗脱下来。经镍柱洗脱的蛋白质再用HiLoad 26/600 Superdex 200 PG (Cytivia)凝胶过滤色谱柱进一步纯化(用 GB缓冲液(50 mmol/L Tris-HCl, pH 7.5,100 mmol/L NaCl,1 mmol/L DTT,1 mmol/L EDTA) 预先平衡好),收集的目的蛋白质用His-3C酶切割N-端Trx标签,再用HiPrep Q HP 16/10离子交换色谱将目的蛋白质与His-3C 蛋白酶、His-Trx融合标签进行分离。最后,使用 PD-10 (Cytivia)重力色谱柱将离子交换色谱纯化所得的目标蛋白质的缓冲溶液进一步更换为200GB (50 mmol/L Tris-HCl,pH 7.5,200 mmol/L NaCl,1 mmol/L DTT,5 mmol/L MgCl2) 。
1.3 脂质体结合检测
称取10 mg牛的大脑提取物(货号:B3635,Sigma-Aldrich)溶于200 μL 的200GB缓冲液 (50 mmol/L Tris-HCl,pH 7.5,200 mmol/L NaCl,1 mmol/L DTT,5 mmol/L MgCl2)中,用超声法获得脂质体(HD3100超声破碎仪(BANDELIN), 30%功率,“5 s工作/5 s停止”循环, 每次超声2 min, 重复5次)。
根据以上体系(Table 1)将蛋白质混合均匀,室温静置孵育20 min,用436 000 g 速度在4 ℃的超高速离心机离心40 min,分离沉淀与上清。其中,沉淀P为与脂质体结合的蛋白质,上清S为游离蛋白质,15% SDS-PAGE进行鉴定。

Table 1 Reagents of lipid binding assay
1.4 磷酸化水平分析
根据以下体系(Table 2)将蛋白质混合均匀,置于37 ℃水浴中反应30 min。磷酸化完成后,取样用phos-tag 胶或蛋白质免疫印迹的方法验证其磷酸化水平。

Table 2 Reagents of phosphorylation assay
1.5 磷酸化蛋白质免疫印迹
将磷酸化反应后的蛋白质进行SDS-PAGE蛋白质胶(12%)分离,将蛋白质胶上的样品电泳转移到适当大小的NC膜上,用0.5%(W/V)的脱脂乳封闭后,取1∶1 000一抗鼠源anti-p-tyr抗体(Cell Signaling Technology)4 ℃孵育4 h,再以1∶10 000的比例加入抗小鼠IgG的二抗室温孵育2 h,显影,获得磷酸化水平结果。
1.6 phos-tag胶
在常规12% SDS-PAGE分离胶中加入phos-tag丙烯酰胺(货号:300-93523,Wako)得phos-tag胶(Table 3)。

Table 3 Reagents of phos-tag ge
在样品中加入4×SDS-loading dye (80 mmol/L Tris-HCl,pH6.8, 10%(W/V) SDS, 0.5%(W/V)溴酚蓝, 50%(V/V)甘油, 1 mmol/L DTT),并以 100 ℃加热10 min处理,再取20 μL加入到蛋白质胶的点样孔中。在运行缓冲液(25 mmol/L Tris , 250 mmol/L 甘氨酸, 1% (W/V) SDS)中以恒压(200 V)方式电泳100 min,取出分离胶用考马斯亮蓝R-250染料染色,获得磷酸化胶结果。
2 结果
2.1 与磷脂酶PTP1B共表达提升了促红细胞生成素产生肝细胞受体A2胞内段蛋白质的纯化质量和均一性
EphA2受体是经典的酪氨酸激酶受体,具有自磷酸化的能力[15]。本文首先构建了Trx蛋白质融合的EphA2受体胞内段的激酶-SAM串联结构域(以下简称为EphA2 CT)的表达质粒(Fig.1B)。由于Trx-EphA2 CT蛋白质具有一定的自磷酸化的能力,在Trx-EphA2 CT的阴离子交换Q柱色谱图与凝胶图中,目的蛋白质洗脱峰不仅在低盐浓度可被洗脱,同时也在高盐浓度被洗脱出来,且洗脱位置与酶切后的Trx标签重叠 (Fig.2A, B)。该现象表明,单独表达的EphA2胞内段蛋白质的表面电荷并不均一。表面携带负电荷较少的目标蛋白质在较低的盐浓度中被洗脱下来;而表面携带负电荷较多的目标蛋白质则在高盐浓度中与Trx标签一起被洗脱出来(Fig.2A, B)。由于单独表达的EphA2胞内段蛋白质表面电荷状态不均一,因此,本文将带GST标签的磷酸酶PTP1B(protein tyrosine phosphatase1B)的1~301片段,与带Trx标签的EphA2受体片段共表达(Fig.1B),试图通过与PTP1B的共表达降低EphA2的自磷酸化水平,以得到纯净和稳定的蛋白质。与单独表达的EphA2胞内段蛋白质相比,磷酸酶PTP1B 1~301活性片段共表达的Duet-EphA2 CT胞内段蛋白质的阴离子交换色谱的洗脱模式明显不同:目标蛋白质只在低盐浓度下被洗脱,不与Trx蛋白质共同洗脱,结果提示,其表面电荷的带电状态相对于单独表达的Trx-EphA2 CT存在明显差异,携带更少的表面负电荷 (Fig.2C, D)。
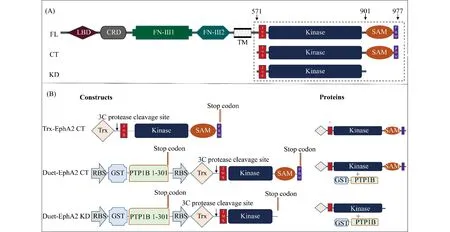
Fig.1 Domain organization and protein expression strategies of different EphA2 fragments (A) Schematic diagrams showing the domain organization of EphA2 full-length, the KD (EphA2 kinase domain, aa 571-901, including juxtamembrane segment and kinase domain) and CT (EphA2 cytoplasmic tail, aa 571-977, including juxtamembrane segment, kinase domain, SAM domain and PBM). (B) Schematic diagrams showing the protein expression strategies of EphA2 CT and KD (Left: Constructs of target proteins; Right: overexpression products). RBS: ribosome binding site
对比2种表达载体的蛋白质磷酸化水平,单独表达的Trx-EphA2 CT的磷酸化水平较高,表面电荷存在至少2种带电状态,而与PTP1B共表达的Trx-EphA2 CT表面电荷较少,磷酸化水平较低或接近于“无磷酸化”(Fig.2E)。就蛋白质的性质而言,由于单独表达的Trx-EphA2 CT的自我磷酸化,使其蛋白质性质表现为稳定性差和容易沉淀。因此,在经过表达纯化条件的优化和摸索后,通过EphA2与PTP1B共表达的方式,得到了稳定而均一的目的蛋白质,为后续实验提供了便利。
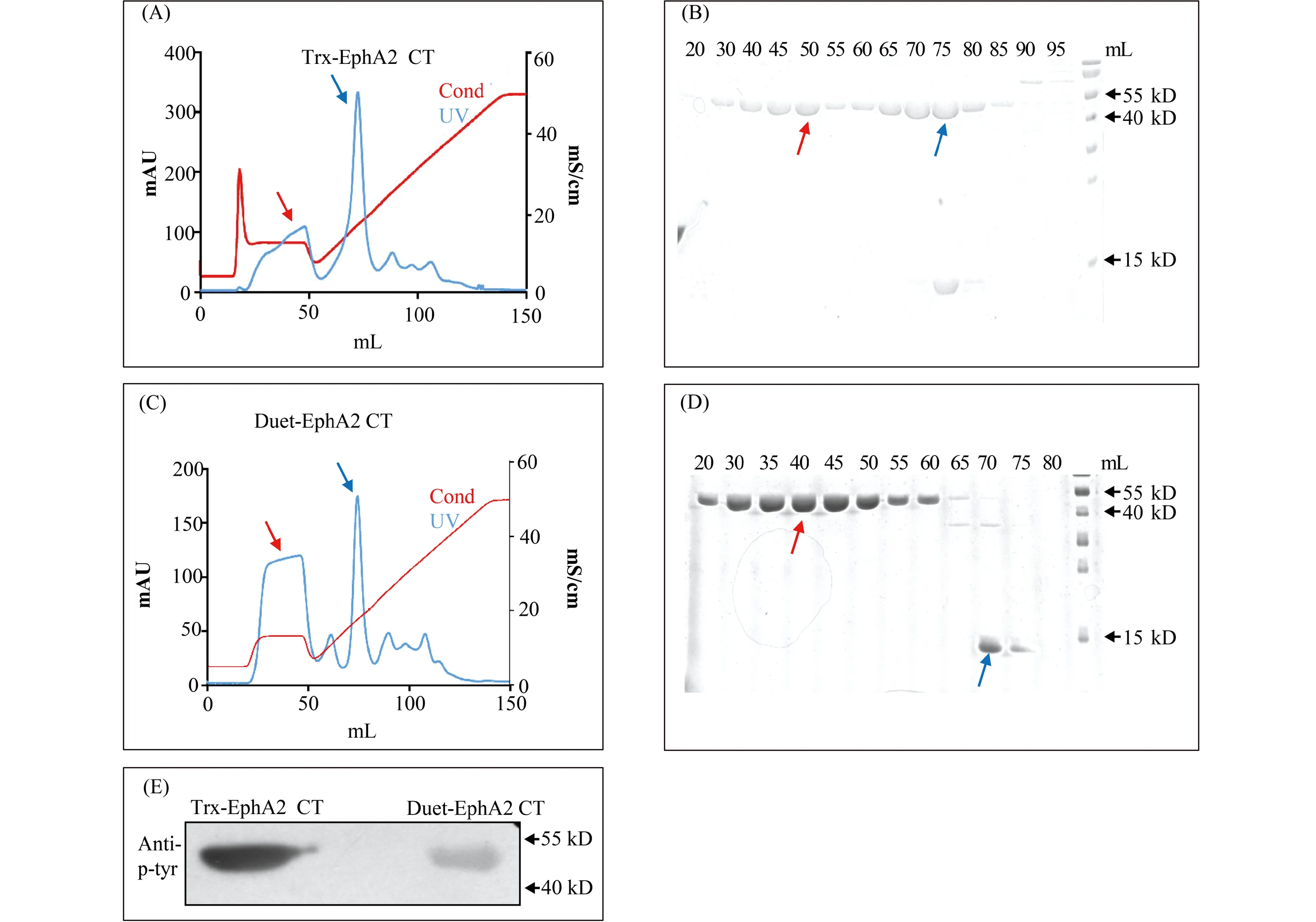
Fig.2 Explosion of the expression and purification conditions of EphA2 intracellular portion (A, B) Anion ion exchange chromatography and corresponding SDS-PAGE (15%) results of Trx-EphA2 CT fusion protein. There is a two-peak distribution profile on the anion ion exchange column. The blue line in the figure A showing the UV absorption, and the red line showing the conductance. The red arrow in figure A&B shows the first elution peak of target protein, and the blue arrow showing the second elution peak, which is overlapped with the elution peak of Trx tag. (C, D) Anion ion exchange chromatography and corresponding SDS-PAGE (15%) results of Trx-EphA2 CT protein co-expressed with PTP1B 1-301 fragment. The elution peak of Trx-EphA2 CT protein on the anion ion exchange column is not overlapped with the elution peak of Trx tag. The blue line in the figure C showing the UV absorption, and the red line showing the conductance. The red arrow in figure C&D shows the elution peak of Trx-EphA2 CT protein, and the blue arrow shows the elution peak of Trx tag. (E). The auto-phosphorylation levels of purified EphA2 CT from two expression methods (non-PTP1B co-expression versus PTP1B co-expression) were measured by Western blot
2.2 SAM结构域促进了促红细胞生成素产生肝细胞受体A2酪氨酸激酶结构域与脂质体的结合。
先前研究表明,EphA2的酪氨酸激酶基团有结合细胞膜的能力,其结合细胞膜后会影响其磷酸化活性[13]。而与激酶结构域相邻的SAM结构域也被发现可负向调节其激酶活性[16-18],但SAM结构域是否参与激酶结构域与细胞膜结合的过程仍不清楚。因此,本文表达纯化了不含SAM结构域的EphA2激酶结构域 (KD, Fig.1A),通过比较EphA2 KD/EphA2 CT与脂质体的结合,探索SAM结构域对激酶结构域结合细胞膜的影响。
利用牛的大脑提取物进行了脂质体的构建,通过脂质体结合实验,比较纯化的CT与KD两种蛋白质的脂质体结合能力。结果正如Fig.3所示,在4 mg/mL的脂质体浓度下,相比于激酶结构域本身,包含SAM结构域的EphA2CT与脂质体的结合能力增强了6倍(P<0.001),提示与激酶结构域相邻的SAM结构域促进了激酶结构域与脂质体的结合。

Fig.3 SAM domain of EphA2 enhances the lipid binding of kinase domain (A) Lipid binding results of 50 μmol/L EphA2 CT/KD and 4 mg/mL liposomes after the protein-lipid mixture was centrifuged for 40 min in 436 000 g. The P (precipitation) represents the proteins that bind to liposome, and the S (supernatant) represents the proteins that do not bind to liposome. (B) Quantification results of lipid binding assay (one-way ANOVA, *** P<0.001)
2.3 脂质体结合能力与磷酸化能力相互促进
由于EphA2受体作为酪氨酸激酶受体具有自磷酸化的能力,我们探讨了磷酸化前后的EphA2 CT蛋白质与脂质体的结合能力。结果显示:在2 mg/mL的脂质体浓度下,与未磷酸化的EphA2 CT相比,磷酸化后的EphA2 CT与脂质体结合能力更强 (约增强2.5倍,P<0.05)(Fig.4A-C)。同时,我们也好奇:与脂质体结合对EphA2 CT的激酶活性是否产生影响?通过检测EphA2 CT与脂质体结合前后其自磷酸化能力的变化,我们发现:与脂质体结合后,EphA2CT的磷酸化能力得到了也明显增强(Fig.4D)。
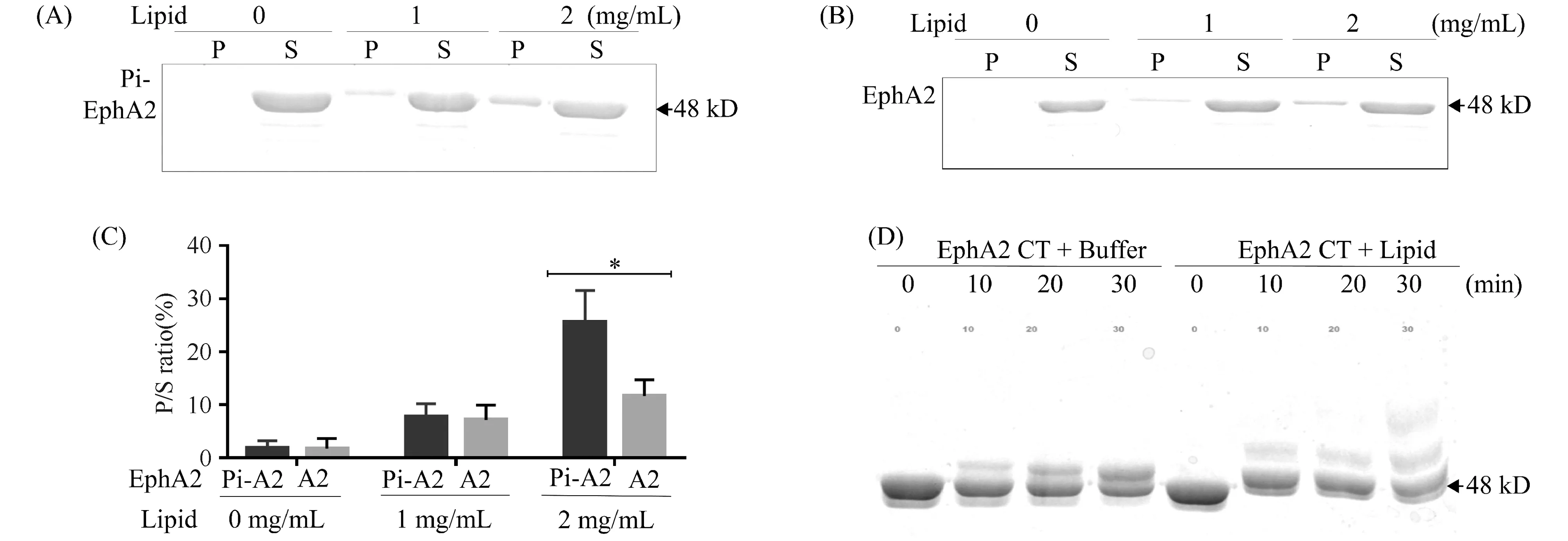
Fig.4 The positive feedback loop between the lipid binding and tyrosine phosphorylation (A, B) Lipid binding results of 50 μmol/L phosphorylated (Pi-CT) or dephosphorylated EphA2 CT (CT) after the protein-lipid mixture was centrifuged for 40 min in 436 000 g. The P (precipitation) represents the proteins that bind to liposome, and the S (supernatant) represents the proteins that do not bind to liposome. (C) Quantification results of lipid binding assay was performed by one-way ANOVA, * P<0.05, compared with the A2 group. (D) The results of phos-tag SDS-PAGE (12%) gel that showing the time-dependent phosphorylation differences between free and lipid-bound (2 mg/mL) EphA2 CT. The EphA2 (50 μmol/L) was auto-phosphorylated in the 200GB (50 mmol/L Tris-HCl, pH 7.5, 200 mmol/L NaCl, 1 mmol/L DTT, 5 mmol/L MgCl2) containing 2 mmol/L ATP in 37 ℃ water bath for 30 min. The migrated band shifts indicate the auto-phosphorylation levels of EphA2 CT
综合以上结果,我们发现:EphA2 SAM结构域的存在增强了EphA2激酶结构域与脂质体的相互作用。其次,磷酸化后的EphA2 CT与脂质体的结合能力得到了增强;同时,在结合脂质体后,EphA2 CT的激酶活性也进一步增强,从而形成了一个脂质体结合能力与激酶活性相互促进的正反馈现象。
3 讨论
Eph受体是单次跨膜的受体酪氨酸激酶,在细胞的形态、黏附、运动、增值、生存、分化等生理过程中发挥了重要作用,探索其活性调控机制对研究Eph受体介导的信号传导具有重要的意义。在此项研究中,通过与磷酸酶PTP1B共表达的方式,我们得到了稳定、接近于无磷酸化的均一性高的EphA2蛋白质片段,这一探索为其它需要进行重组表达纯化的激酶研究提供了很好的借鉴。
脂质体结合实验的结果表明,EphA2受体SAM结构域增强了其相邻的激酶结构域与脂质体的结合。结合之前EphA2 SAM结构域抑制激酶结构域活性的研究结果[16, 17],提示EphA2胞内段的SAM结构域可能与激酶结构域共同形成了一个完整的功能结构单位,即超结构域 (supramodule)。在后续研究中,通过解析EphA2胞内段激酶-SAM串联结构域的晶体结构并揭示激酶与SAM结构域之间的相互作用面的关键氨基酸位点,将能够很好地解释这两个结构域之间互相协调的分子机制。
此外,我们还发现了EphA2 CT与脂质体结合对其酶活的正反馈现象。猜想这种正反馈可能的作用机制是:通过与细胞膜的结合,提高了EphA2受体胞内段激酶-SAM串联结构域 (EphA2 CT) 在细胞膜上相互碰撞和聚集的机会,从而促进了其自身磷酸化。考虑到EphA2是单次跨膜的蛋白质,其激酶结构域和SAM结构域都与细胞膜非常接近,因此其“激酶结构域的自磷酸化”与“膜脂结合”这两种能力的相互促进。提示EphA2受体在被配体激活时可能通过与细胞膜结合的方式进一步放大自磷酸化的信号。在接下来的研究中,可通过调节EphA2与磷脂膜的相互作用来调控激其酶活,从而实现对下游信号的调节。最后,对于Eph受体家族的其他亚型,目前仍不清楚它们是否也存在与EphA2类似的活性调节机制。因此,在我们的研究基础上,进一步研究Eph受体家族中其他亚型的胞内段活性调控机制也将是一个有益的研究方向。
