调节性T细胞在干眼中的免疫调控作用相关研究
2022-09-07王慧凤综述阮庆国谢立信审校
王慧凤 综述 阮庆国 谢立信 审校
1山东第一医科大学附属眼科研究所 山东第一医科大学附属青岛眼科医院,青岛 266071;2山东第一医科大学附属眼科研究所 山东省眼科学重点实验室-省部共建国家重点实验室培育基地,青岛 266071
干眼是以泪膜稳态失衡为主要特征并伴有眼部不适症状的多因素眼表疾病,泪膜不稳定、泪液渗透性升高、眼表炎症与损伤及神经感觉异常是其主要的病理机制[1]。近年来研究表明,免疫介导的炎症反应在干眼的病理过程中发挥重要作用[2],泪液渗透压升高或泪膜不稳定会引起眼表炎症反应[3],并伴有致病性的CD4+T细胞浸润,尤其是辅助性T细胞17(T helper cell 17,Th17)和Th1,从而破坏免疫稳态造成泪腺功能单位受损。调节性T细胞(regulatory T cell,Treg)能够通过抑制效应性T细胞的功能,维持免疫稳态[4],其通过多种机制发挥免疫负调控作用来抑制干眼的炎症反应,从而在干眼的发生和发展及治疗中发挥重要作用。本文就Treg与干眼的相关性及其在干眼发病机制、治疗等方面中的相关研究进行综述。
1 Treg概述
Treg作为免疫稳态的调节细胞,在维持免疫耐受和控制免疫反应中发挥重要作用。根据Treg来源可分为胸腺来源的Treg(thymus Treg,tTreg)、外周体内诱导的Treg(peripheral Treg,pTreg)和体外诱导的Treg(induced Treg,iTreg)。叉头蛋白3(forkhead box protein 3,Foxp3)是调控Treg功能和发育的关键转录因子,对Treg发挥免疫抑制功能有不可或缺的作用。目前通常用Foxp3作为确定Treg存在的标记蛋白,除此之外还可采用CD25、白细胞介素-10(interleukin-10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)、细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)等。Treg可通过5种不同的机制来调控免疫应答:(1)利用细胞表面分子如CTLA-4、IL-2受体发挥免疫抑制作用;(2)分泌IL-10、TGF-β等抑制效应性T细胞(T effector cell,Teff)的生物学功能;(3)释放穿孔素或颗粒酶等细胞毒性分子促进Teff凋亡[5];(4)裂解胞外ATP等物质产生腺苷,促进Teff的胞内cAMP升高,进而干扰其代谢、增生与生物学功能[6];(5)诱导耐受性树突状细胞(dendritic cell,DC)或抑制抗原提呈细胞(antigen present cell,APC)的成熟等发挥免疫抑制作用[7]。
研究表明,Treg具有可塑性和不稳定性。正常情况下,部分Foxp3+T细胞会出现Foxp3失表达的情况,此时细胞不再具有免疫抑制功能却表现出记忆细胞或效应细胞的表型和特征,或者是转变为Th17细胞,进而促进疾病的发展[8]。当其处于淋巴细胞增生或Th1、Th17细胞极化的状态下,该转化过程会更明显[9]。具有免疫抑制功能的Foxp3+Treg向促炎性Th17细胞的转化被认为是导致自身免疫性疾病发生的关键因素[10]。
2 Treg与干眼
2.1 Treg与干眼的相关性
Treg与多种自身免疫性疾病相关,如自身免疫性脑脊髓炎、多发性硬化、类风湿性关节炎等,此外与干眼的发生和发展也有密切的关系[11]。研究表明,采用干燥应力环境诱导小鼠发生干眼,并将该小鼠中的CD4+T细胞过继转移至免疫缺陷的裸鼠,裸鼠则会出现干眼症状,而当过继转移至正常小鼠时则不会出现干眼症状;如果将上述正常受体小鼠体内的CD4+CD25+Foxp3+Treg抑制后,小鼠会出现干眼症状,若补充CD4+CD25+Foxp3+Treg,则可抑制干眼的发生[12]。由此说明,CD4+CD25+Foxp3+Treg具有抑制干眼发生的作用。
研究发现,干眼中Treg的功能和数量存在异常。Chauhan等[2]对干眼小鼠与非干眼小鼠中Treg进行比较,发现干眼小鼠中Treg抑制T细胞增生、活化能力减弱,而Treg数量未见明显变化;同样在原发性干燥综合征(Sjögren syndrome,SS)患者中CD4+CD25high细胞的百分比也没有明显改变[13],但是该研究中对患者的临床特征及细胞功能未作描述。然而Li等[14]发现干眼患者眼表组织中Treg数量减少;在SS中,研究者同样发现患者外周血中常规CD25highTreg细胞数量降低[15]。此外Alunno等[16]发现,在SS患者中虽然常规的CD4+CD25highTreg减少,但是CD4+CD25lowGITR+细胞在外周血中扩增,并且通过表型分析,该类型的细胞显示Treg的标志物对效应T细胞具有抑制作用。因此在T细胞活化的特定条件下,CD25并不是鉴定Treg很好的标志物,非Treg也可以表达CD25,所以这可能是导致上述结果存在差异的原因。
Treg与干眼患者的年龄、性别等危险因素存在一定关系。干眼发病率会随着年龄的增长而增加,在50岁以上人群中,干眼患病率为11.3%,而80岁以上人群发病率可接近20%[17]。研究表明,Treg功能受损是导致该现象出现的主要原因[18]。与老年干眼患者相比,年轻人的眼表中驻留大量的Treg,可以抑制Th1/Th17介导的炎症反应,从而有助于维持眼表稳态[19]。在老年小鼠中,Treg能够抑制产生干扰素-γ(interferon-γ,IFN-γ)的CD4+T细胞,但是抑制产生IL-17的CD4+T细胞功能受损[20]。此外随着年龄增长,CD4+CD25+Foxp3+Treg可转变成能产生IL-17的效应细胞[21-22]。Coursey等[23]应用NOD.B10.H2b小鼠进行相关研究发现,随着小鼠年龄的增长,在颈部淋巴结、泪腺中观察到Treg的百分比增加,但是这些细胞丧失了免疫抑制功能,虽然仍表达Foxp3,但是却分泌促炎因子IL-17和IFN-γ。在Treg过继转移实验中证实了来自老年个体的Treg可以导致干眼,而来自年轻的Treg没有出现,由此证明产生促炎因子的Treg具有致病性[23]。因此Treg的可塑性可能是导致干眼发病率随年龄增长而增加的重要因素之一。
在干眼患者性别分析研究中发现,基于女性健康研究的标准,女性干眼患病率高于男性[24-25]。通过对干燥应力环境诱导的干眼小鼠模型研究发现,在雌性小鼠淋巴结中Treg数量少于雄性小鼠,且干眼症状更严重[26]。进一步研究发现,在雌性干眼小鼠引流淋巴结中,多形核中性粒细胞和脂氧素A4(lipoxin A4,LXA4)形成显著减少,并且这2种物质处于功能抑制状态,这会导致淋巴结中Treg减少,而效应T细胞增加,进而导致雌性小鼠干眼更严重。当给予LXA4时,Foxp3+Treg数量会恢复,从而显著抑制Th1细胞、部分抑制Th17细胞的促炎作用,减轻干眼体征。
2.2 Treg调控干眼的发病机制
干眼作为一种多因素导致眼表紊乱的慢性疾病,虽然其发病机制尚未完全阐明,但免疫介导的炎症反应在干眼的发生和发展中发挥了重要作用[27]。Treg作为一类免疫负调控细胞,可参与调控干眼的炎症反应。
虽然Treg可通过多种机制抑制炎症反应,但根据研究发现其主要是通过以下2种机制在干眼中发挥作用(图1):(1)Treg直接分泌免疫抑制因子TGF-β、IL-10来抑制效应T细胞[12]。(2)通过作用于APC间接发挥抑制效应T细胞的作用。当环境或微生物的应激反应导致眼表的微环境受到破坏,细胞因子、基质金属蛋白酶、趋化因子等会随之产生,促进APC的成熟并向引流淋巴结迁移。迁移到引流淋巴结的APC能够激活naïve T细胞使其成为效应T细胞,随后该细胞获得趋化因子受体(如CCR5、CXCR3)并迁移至眼表引起炎症反应[28]。正常情况下,Treg能够调控该过程。tTreg离开胸腺时,趋化因子受体CCR7、CD62L表达上调,促使其向次级淋巴结迁移,Treg可与携带抗原的DCs产生相互作用从而阻滞效应T细胞的激活[29];此外,Treg可通过下调共刺激分子CD80和CD86的表达降低DCs激活效应T细胞的能力;还可以通过诱导DCs产生促凋亡分子促进T细胞凋亡[29-30]。
Treg介导的黏膜免疫耐受在预防干眼发病的过程中发挥重要作用,而当膜免疫耐受被打破时,则会导致核转录因子(nuclear factor,NF)-κB信号激活并引起免疫炎症反应[31]。激活的NF-κB信号会引起Treg活性降低,而Th1细胞和Th17细胞活性增强(图1)。Treg活性降低导致其对干眼的炎症抑制作用减弱,Th1和Th17的活性增强则会加重干眼的发生和发展,Th1可通过产生IFN-γ导致结膜鳞状化生和诱导结膜细胞凋亡,同时也会损害结膜中的杯状细胞;Th17通过分泌IL-17诱导基质金属蛋白酶-3和基质金属蛋白酶-9的产生,导致角膜上皮屏障破坏[32]。当局部应用NF-κB抑制剂时可降低眼部角膜上皮损伤和IL-1β、IL-6水平,研究表明该作用是由增强的Treg免疫应答所介导[31]。
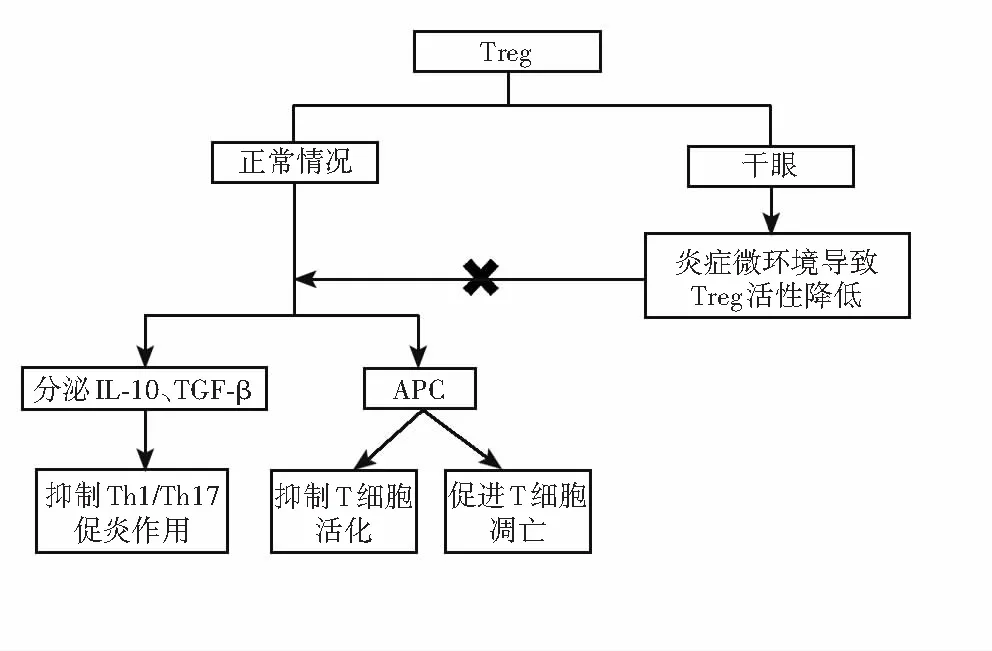
图1 Treg调控干眼的发病机制 Treg:调节性T细胞;IL:白细胞介素;TGF:转化生长因子;APC:抗原提呈细胞;Th:辅助性T细胞
3 Treg在干眼治疗中的应用
通过对干眼病理过程、影响因素、临床症状等多方面的深入研究,干眼的治疗手段也在不断完善和发展,但目前临床应用标准不一,疗效也存在一定差距[33-34]。因此基于Treg在干眼中的作用,靶向Treg将为干眼的治疗带来新的希望。
3.1 增加Treg数量
研究者提出可以通过从外周血中获取Treg,然后进行体外扩增并过继转移至患者体内,增加循环系统中Treg的数量,从而减轻或消除炎症反应导致的损伤[35]。Siemasko等[12]证明了通过体外扩增Treg并注入干眼小鼠体内的方式,可达到抑制眼表炎症反应的目的。虽然这种过继转移方式效率高,不良反应小,具有很好的潜力,但是应用到临床中还存在一定的问题,例如如何在体外扩增足量的Treg是一个具有挑战性的问题,而且需要标准化的扩增过程且确保细胞没有受到污染;同时,Treg的可塑性可导致其分化为效应T细胞,这也是需要解决的问题。此外,可以通过招募体内Treg的方式来达到治疗干眼的效果[36]。该方法是基于生物可降解聚合物制成的缓释系统技术,可以维持趋化因子CCL22的梯度,有效地将Treg招募至缓释系统的植入点,从而缓解干眼体征,如增加杯状细胞密度、促进角膜上皮完整性、增加泪液生成量。
3.2 促进Treg分化
Ratay等[37]研究发现,应用可降解聚合物微球(TRI microspheres)局部缓释系统可以促进Treg的分化以减轻干眼症状,该微球是由TGF-β1、雷帕霉素、IL-2组成的。雷帕霉素是一种mTOR抑制剂,可以抑制效应T细胞的产生和增生,而且既往研究证明,使用可降解微球维持TGF-β、雷帕霉素和IL-2的浓度能够增加在体外诱导naïve CD4+T细胞向Foxp3+Treg分化的效率[38]。在应用该微球治疗干眼的过程中可以观察到,泪腺中Foxp3+Treg的比例增加,IFN-γ、IL-6、IL-2等炎性因子表达降低,干眼相关症状减轻。因此,该研究通过利用Treg来恢复眼部的局部免疫稳态为干眼的抗炎治疗提供了一种潜在策略。
此外,还可通过局部应用瑞巴派特促进Treg的分化来治疗干眼。瑞巴派特因具有抗炎、抗氧化和促进胃粘膜分泌的作用被广泛应用于胃炎和胃溃疡的治疗。近年来研究发现,该药也可用于干眼的治疗。Fu等[39]将2%的瑞巴派特滴眼液用于干眼小鼠,每日4次,持续2周,结果显示该药可以恢复干眼引起的结膜和泪腺组织病理学的变化,延长干眼小鼠的泪膜破裂时间及增加泪液产生,并且应用该药治疗的小鼠泪腺及角膜组织中炎性因子IL-1β、IL-6、TNF-α、IL-17及IL-23含量减少,这是通过促进Treg分化并抑制Th17细胞分化,从而调节Th17细胞与Treg的平衡来抑制干眼的炎症反应。
综上所述,Treg可通过发挥免疫负调控作用减轻干眼的炎症反应从而在其发生和发展中发挥重要作用。通过靶向Treg来治疗干眼具有良好的临床应用前景。但是由于Treg在体内的数量较少,而体外扩增却面临着细胞稳定性、可塑性、纯度等多方面的问题,所以在治疗方面的应用仍要开展进一步的研究。此外,虽然目前对于Treg在干眼中维持免疫稳态及调控方面有较多的研究,但是对于干眼患者眼表的炎症微环境通过何种分子机制调控Treg功能的研究还相对欠缺,因此通过对此方面深入研究,可以加深与拓展对干眼等眼科相关免疫炎症性疾病病理机制的认识和理解,从而为疾病的临床诊疗提供新的思路。
利益冲突所有作者均声明不存在利益冲突
