非小细胞肺癌中miR-320a 靶向PD-L1 对肿瘤免疫调节的影响
2022-09-06章伟慧杨开勇
章伟慧,杨开勇
(1.江苏民政康复医院检验科,江苏 南京 210000;2.南京中医药大学医学院 整合医学学院,江苏 南京 210023)
中晚期非小细胞肺癌(NSCLC)患者中,表皮生长因子受体(EGFR)突变可有效提高患者对免疫治疗的应答率,使患者从中受益[1-2]。 在肺癌中,EGFR 突变可诱导细胞程序性死亡-配体1 (PDL1)上调[2]。 PD-L1 是一种免疫检查点蛋白,在多种肿瘤细胞,包括NSCLC 表面上呈高表达,与T 细胞膜上受体PD-1 结合,抑制T 细胞的功能,诱使T 细胞耗竭[3]。 有多种分子机制参与PD-L1 的调控, 其中转录后调节扮演重要的角色。 MicroRNA(miRNA) 是一类由内源基因编码的长度为18-25个核苷酸的非编码单链RNA 分子,主要参与转录后基因表达调控[4]。 MicroRNA-320a(miR-320a)在多种恶性肿瘤中均异常低表达,包括结直肠癌、乳腺癌和肺癌等[5-6]。此外,miR-320a 具有调节细胞增殖、凋亡、侵袭等多种生物学功能[5-6]。 例如,miR-320a 可抑制肺腺癌细胞的增殖[6]。 然而,关于miR-320a 调节PD-L1 的表达以及免疫抑制尚无研究报道。 因此,研究miR-320a 靶向PD-L1 介导肿瘤免疫抑制及其分子机制, 为EGFR 突变的肺癌患者接受免疫治疗提供参考依据。
1 材料与方法
1.1 材料 非小细胞肺癌细胞株H460、A549、HCC827 和H1975 均来自于中科院上海细胞库;RPMI1640、DMEM 培养基和胰蛋白酶均购自美国Gibco 公司; 胎牛血清购自上海依科赛公司;miR-320a 茎环结构特异性逆转录试剂盒、NC mimics 和miR-320a mimics 均购自广州市锐博公司;双荧光素酶报告基因检测试剂盒购于美国Promega 公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购于上海翊圣公司; 人外周血淋巴细胞分离液购于天津市灏洋公司; 所有的引物和Trizol 总RNA 抽提试剂盒购自上海生工; 鼠抗PD-L1 单克隆抗体购自武汉三鹰生物技术有限公司;鼠抗GAPDH 单克隆抗体和HRP 标记山羊抗兔或鼠IgG 二抗以及山羊抗鼠IgG H&L (Alexa Fluor594)红色荧光二抗购自美国Abcam 公司。
1.2 细胞培养 将H460、HCC827、H1975 和A549 细胞用含10%胎牛血清、100 U/mL 青霉素、100 g/mL链霉素的RPMI1640 和DMEM 培养基培养, 置于含5% CO2的37 ℃培养箱中, 取对数生长期细胞进行实验。
1.3 共培养体系的建立 收集健康捐赠的外周血,分离出外周血单个核细胞(PBMCs),再给予5 μg/mL的植物血凝素(PHA)刺激活化后,在Transwell 中与已转染miR-320a mimics 的H1975 细胞进行共培养,48 h 后进行后续实验。
1.4 MTT 法检测细胞存活率 参照1.3 材料与方法,待共培养结束后,在铺有H1975 细胞下层培养板每孔中加入MTT(终浓度为0.5 mg/mL),37 ℃反应2 h,吸去上清后每孔加入100 L 二甲基亚砜,振荡5 min, 置酶标仪上于570 nm 处测定各孔吸光度值。
1.5 RT-PCR 和Real-time quantitative PCR 检 测miR-320a 和PD-L1 的表达 收集细胞后, 按照Trizol 试剂说明书,提取总RNA。 使用PrimeScript RT Master Mix 试剂盒将RNA 反转录合成第一链cDNA。 RT-PCR:依据2×TSINGKE Mix 说明书操作。 PD-L1 正 向 引 物: TACTGTCACGGTTCCCAAGG;PD-L1 反 向 引 物: GGAGAGCTGGTCCTTCAACA。GAPDH 作内参对照。GAPDH 正向引物: CCAGAACATCATCCCTGCCT;GAPDH 反向引物: - CCTGCTTCACCACCTTCTTG。
Real-time quantitative PCR: 参照2× SYBR green PCR mixture 的使用说明书进行操作。 miR-320a 正向引物: AAAAGCTGGGTTGAGAGG,miR-320a 反向引物: AACATGTACAGTCCATGGATG;U6 作内参对照。 U6 正向引物: CGCTTCGGCAGCACATATAC; 反 向 引 物 : TTCACGAATTTGCGTGTCAT。 PD-L1 (qRT-PCR) 正向GTGCCGACTACAAGCGAATT;PD-L1 (qRT-PCR)反向引物: CTTGGAATTGGTGGTGGTGG。
1.6 双荧光素酶报告基因实验检测PD-L1 3’UTR的荧光素酶活性 运用生物信息学网站TargetScan(http://www.targetscan.org/vert_72/) 分析miR-320a与PD-L1 3’UTR 的结合位点序列, 构建pGL3-PD-L1-wild type 和pGL3-PD-L1-mutant 的质粒。按照双荧光素酶报告基因检测试剂盒说明书进行操作,通过Promega GloMax 20/20 发光检测仪检测荧光强度,随后记录并分析数据。
1.7 Western blot 检测细胞内PD-L1 的表达 将20 g 蛋白进行SDS-PAGE 电泳、转膜并封闭后,加入抗PD-L1 和GAPDH 抗体于4 ℃反应过夜。 洗涤后,将膜和相应二抗在室温下反应1 h,以ECL显色后并以全自动化学发光成像分析系统进行扫描,以ImageJ 软件分析各条带灰度值。
1.8 Flow cytometry 检测细胞膜上PD-L1 的表达收集细胞,用冰甲醇固定10 min 后,加入2BSA 封闭30 min,再加入抗PD-L1 抗体于4 ℃反应过夜。洗涤后, 用相应的红色荧光二抗在室温下孵育1 h,上流式细胞仪待测,以FlowJo VX10 软件分析平均荧光强度值。
1.9 AnnexinV-FITC/PI 双染法检测细胞凋亡用binding buffer 清洗细胞, 用含有AnnexinV-FITC的binding buffer 重悬细胞,冰上暗处孵育15 min,再加PI 孵育5 min,通过流式细胞仪检测细胞凋亡率。
2 结果
2.1 miR-320a 和PD-L1 在HCC827 和H1975 细胞中的表达qRT-PCR 结果表明,与EGFR 野生型的H460 和A549 细胞相比,EGFR 突变型的HCC827 和H1975 细胞中的miR-320a 的水平呈相对低表达,见图1A。 western blot 和RT-PCR 结果显示, 与EGFR 野生型的H460 和A549 细胞相比,EGFR 突变型的HCC827 和H1975 细胞中的PD-L1 的mRNA 水平和蛋白水平均呈相对高表达,见图1B—1C。
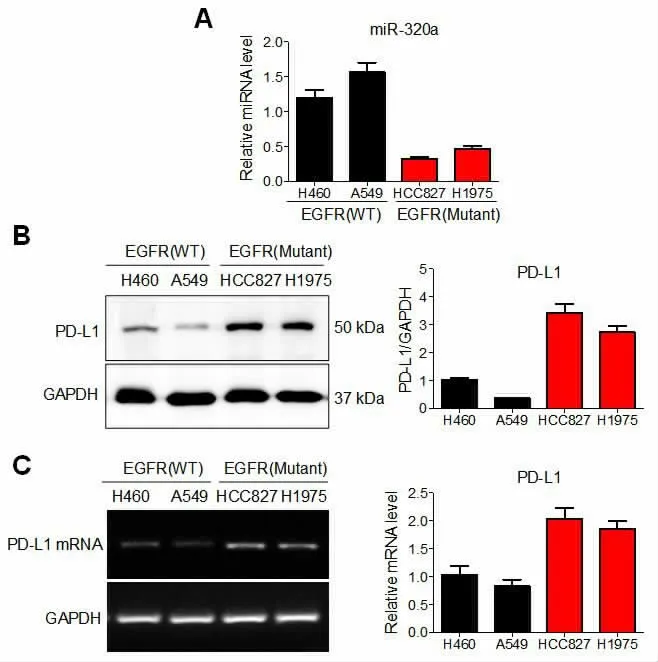
图1 miR-320a 和PD-L1 在多种NSCLCs 细胞株中的表达
2.2 miR-320a 过表达后对HCC827 和H1975 细胞中PD-L1 表达的影响 qRT-PCR 结果表明,与NC mimics 相比,miR-320a mimics 明显使HCC827 和H1975 细胞中PD-L1 mRNA 水平下调(图2A—图2B)。 此外,western blot 和flow cytometry 实验结果也 表 明,miR-320a mimics 可 抑 制HCC827 和H1975 细胞中PD-L1 蛋白表达(图2C—图2D)。
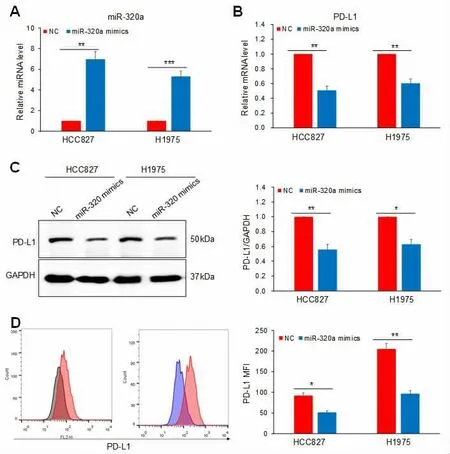
图2 miR-320a mimics 对HCC827和H1975 细胞中PD-L1 表达的影响
2.3 miR-320a 与PD-L1 3’UTR 结合可缩短PDL1 mRNA 的半衰期 应用TargetScan 预测并找出含有miR-320a 结合位点的PD-L1 3’UTR 区序列为CAGCUUU (图3A—图3B)。 双荧光素酶报告基因结果表明,miR-320a mimics 明显抑制野生型PD-L1 3’UTR 的活性,而对突变型PD-L1 3’UTR的活性无明显影响,见图3C。 此外,半衰期结果表明,miR-320a 与PD-L1 3’UTR 结 合 可 缩 短PDL1 mRNA 的半衰期,见图3D。
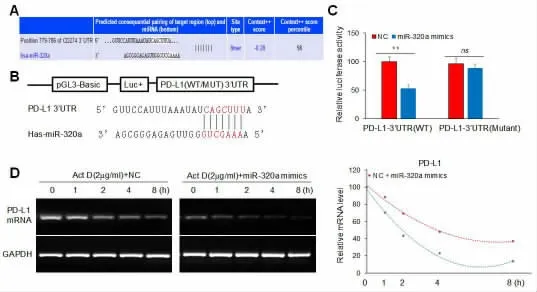
图3 miR-320a 与PD-L1 3’UTR结合可缩短PD-L1 mRNA 的半衰期
2.4 miR-320a mimics 可抑制T 细胞的凋亡和降低H1975 细胞的存活率AnnexinV-FITC/ PI 双染法结果表明,在活化的PBMCs 和H1975 细胞的共培养体系中,miR-320a mimics 可明显抑制T 细胞的凋亡,见图4A、4B—图4C。 MTT 实验结果显示,miR-320a mimics 可显著降低H1975 细胞的存活率。

图4 miR-320a mimics 可抑制T 细胞的凋亡和降低H1975 细胞的存活率
3 讨论
本实验结果显示,miR-320a mimics 可抑制T细胞的凋亡和降低H1975 细胞的存活率, 提示miR-320a 可削弱肿瘤免疫抑制。此外,在EGFR 突变的HCC827 和H1975 细胞中,miR-320a 可抑制PD-L1 的表达, 其分子机制可能是miR-320a 与PD-L1 3’UTR 结合,从而缩短PD-L1 mRNA 半衰期导致的,见图5。
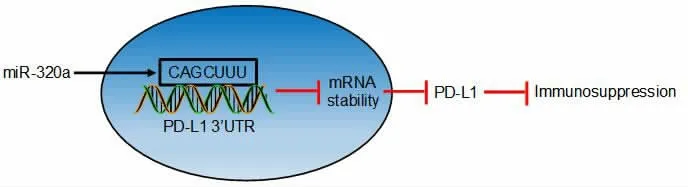
图5 miR-320a 调节PD-L1 表达的作用示意图
NSCLC 患者接受免疫治疗后可有效提升患者的治疗效果,延长患者的生存率[1-2]。 由于大多数患者的肺癌组织中PD-L1 呈低表达, 不易被活化的T 淋巴细胞所识别杀伤, 从而影响免疫治疗的效果[1-2]。 因此,找出适合免疫治疗的标志物指标对指导肺癌患者使用免疫治疗具有重要的临床意义。基因突变负荷,包括EGFR 突变,可诱导PD-L1 高表达,从而使患者更好的受益于免疫治疗[7-8]。 然而临床上检测肺癌组织中PD-L1 的表达或者其它相关基因突变,由于组织获取较难且检测周期较长,不利于患者及时治疗, 故找出高效且易于检测的标志物指标显得尤为重要。 miRNAs 稳定存在于血液和其他体液中, 可以作为诸如肿瘤等各种疾病的生物标志物[9-11]。 例如,miR-141、miR-135b 和miR-92 等在前列腺癌患者的血清或者血浆中呈高表达[12-14]。 miR-320a 在胃癌、结肠癌和肺癌等患者的血浆中呈低表达[5-6]。 本研究也发现miR-320a 在EGFR 突变的HCC827 和H1975 细胞呈低表达(图1A)。 有 趣 的 是, 在EGFR 突 变 的HCC827 和H1975 细胞PD-L1 却呈高表达,见图1B—图1C,且miR-320a mimics 可抑制PD-L1 的表达, 见图2。上述结果提示,miR-320a 可负性调节PD-L1 的表达。
由于miRNAs 通过与靶基因mRNA 分子的3’UTR 互补配对,从而调控靶基因的表达[5],故推测miR-320a 调控PD-L1 表达可能发生在转录后水平。 为了验证该猜想, 首先借助生物信息学工具TargetScan 预测miR-320a 与PD-L1 3’UTR 的结合位点,见图3A,然后通过荧光素酶报告基因实验证实了miR-320a mimics 可抑制PD-L1 3’UTR 的报告基因活性,见图3C。此外,miR-320a mimics 可抑制PD-L1 mRNA 的半衰期, 促进PD-L1 的降解。 上述结果提示,miR-320a 抑制PD-L1 的表达,其分子机制可能是miR-320a 与PD-L1 3’UTR 结合,从而促进PD-L1 的降解发生的。
PD-L1 是大小为40kDa 的一型跨膜蛋白,与其受体PD-1 结合后传导抑制性的信号,抑制细胞毒T 淋巴细胞的毒性,发挥免疫抑制性功能[15-16]。本研究发现,在活化的PBMCs 与H1975 细胞共培养的体系中,miR-320a 可降低H1975 细胞的存活率以及抑制PBMCs 细胞凋亡。 这些结果提示,miR-320a 调节肿瘤细胞免疫抑制可能与PD-L1的表达有关。
综上所述,miR-320a 削弱肿瘤免疫抑制可能与下调PD-L1 的表达有关, 其分子机制至少部分是通过与PD-L1 3’UTR 结合,从而促进PD-L1 降解导致的。
