甲磺酸阿帕替尼联合FOLFOX化疗方案治疗晚期结直肠癌的临床疗效
2022-09-06周晓艳宋晓锋周利胜张会芳
周晓艳,宋晓锋,周利胜,张会芳
许昌市中心医院肛肠科,河南 许昌 461000
结直肠癌是临床常见的消化系统恶性肿瘤,诱发因素较多,包括遗传、环境、饮食因素等,多发于中年人群,且男性发病率高于女性[1]。调查显示,近年来中国居民饮食结构发生变化,导致结直肠癌的发病率逐年升高,且呈年轻化趋势[2-3]。结直肠癌早期病情隐匿,部分患者确诊时已发展至中晚期,手术切除后易复发或局部转移,影响预后。为进一步提高临床疗效,降低结直肠癌复发率,临床多辅以放化疗,FOLFOX化疗方案是在奥沙利铂的基础上联合亚叶酸钙及氟尿嘧啶,是目前公认的结直肠癌化疗方案[4]。研究显示,恶性肿瘤患者在使用奥沙利铂、氟尿嘧啶、伊立替康等化疗药物进展后,临床用药将陷入困境,一是无新药物可供选择,二是靶向抗肿瘤药物的价格昂贵,限制了其临床应用[5-6]。甲磺酸阿帕替尼是一种血管内皮细胞 生 长 因 子(vascular endothelial growth factor,VEGF)抑制剂,已被批准作为晚期胃癌或胃-食管结合部腺癌的三线及以上治疗药物[7]。研究显示,在晚期结直肠癌标准二线治疗失败后,应用甲磺酸阿帕替尼可进一步改善疗效,延长患者总生存时间[8]。本研究探讨甲磺酸阿帕替尼联合FOLFOX化疗方案治疗晚期结直肠癌的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
收集2015年1月至2017年1月许昌市中心医院收治的晚期结直肠癌患者的病历资料。纳入标准:①经病理检查确诊为晚期结直肠癌;②美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分≤1分;③年龄≥18岁;④存在1个及以上可测量病灶;⑤采取FOLFOX化疗方案或甲磺酸阿帕替尼联合FOLFOX化疗方案;⑥临床资料完整。排除标准:①化疗前3个月接受过抗肿瘤治疗;②肿瘤转移部位在脑部;③合并严重心血管疾病;④妊娠期或哺乳期女性。依据纳入和排除标准,本研究共纳入92例患者。根据治疗方案的不同将患者分为化疗组(n=40)和联合组(n=52),化疗组患者仅采取FOLFOX化疗方案治疗,联合组患者采取甲磺酸阿帕替尼联合FOLFOX化疗方案治疗。两组患者的性别、年龄、ECOG体力状况评分、肿瘤部位、肿瘤转移部位个数、FOLFOX化疗方案比较,差异均无统计学意义(P﹥0.05)(表1),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
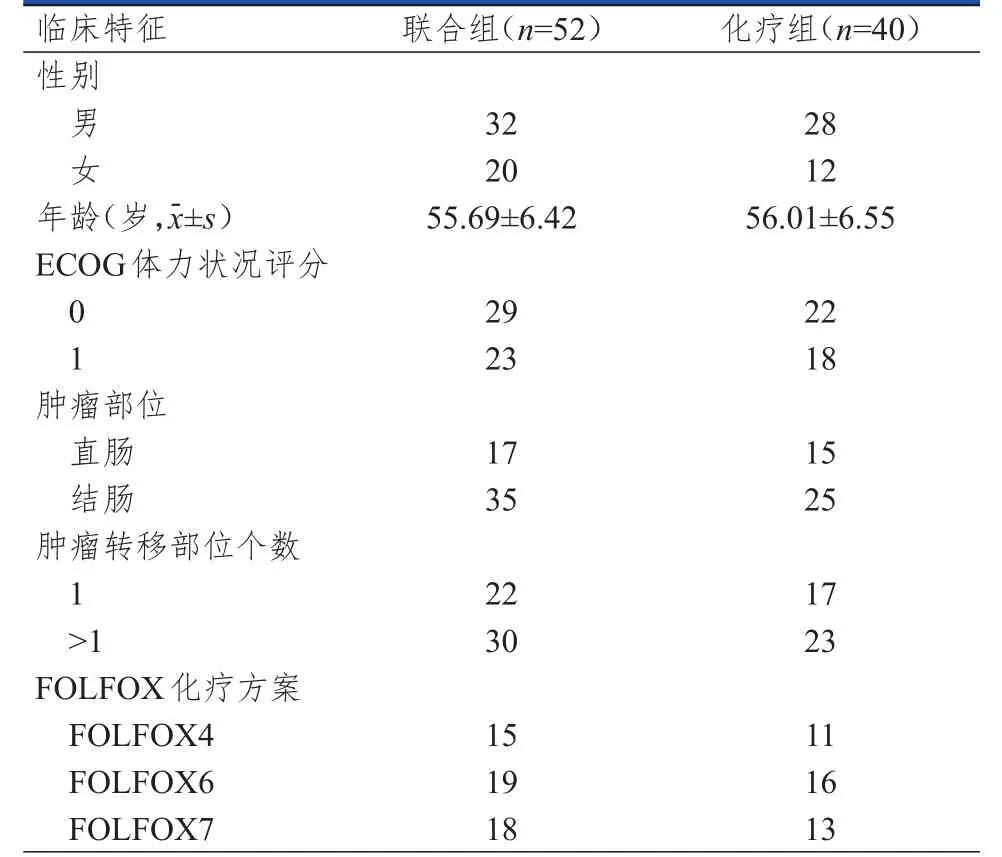
表1 两组患者的临床特征
1.2 治疗方法
化疗组患者仅采取FOLFOX化疗方案治疗。FOLFOX4方案:奥沙利铂85 mg/m2,静脉滴注2~3 h,第1天;亚叶酸钙200 mg/m2,静脉滴注2 h,第1~2天;5-氟尿嘧啶400 mg/m2,在亚叶酸钙后静脉滴注,第1~2天;5-氟尿嘧啶600 mg/m2,持续静脉滴注22 h。FOLFOX6方案:奥沙利铂85 mg/m2,静脉滴注2~3 h,第1天;亚叶酸钙200 mg/m2,静脉滴注2 h,第1天;5-氟尿嘧啶400 mg/m2,在亚叶酸钙后静脉滴注,第1天;5-氟尿嘧啶2400 mg/m2,持续静脉滴注46 h。FOLFOX7方案:奥沙利铂85 mg/m2,静脉滴注2~3 h,第1天;亚叶酸钙200 mg/m2,静脉滴注2 h,第1天;5-氟尿嘧啶2400 mg/m2,持续静脉滴注46 h。14天为1个化疗周期,共治疗12个周期。
联合组患者采取甲磺酸阿帕替尼联合FOLFOX化疗方案治疗,其中FOLFOX化疗方案与化疗组相同,另外口服甲磺酸阿帕替尼,每次500 mg,每天1次,连续治疗12周。
1.3 观察指标及评价标准
①采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[9]评价两组患者的近期疗效。完全缓解(complete response,CR),影像学资料显示肿瘤病灶消失且未发现新病灶,血清癌胚抗原(carcinoembryonic antigen,CEA)及糖类抗原 19-9(carbohydrate antigen 19-9,CA19-9)水平正常,持续4周及以上;部分缓解(partial response,PR),影像学资料显示肿瘤最大径之和减少≥30%,持续4周及以上;疾病稳定(stable disease,SD),影像学资料显示肿瘤最大径之和减少﹤30%或增加﹤20%;④疾病进展(progressive disease,PD),影像学资料显示肿瘤最大径之和增加20%及以上或出现新病灶。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。②比较治疗前、治疗后3个月两组患者的血清肿瘤标志物水平,包括CEA及CA19-9。③采取电话及门诊随访的形式对所有患者随访3年,比较两组患者的生存情况,包括总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)。④采用抗肿瘤药物常见不良反应评价标准[8]评价两组患者的不良反应,包括血液毒性和非血液毒性,分为Ⅰ~Ⅳ级。
1.4 统计学分析
采用SPSS 22.0软件对数据进行统计分析,符合正态分布且方差齐的计量资料以均数±标准差()表示,组内比较采用配对t检验,组间比较采用两独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较
联合组患者的ORR和DCR分别为65.38%(34/52)和90.38%(47/52),分别高于化疗组患者的40.00%(16/40)和75.00%(30/40),差异均有统计学意义(χ2=5.872、3.921,P=0.015、0.048)。(表2)
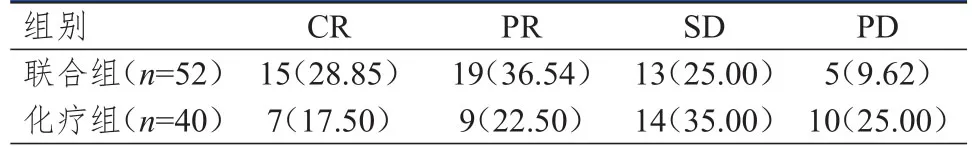
表2 两组患者的近期疗效[n(%)]*
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者的血清CEA、CA19-9水平比较,差异均无统计学意义(P﹥0.05)。治疗后,两组患者的血清CEA、CA19-9水平均明显低于本组治疗前,且联合组患者的血清CEA、CA19-9水平均明显低于化疗组,差异均有统计学意义(P﹤0.01)。(表3)

表3 治疗前后两组患者血清肿瘤标志物水平的比较
2.3 生存情况的比较
联合组患者的中位OS为27.48个月,长于化疗组患者的17.64个月,差异有统计学意义(χ2=4.443,P=0.035)。联合组患者的中位PFS为18.39个月,长于化疗组患者的11.14个月,差异有统计学意义(χ2=4.318,P=0.038)。(图1、图2)
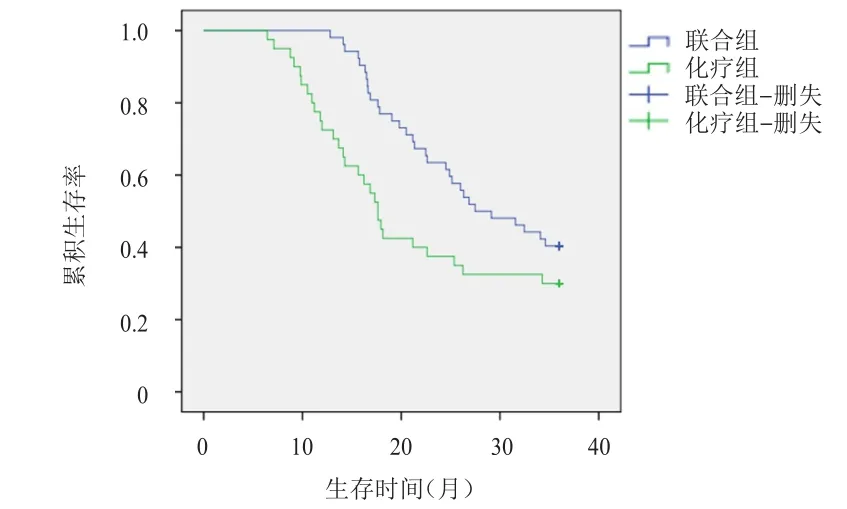
图1 联合组(n=52)和化疗组(n=40)晚期结直肠癌患者的OS曲线
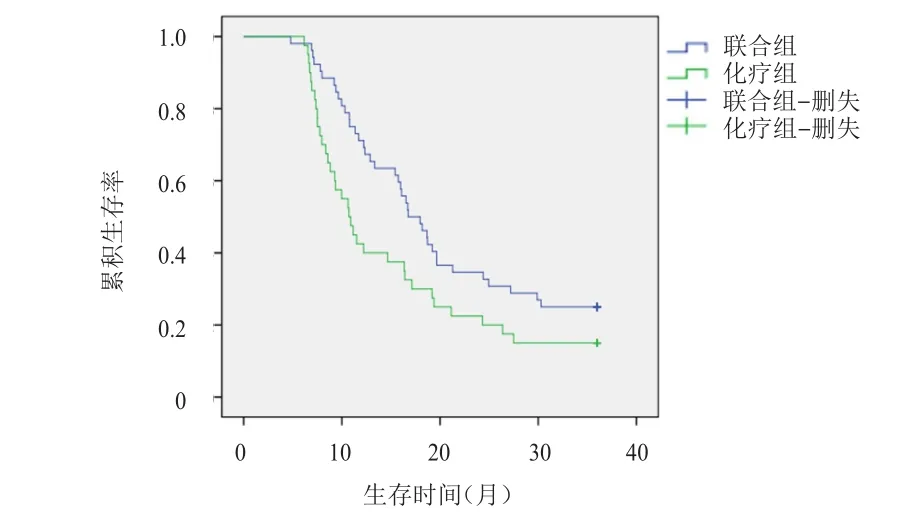
图2 联合组(n=52)和化疗组(n=40)晚期结直肠癌患者的PFS曲线
2.4 不良反应发生情况的比较
两组患者的血液毒性(白细胞减少、血小板减少、血红蛋白减少)和非血液毒性(消化道反应、高血压、手足综合征、肾功能异常、心律失常、脱发)发生率比较,差异均无统计学意义(P﹥0.05)。(表4)
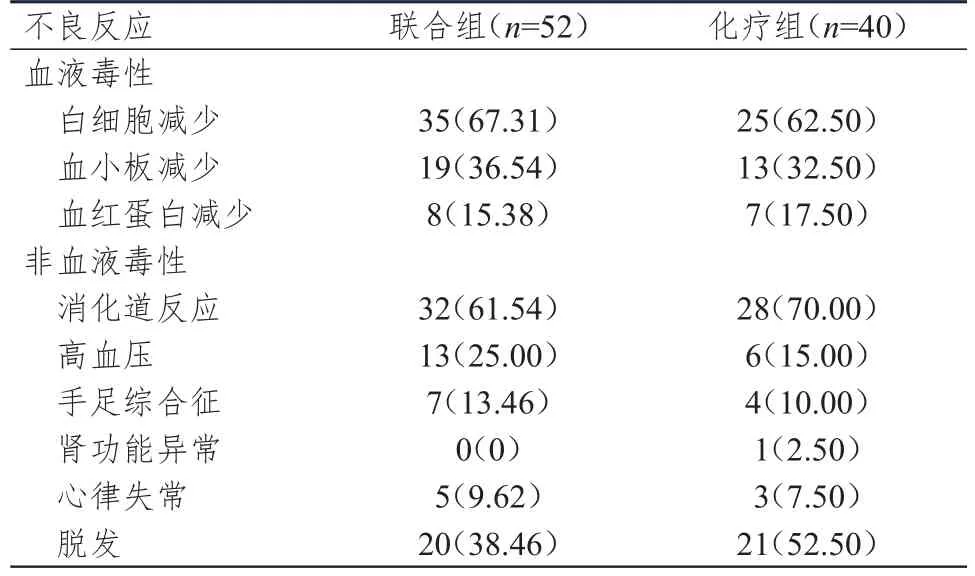
表4 两组患者的不良反应发生情况[n(%)]
3 讨论
对于晚期结直肠患者,通过化疗降低淋巴结转移率、降低肿瘤复发率、延长生存期是主要的临床治疗目标。FOLFOX化疗方案是临床中治疗结直肠癌的公认标准化疗方案,能够明显提高患者的生存率,减少胃肠道不适[10]。其中奥沙利铂属于第三代铂类化疗药物,作用机制与顺铂相同,通过抑制DNA合成发挥抗肿瘤活性,单独应用亦具有较好的疗效,而且患者心肝肾功能不全时不受影响[11]。5-氟尿嘧啶是抗代谢类化疗药物,能够抑制脱氧尿苷酸转化为脱氧胸苷酸,从而干扰DNA合成,发挥抗肿瘤作用[12]。亚叶酸钙可以增强5-氟尿嘧啶的抗肿瘤效果。研究显示,FOLFOX化疗方案可延长晚期肿瘤患者的生存时间,提高患者的生存率和生活质量,但对于复发或转移性晚期肿瘤患者,疗效一般[13-14]。另有研究发现,化疗联合表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂或VEGF抑制剂能够改善肿瘤微环境,是临床研究的热点[15]。甲磺酸阿帕替尼是中国自主研发的针对血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的一种小分子酪氨酸激酶抑制剂,已被批准作为三线及以上药物治疗晚期胃癌或胃-食管结合部腺癌[16]。
本研究结果显示,联合组患者的ORR和DCR分别为65.38%和90.38%,分别高于化疗组患者的40.00%和75.00%(P﹤0.05),说明甲磺酸阿帕替尼联合FOLFOX化疗方案能够提高晚期结直肠癌患者的近期疗效。FOLFOX化疗方案是晚期结直肠癌的常用化疗方案,有研究指出,以奥利沙铂为主的化疗能够在一定程度上抑制晚期结直肠癌生长,但效果有限,而阿帕替尼能够抑制VEGFR2的表达,从而有效抑制肿瘤侵袭,提高化疗疗效[17]。CEA和CA19-9是临床常见的血清肿瘤标志物,其在血清中的表达水平随病情进展而迅速增加,是结直肠癌早期筛查及预后评估的重要指标,为提高筛查和预后判断的准确率,一般采用几种肿瘤标志物联合检测的方式[18]。本研究结果显示,治疗后,联合组患者的血清CEA和CA19-9水平均明显低于化疗组(P﹤0.01),提示在化疗的基础上使用甲磺酸阿帕替尼可有效降低血清CEA和CA19-9水平,可能与甲磺酸阿帕替尼的抗肿瘤血管生成作用有关。生存曲线分析显示,联合组患者的中位OS和中位PFS均长于化疗组(P﹤0.05),表明甲磺酸阿帕替尼联合FOLFOX化疗方案可延长晚期结直肠癌患者的OS和PFS,改善患者预后,与既往研究结果一致[19-20]。甲磺酸阿帕替尼联合化疗可增强机体对化疗药物的敏感性,逆转个体化治疗的耐药性,延长患者生存时间。研究发现,甲磺酸阿帕替尼对结肠癌细胞HCT-116具有抑制增殖、促进凋亡的作用,而且作用强弱呈浓度依赖性,可能是因为甲磺酸阿帕替尼阻断了磷脂酰肌醇3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)信号通路,从而启动了细胞凋亡程序[21]。两组患者的血液毒性和非血液毒性发生率比较,差异均无统计学意义(P﹥0.05),提示甲磺酸阿帕替尼的联合使用不会增加化疗不良反应。李宁宁等[19]研究指出,结直肠癌患者服用甲磺酸阿帕替尼后可能会出现手足综合征、蛋白尿、高血压等症状,但在停药、减少剂量或对症治疗后,基本上都可减轻或恢复。
综上所述,对于晚期结直肠癌患者,推荐治疗方案为甲磺酸阿帕替尼联合FOLFOX化疗方案,该方案安全有效,能够延长患者的OS及PFS,且不会增加不良反应。但本研究纳入的样本量较少,结果需要大样本量的深入研究进一步证实。
