鱼油改善肠道菌群与宿主互作失调并维持缓解小鼠肠炎
2022-09-06冯政轩汪泓成樊子怡
方 剑, 王 惠, 冯政轩, 汪泓成, 樊子怡
(1)绍兴文理学院医学院, 浙江绍兴 312000;2)绍兴市人民医院肛肠外科, 浙江绍兴 312000;3)浙江中医药大学护理学院, 杭州 310000)
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性复发性炎症性肠病(inflammatory bowel disease, IBD),以持续缓解和复发为特征,目前在世界各地非常常见,特别是亚洲国家发病率快速上升[1]。临床上常使用抗炎或免疫制剂药物治疗UC,通常不能维持长期的临床缓解。大量研究显示,UC患病30年时肠癌患病率从患病20年的5%~10%跃升至12%~30%[1],而且UC患者肠癌发病年龄低(<20岁)、预后差,发现时多已是癌症晚期。但目前通常忽视维持缓解治疗的重要性,显著增加了结肠炎复发和结、直肠癌的发病风险[2]。为此,寻求能有效维持缓解治疗UC,对提高患者生活质量,预防肠癌具有重要意义。
n-3多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)主要来源于海产鱼类,是鱼油的主要成分,其成员主要包括二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)[3]。近年来,大量研究表明,n-3 PUFAs在控制UC发生[4]、发展中发挥积极作用[5],n-3 PUFAs干预有望成为UC辅助治疗措施[6]。目前,关于n-3 PUFAs与维持缓解治疗UC的效果尚无明确答案,影响了n-3 PUFAs的临床应用。本研究以葡聚糖硫酸钠(dextran sulfate sodium, DSS)构建急性期肠炎小鼠模型(诱导期)和慢性期肠炎小鼠模型(缓解期),比较鱼油对急慢性期肠炎小鼠的影响,并从结肠黏膜机械屏障和炎症通路活化,以及肠道菌群等角度深入挖掘鱼油对急慢性期肠炎小鼠的差异调控,为探索诱导缓解和维持缓解治疗UC提供科学依据。
1 材料与方法
1.1 动物
8周龄雄性野生型C57BL/6J小鼠60只上海斯莱克实验动物有限公司,饲养于绍兴文理学院附属第一医院实验动物中心SPF级实验室。温度(24±3)℃,相对湿度(50±5)%,噪声强度≤60 dB,每12 h明暗更替,小鼠自由摄水取食,隔日更换垫料和饮水瓶。动物饲养及使用符合绍兴文理学院附属第一医院动物伦理委员会的相关规定并获得允许。
1.2 材料
高纯度鱼油订购于上海互众药业有限公司,鱼油中总n-3 PUFAs含量为98.05%,其中DHA含量为47.25%,EPA含量为48.24%。分子量为36 000~50 000的DSS(美国MP Biomedicals公司);粪便饮血试剂盒(南京建成生物工程研究所);小鼠IL-6、IL-10、IL-1β和TNF-α ELISA试剂盒购于杭州联科生物技术股份有限公司;Claudin1、Oclaudin、ZO1、MCT1、GPR43、CPT1A、CPT2、CS、LDH和β-肌动蛋白抗体(英国Proteintech公司)。
1.3 动物模型建立和治疗方案
参考《Nature Protocols》的方法建立DSS诱导的小鼠结肠炎模型[7],具体操作如下:诱导缓解模型组小鼠接受2% DSS水自由饮水1周,换无菌水持续3 d;维持缓解模型组小鼠接受2% DSS水自由饮水1周,换无菌水持续2周,再自由饮用2% DSS水1周,最后换无菌水持续1周。治疗方案如下:将60只8周龄的C57BL/6J分为急性期空白对照组、诱导缓解模型组、诱导缓解鱼油组、慢性期空白对照组、维持缓解模型组和维持缓解鱼油组,每组10只。急性期肠炎小鼠:诱导缓解鱼油组小鼠给予4周鱼油灌胃(400 mg/kg·bw鱼油阿拉伯胶),其中急性期空白对照组和诱导缓解模型组小鼠给予10%阿拉伯胶灌胃。之后,除急性期空白对照组外,诱导缓解模型组和诱导缓解鱼油组小鼠接受2% DSS水自由饮水1周,换无菌水持续3 d。在急性建模期间,急性期空白对照组和诱导缓解模型组小鼠继续给予每天10%阿拉伯胶灌胃,诱导缓解鱼油组小鼠继续给予400 mg/kg·bw鱼油阿拉伯胶灌胃。慢性期肠炎小鼠:慢性期鱼油组小鼠给予4周鱼油灌胃(400 mg/kg·bw鱼油阿拉伯胶),其中慢性期空白对照组和维持缓解模型组小鼠给予10%阿拉伯胶灌胃。之后,除慢性期空白对照组外,维持缓解模型组和维持缓解鱼油组小鼠接受2% DSS水自由饮水1周,接着换无菌水持续2周;再自由饮用2% DSS水1周,最后换无菌水持续1周。在慢性建模期间,慢性期空白对照组和维持缓解模型组小鼠继续给予每天10%阿拉伯胶灌胃,维持缓解鱼油组小鼠继续给予400 mg/kg·bw鱼油阿拉伯胶灌胃,实验分组见Fig.1A所示。在造模期间每日记录小鼠体重,从小鼠体重下降、粪便性状及便血情况进行疾病活动指数计算。结束实验后,留取粪便、血清和结肠组织样本。
1.4 小鼠粪便、组织样本采集与处理
收集新鲜小鼠粪便50~100 mg(约2~3粒),置于无菌离心管,封口后于-80 ℃保存,用于粪便中短链脂肪酸及16 S rRNA扩增子检测。通过摘除眼球收集小鼠外周血到无菌离心管,经4 ℃,1 000 g离心15 min,获得的上清用于炎症指标分析。小鼠经颈椎脱臼后,行腹部消毒,解剖小鼠获得回盲部到肛门的完整结肠,测量结肠重量和长度。用预冷的生理盐水漂洗掉结肠中血液及污物,取一小段结肠入10%福尔马林溶液固定,用于H&E(haematoxylin eosin, H&E)染色;剩余部分装到无菌无酶EP管中后入液氮,最后保存在-80 ℃冰箱,用于结肠中脂肪酸含量和Western印迹检测。
1.5 气相色谱法检测小鼠粪便中短链脂肪酸及结肠中脂肪酸含量
称取约2 g小鼠粪便(每组10只),加10 mL无菌去离子水,漩涡振荡10 min,12 000 r/min离心30 min,取上清,经0.45 μm水系滤膜过滤2次,取500 μL过滤液待机检测,GC条件参考赵亚婷等人的报道[8]。将小鼠组织解冻,称取约50 mg于离心管,在液氮中充分碾磨,4 ℃过夜浸提。加0.9% NaCl 1 mL,分层后保留氯仿层,加1 mL正己烷和1 mL 14%三氟化硼/甲醇溶液,入金属浴90~110 ℃加热1 h。冷却后,加1 mL去离子水,2 000 r/min离心5 min,取上清,于30 ℃氮吹仪吹干,加200 μL正己烷,上机检测。
1.6 小鼠结肠组织H&E染色
对充分固定的结肠组织进行梯度脱水、透明、浸蜡、包埋、切片、展片、贴片、烤片、脱蜡复水、H&E染色、梯度脱水、透明和树胶封片,委托临床病理中心专家全盲阅片,并参考方剑等人发表的论文中小鼠结肠炎组织学评分标准进行评分[9]。
1.7 Western 印迹检测
称取100 mg结肠组织于液氮中,加组织裂解液200 μL,用组织匀浆机充分碾磨组织,漩涡振荡后,冰水浴30 min,4 ℃离心20 000 g 20 min,按照细胞核蛋白质中与细胞浆蛋白质抽提试剂盒说明书(碧云天生物技术有限公司)提取蛋白质。用Bio-Rad DC蛋白质分析试剂盒(Bio-Rad生物公司)测定蛋白质浓度。按《分子克隆实验指南(第四版)》中的方法,以5%浓缩胶和12%分离胶电泳。
1.8 肠道微生物16 S rRNA扩增子测序
将小鼠粪便样本(每组5只)委托南京集思慧远生物科技有限公司进行高通量16 S rRNA扩增子测序,用简并引物515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTRAGTTT-3′)对16 S rRNA基因的可变区V4~V5进行PCR扩增。对最终文库的扩增子于Illumina HiSeq 2500上机测序,获得fastq格式数据由本课题组进行下游分析。用VSEARCH中fastq_mergepairs seq对双端序列进行合并,然后用fastx_filter temp切除上下游引物,derep_fulllength temp对序列去冗余。之后用USEARCH的unoise3 temp去噪,VSEARCH中的uchime_ref temp进一步去嵌合,接着用USEARCH中的usearch_global temp命令基于UPARSE算法按97%相似度聚类为可操作分类单元(operational taxonomic unit, OTU)。最后基于SILVA数据库去除质体、非细菌和古菌,此外使用VSEARCH中的sinta命令进行物种注释(sintax_cutoff=0.6)。基于所获得的OTU表可在R 4.1.2环境下实现alpha多样性分析、beta多样性分析、PICRUSt功能预测及组间差异等分析。
1.9 统计学方法

2 结果
2.1 鱼油对维持缓解期肠炎小鼠的抗炎作用优于诱导缓解期肠炎小鼠
2.1.1 诱导缓解与维持缓解肠炎小鼠模型构建的确定 通过监测小鼠体重变化、疾病活动指数(disease activity index, DAI)和结肠长度与水肿程度结果见Fig.1,相比于空白对照组,急性期模型组小鼠在实验周期第5 d和第10 d DAI评分明显升高(P<0.01);慢性期模型组小鼠在实验周期第10 d、24 d和第32 d DAI评分显著升高(P<0.05)。急慢性小鼠模型组结肠充血、水肿均高于空白对照组。此外,实验周期结束时,对小鼠结肠组织进行H&E染色发现(Fig.2),相比于空白对照组,急慢性模型组小鼠组织病理学评分显著提高(P<0.01)。血清学检测结果同样证实急慢性模型组中促炎症因子IL-1β、TNF-α、IL-6显著高于空白对照组(P<0.01),抗炎因子IL-10的表达水平明显低于空白对照组(P<0.01)。可见,已成功构建诱导缓解与维持缓解肠炎小鼠模型。
2.1.2 鱼油对急慢性期肠炎小鼠结肠组织脂肪酸构成存在差异 取各组结肠组织进行气相色谱(gas chromatography, QC)法检测结肠组织脂肪酸组成,结果正如Fig.1E。急慢性期空白对照组和模型对照组全程无鱼油干预,4组小鼠结肠n-3 PUFAs含量差别无统计学意义。与模型对照组相比,急慢性期鱼油组n-3 PUFAs含量差异具有统计学意义(P<0.01);慢性期鱼油干预组小鼠结肠中n-3 PUFAs含量高于急性期鱼油干预组(P<0.05)。说明鱼油干预可提高小鼠结肠中n-3 PUFAs含量,且干预时间越长富集效果越好。与模型对照组相比,急慢性期鱼油组结肠中的DHA和EPA富集程度提高(P<0.01),其中慢性期鱼油组小鼠结肠中DHA和EPA含量高于急性期鱼油干预组(P<0.05),值得注意的是慢性期鱼油组小鼠结肠中EPA含量高于DHA。与模型对照组和急性期鱼油组相比,慢性期鱼油组花生四烯酸(arachidonic acid, AA)含量最低(P<0.01)。与空白对照组相比,急性期模型组AA含量显著升高(P<0.01)。可见,鱼油可显著提高急慢性期肠炎小鼠结肠组织中n-3 PUFAs、DHA和EPA含量,本文推测,鱼油富集程度可能与干预时间相关;同时鱼油能有效降低小鼠结肠组织中AA含量。
2.1.3 从疾病活动指数分析鱼油缓解急慢性期肠炎小鼠结肠组织炎症存在差异 整个实验周期内各组小鼠体重变化监测结果正如Fig.1B和Table 1,急慢性期空白对照组全程体重无较大波动,呈平稳增长;与急性期空白对照组相比(28.23 ± 0.15 g),急性期模型组DSS饮水第5 d小鼠体重(24.2 ± 0.09 g)大幅度降低(P<0.01),急性期鱼油组体重(25.34 ± 0.11 g)显著下降(P<0.05);DSS饮水结束,自由饮水第3 d,急性期模型组体重(20.44 ± 0.20 g)降低仍然明显(P<0.01),急性期鱼油组(21.63 ± 0.13 g)也明显下降(P<0.05)。与慢性期空白对照组相比,慢性期模型组在实验周期第10 d、24 d和32 d小鼠体重下降程度最明显(P<0.01);慢性期鱼油组在实验周期第10 d、24 d和32 d小鼠体重也呈现下降趋势(P<0.05),但小鼠体重下降程度低于慢性期模型对照组,体重恢复速度快于慢性期模型对照组。相比于急性期鱼油组,慢性期鱼油组随着干预时间延长,DSS引起小鼠体重丢失的程度逐渐减少,体重恢复速度明显加快。
计算各组小鼠体重丢失典型时间点的DAI变化趋势结果见Fig.1D。与急性期模型组相比,急性期鱼油干预组在实验周期第5 d和第10 d小鼠DAI评分明显降低(P<0.01);与慢性期模型组相比,慢性期鱼油干预组在实验周期第10 d、24 d和第32 d小鼠DAI评分明显降低(P<0.01),且随着鱼油干预时间延长,DAI下降幅度越明显(P<0.01)。在构建肠炎小鼠模型中,DSS会引起小鼠结肠充血、水肿及结肠变短,结果由图Fig.1C所示,急慢性期模型组小鼠结肠长度短于空白对照组(P<0.01),而结肠重量/长度比值高于空白对照组(P<0.05);急性期鱼油组小鼠结肠长度和结肠重量/长度比值与急性期模型组无差异;慢性期鱼油组小鼠结肠长度长于慢性期模型(P<0.01),结肠重量/长度比值低于慢性期模型组(P<0.05);与急性期鱼油组相比,慢性期鱼油组小鼠能显著增长结肠长度(P<0.01),降低结肠重量/长度比值(P<0.05)。相比于空白对照组,急慢性模型组小鼠体重显著降低、疾病活动指数和结肠长度与水肿程度显著升高。鱼油干预则能有效改善慢性期肠炎小鼠结肠长度,降低小鼠疾病活动指数。

Fig.1 Effects of fish oil on DSS-induced colitis in mice (A) Experimental protocol. The acute DSS group and acute DSS+FO group were exposed to 2.0% DSS (weight/ volume) drinking and and three days of water drinking. Then the chronic DSS group and chronic DSS+FO group intervened by fish oil was exposed to two cycles of 2.0% DSS (weight/ volume) drinking, while the control group was given autoclaved distilled water. During this time, fish oil intervention continued. To be more specific, the first DSS cycle consisted of 7 days of DSS drinking followed by 14 days of water drinking, and second DSS cycle contained 7 days of DSS drinking and 7 days of water drinking. (B) Body weight loss of mice. (C) Colon length and colon weight per unit length. Mice were sacrificed at the end of experiment, the length and weight of colon segment were measured. (D) DAI scores. The mice were weighed every day and monitored for weight loss, stool consistency and rectal bleeding to calculate disease activity index (DAI) score, which is commonly used to evaluate the severity of colitis. (E) The content of long chain polyunsaturated fatty acids in the colon of mice (*P<0.05,**P<0.01, compared with the control group.#P<0.05,##P<0.01, compared with the DSS model group.&P<0.05,&&P<0.01, compared with the acute DSS+FO group). At the end of the experiment, fatty acid profiles in colonic samples were analyzed by gas chromatography

2.1.4 组织病理学分析鱼油缓解急慢性期肠炎小鼠结肠组织炎症存在差异 对小鼠结肠组织的隐窝形态、组织损伤和炎症细胞浸润等方面进行组织病理学评分,结果见图Fig.2(A, B)。空白对照组小鼠结肠上皮结构清晰完整,隐窝结构排列有序,杯状细胞颗粒饱满,无炎性细胞浸润,黏膜肌层结构正常;模型组小鼠结肠上皮结构紊乱随着进入慢性期进程逐渐加重,隐窝结构严重变形或丧失,杯状细胞大量耗竭,上皮细胞中弥漫中性粒细胞和单核细胞,在急性期模型组中尤为明显,并深入肌层;急性期鱼油干预组小鼠结肠上皮结构较模型组完整,存在大量中立性细胞浸润,但不涉及肌层;慢性期中鱼油干预组炎症症状逐渐好转,上皮结构更加有序,炎性细胞偶见,隐窝结构排列有序和杯状细胞颗粒饱满。各组小鼠结肠组织学评分有差异(P<0.01),其中急性期模型组组织学评分最高,其次为慢性期模型组和急性期鱼油组,慢性期鱼油组最低;与模型组相比,在急慢性期中鱼油干预均能有效降低组织学评分(P<0.01),但慢性期效果优于急性期(P<0.01)。
检测各组小鼠血清中炎症因子IL-1β、TNF-α、IL-6和IL-10的表达水平(Fig.2B和Table 2),3种促炎因子IL-1β、TNF-α和IL-6在急性期模型对照组中表达最高,其次为慢性期模型组和急性期鱼油组,慢性期鱼油组最低;与模型组相比,在急慢性期中鱼油干预均能有效降低3种促炎因子TNF-α、IL-1β和IL-6的表达水平(P<0.05),但慢性期效果优于急性期(P<0.01)。与空白对照组相比,急慢性期模型组抗炎因子IL-10表达水平显著下降(P<0.01);与模型组相比,在急慢性期中鱼油干预均能有效提高抗炎因子IL-10的表达水平(P<0.05),但慢性期效果优于急性期(P<0.05)。可见鱼油干预能有效促进慢性期肠炎小鼠抗炎因子IL-10表达,且抑制抗促炎因子IL-1β、TNF-α和IL-6表达。
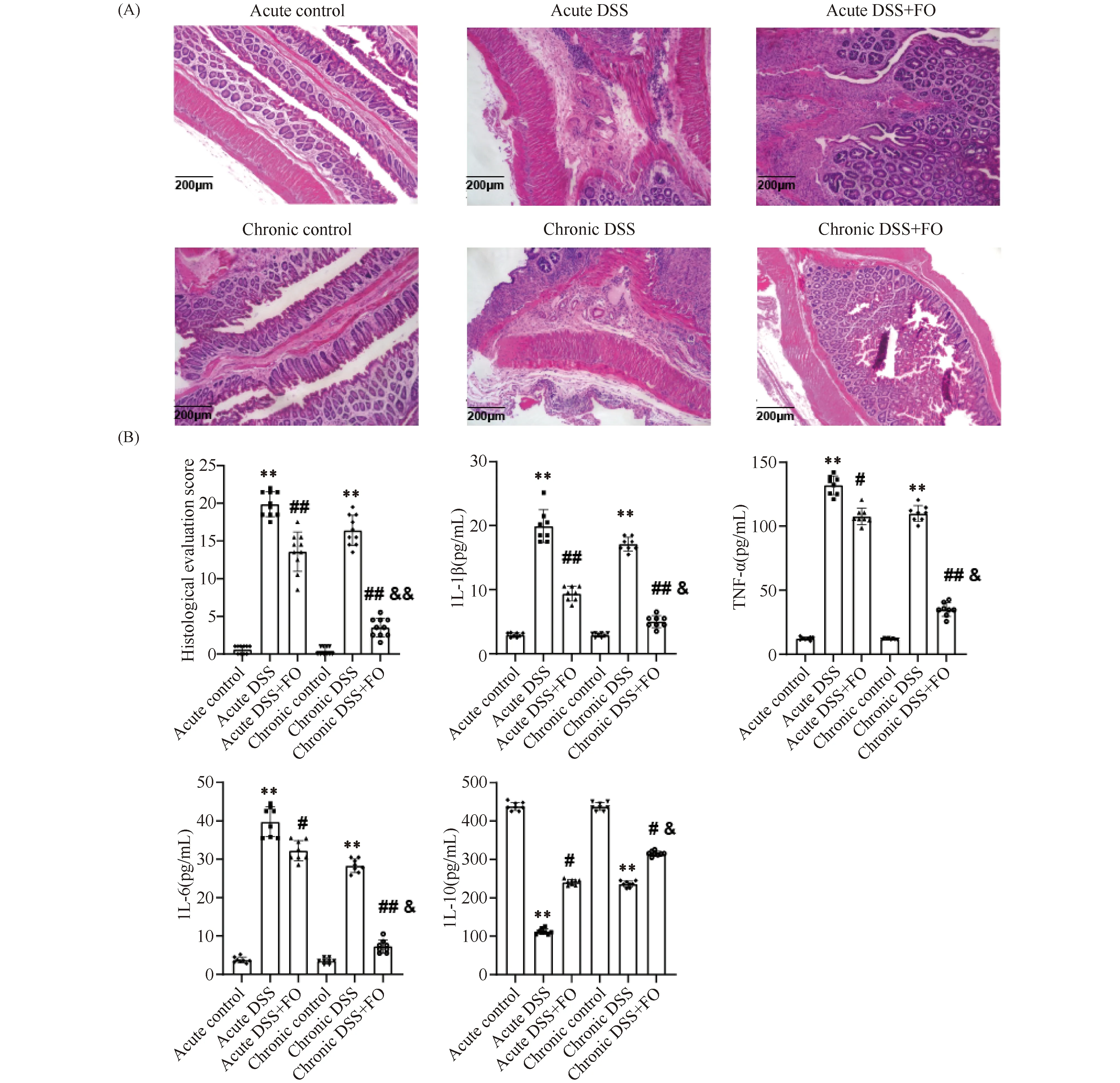
Fig.2 Histopathological analysis and serum inflammtatory factor evaluation in mice with DSS-induced colitis (A) Distal colon specimens were taken and fixed in 4% formalin for 24 hours followed by being embedded in paraffin. The 5 μm tissue sections were prepared and stained with Hematoxylin and eosin (H&E) for histopathological examination of colonic inflammation (×100, scale bar 200 μm). (B) Histological scores and serum inflammatory cytokine levels at the end of the experiment (*P<0.05,**P<0.01, compared with the control group.#P<0.05,##P<0.01, compared with the DSS model group.&P<0.05,&&P<0.01, compared with the acute DSS+FO group). At the end of the experiment, blood samples were collected from the retroorbital sinus after 12 hours of food deprivation, and the serum was isolated from whole blood by centrifuging. The concentrations of serum IL-1β, IL-6 and TNF-α were quantified by ELISA kits

Table 2 Inflammatory cytokines contents in serum of mice
2.2 鱼油显著增加慢性期肠炎小鼠粪便中产短链脂肪酸菌属和益生菌比例
2.2.1 鱼油影响急慢性期肠炎小鼠粪便肠道菌群组成存在差异 30个样品测序共获得4 050 807条高质量有效序列,平均135 027条,每个样本读段数从110 020条到156 023条不等,用USEARCH对高质量序列进行去引物、质量分析、去冗余和去嵌合体等,以97%相似度进行聚类共获得982个OTUs。小鼠粪便肠道微生物多样性分析结果见Fig.3(A, B),肠炎小鼠肠道菌群受疾病程度和干预的影响。与急性期空白对照组相比,急性期模型组alpha多样性(ACE指数)显著下降(P<0.05);与急慢性期模型组相比,急慢性期鱼油组小鼠粪便中ACE指数和Shannon指数无统计学差异;与慢性期空白对照组,慢性期模型组小鼠粪便中ACE指数和Shannon指数无统计学差异。本研究对样本间Bray-Curtis距离做非限制性主坐标分析(principal coordinate analysis, PCoA)(Fig.3B),结果显示,在第一主坐标轴(PCo1)上DSS诱导肠炎导致小鼠粪便微生物组成不同,这是本研究中最主要的微生物差异来源。鱼油干预是导致第二主坐标轴(PCo2)上样本粪便微生物组差异的主要因素,急性期鱼油组和慢性期鱼油组在第二轴上的位置不一致,慢性期鱼油组与急慢性空白对照组位置比较接近,提示鱼油干预可更有效影响慢性期肠炎小鼠粪便肠道菌群,使其微生物组组成更接近正常小鼠。
在微生物分类的目水平分析可见,各组主要由拟杆菌目(Bacteroidales)、梭菌目(Clostridiales)、丹毒丝菌目(Erysipelotrichales)、乳杆菌目(Lactobacillales)、肠杆菌目(Enterobacteriales)、伯克霍尔德氏菌目(Burkholderiales)和红蝽菌目(Coriobacteriales)组成。与空白对照组相比,急慢性期模型组具有产短链脂肪酸(short-chain fatty acid, SCFA)的梭菌目比例显著下调(P<0.01),其中慢性期模型组较急性期模型组下调比例大;与其相反,具有致病性及兼性厌氧的肠杆菌目比例明显升高(P<0.01),其中急性期模型组较慢性期模型组上升比例大;与急慢性模型组相比,急慢性鱼油组梭菌目和乳杆菌目比例显著上调(P<0.01),其中慢性期鱼油组乳杆菌目较急性期鱼油组升高比例大(P<0.05)。由此可见:鱼油干预可显著提高慢性期肠炎小鼠粪便中产丁酸盐和益生菌的相对丰度。
2.2.2 鱼油影响急慢性期肠炎小鼠粪便肠道菌群表型存在差异 为进一步了解肠道菌群表型功能的差异,将OTUs进行Bugbase表型预测分析,结果正如Fig.3C。与空白对照组相比,急慢性模型组厌氧菌的相对丰度显著下降(P<0.05);与模型组相比,鱼油组厌氧菌丰度明显升高(P<0.01);其中慢性鱼油组效果优于急性鱼油组(P<0.05)。与其相反,急慢性模型组需氧菌和兼性厌氧菌的相对丰度显著上调(P<0.01);与模型组相比,鱼油组需氧菌和兼性厌氧菌丰度明显下降(P<0.01);其中慢性鱼油组效果优于急性鱼油组(P<0.05)。有趣的是,给予鱼油干预后,小鼠粪便中革兰氏阳性菌相对丰度增加,而与致病菌和生物膜形成能力显著下调(P<0.01);其中慢性鱼油组效果优于急性鱼油组(P<0.05)。

Fig.3 Effects of fish oil on the gut microbiota diversity and composition (A, B) Alpha diversity boxplot (ACE index and shannon index). (B) PCoA using Bray-Curtis metric distances of beta diversity. Gut bacteria species are taxonomically classified by order. (C) Phenotypic prediction based on BugBase analysis. The relative abundances of phyla possessing anaerobic, aerobic, facultatively anaerobic, gram positive, potentially pathogenic and forms biofilms. (*P<0.05,**P<0.01, compared with the control group.#P<0.05,##P<0.01, compared with the DSS model group.&P<0.05,&&P<0.01, compared with the acute DSS+FO group)
2.3 鱼油改善慢性期肠炎小鼠肠道菌群与宿主互作失调
2.3.1 鱼油促进紧密连接相关蛋白质表达增强肠炎小鼠肠道机械屏障 紧密连接蛋白(tight junctions, TJs)包括闭合蛋白(claudins)、咬合蛋白(occludin)及闭合小环蛋白(zonula occludens-1, ZO1)等,位于相邻两细胞间,对维系上皮结构功能的完整性发挥重要作用[10]。结果正如Fig.4所示,与空白对照组相比,模型组中claudin1、occludin和ZO1相对表达明显下降(P<0.01);其中慢性期模型组相较于急性期模型组occludin表达量更低(P<0.01);与模型组相比,急慢性期鱼油干预可上调claudin1、occludin和ZO1表达;其中慢性期鱼油组相对表达量均高于急性期鱼油组(P<0.05)。我们推测,DSS破坏下调紧密连接蛋白质的表达,破坏结肠黏膜机械屏障,引起肠腔中菌群易位,诱发炎症;而鱼油干预可改善紧密连接蛋白质的表达水平、维护机械屏障,减轻炎症,且慢性期肠炎小鼠效果最佳。
2.3.2 鱼油促进氧化代谢相关蛋白质表达增强上皮能量代谢平衡 通常情况下,结肠上皮细胞的能量主要来自短链脂肪酸的有氧氧化,结肠上皮细胞有氧氧化代谢有利于维持肠腔厌氧环境和保持肠道菌群平衡[6]。通过蛋白质印迹法检测短链脂肪转运与氧化代谢相关的蛋白质表达情况:单羧酸转运蛋白1(monocarborxylat transporter 1, MCT1)、短链脂肪酸受体43(short-chain fatty acid receptor 43, GPR43)、肉碱脂酰转移酶1A(carnitine palmotyltransferase 1A, CPT1A)、肉碱脂酰转移酶2(carnitine palmotyltransferase 2, CPT2)、柠檬酸合成酶(citrate synthase, CS)和乳酸脱氢酶(lactate dehydrogenase, LDH),结果见Fig.4所示。与空白对照组相比,模型组中MCT1、GPR43、CPT1A、CPT2和CS相对表达量明显下降(P<0.05);与其相反,LDH的相对表达量显著上调(P<0.01);其中相比急性期模型组,慢性期模型组MCT1、GRP43、CPT1A和CS的相对表达量下调更明显。与模型组相比,急慢性期鱼油干预可上调CPT1A、CPT2和CS表达(P<0.01),其中只有慢性期鱼油干预可显著上调MCT1和GPR43相对表达量(P<0.01);同样,急慢性期鱼油干预可下调LDH表达(P<0.01),两组无统计学差异。由此推测,鱼油干预特别是慢性期鱼油干预能有效改善上皮屏障能量代谢功能异常,增强β-氧化,降低肠腔氧含量,阻止肠道微生物易位诱发炎症。

Fig.4 Effects of fish oil on colonic epithelial mechanical barrier and energy metabolism in mice with DSS-induced colitis The amount of every protein was quantified by the integrated density (Image J) of each band (*P<0.05,**P<0.01, compared with the control group.#P<0.05,##P<0.01, compared with the DSS model group.&P<0.05,&&P<0.01, compared with the acute DSS+FO group)
2.3.3 鱼油改善肠炎小鼠肠道菌群结构与代谢功能失调 基于PICRUSt2进行“封闭式”参考OTU划分(closed-reference OTU picking),通过与Greengenes数据库比对,寻找每一条测序序列的“参考序列最近邻居”,进而通过KEGG/EggNOG等基因功能谱数据换算预测菌群的整体代谢功能,结果见图Fig.5A,与空白对照组相比,急慢性期模型组粪便菌群的糖苷生物合成与代谢途径和氧化磷酸化代谢受到破坏(P<0.05);相比于模型组,慢性期鱼油干预可改善菌群糖苷生物合成与代谢和氧化磷酸化代谢障碍(P<0.05)。
对各组粪便中丙酸(propionic acid)、乙酸(acetic acid)和丁酸(butyric acid)含量检测结果正如Fig.5B。与空白对照组相比,急慢性期模型组中丙酸、乙酸和丁酸含量显著下降(P<0.01);与模型组相比,鱼油干预能有效上调乙酸、丙酸和丁酸含量(P<0.01),其中慢性期鱼油组对乙酸的上调幅度最明显(P<0.01),其次是丁酸(P<0.01)。短链脂肪酸和肠道微生物群丰度之间的相关性分析(Fig.5C)表明,肠道菌群的丰度与乙酸、丙酸和丁酸含量显著相关。在目水平上,Eggerthellales(P<0.05)、Anaeroplasmatales(P<0.05)、Clostridiales(P<0.05)和Bifidobacteriales(P<0.01)与丁酸含量呈正相关;Bdellovibrionales(P<0.05)、Clostridiales(P<0.05)和Bifidobacteriales(P<0.05)与乙酸含量呈正相关;Enterobacterales(P<0.01)与丙酸、乙酸和丁酸含量呈负相关;Rhizobiales(P<0.05)、Verrucomicrobiales(P<0.05)、Bacillales(P<0.05)和Sphingomonadales(P<0.05)与乙酸含量呈负相关。由此推测,肠炎小鼠会改变肠道菌群自身代谢功能异常并会引起菌群结构紊乱,鱼油干预可改善产SCFA菌群结构和益生菌比例,同时抑制兼性厌氧菌组成,进而缓解肠腔氧分压失衡。
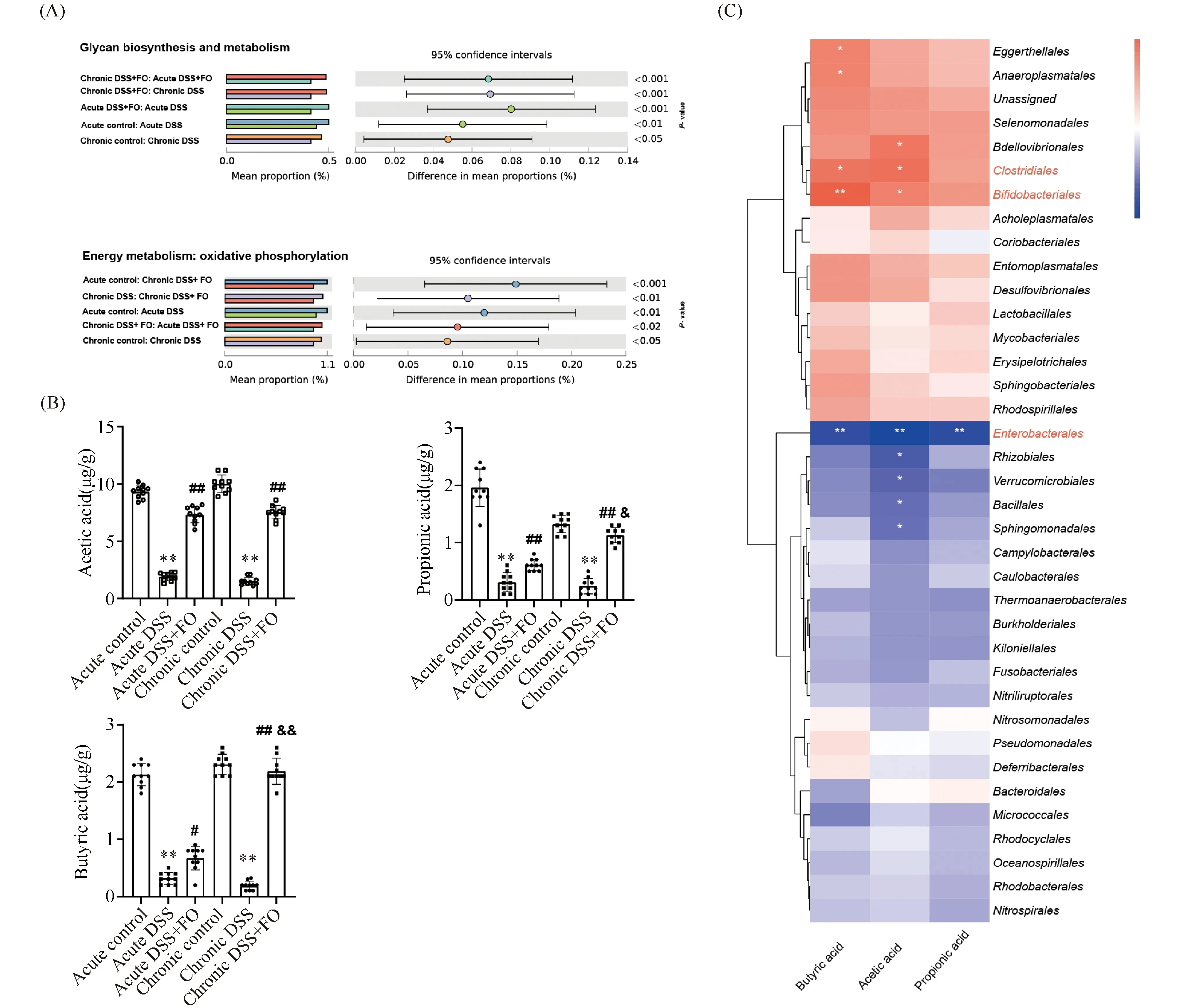
Fig.5 Effects of fish oil on microbial metabolism of DSS-induced colitis mice (A) Functions were predicted by PICRUSt2 using the KEGG pathway database and visualized using STAMP. (B) The fecal SCFA content was measured using gas chromatography. (C) Spearman’s correlation between fecal SCFAs and order-level abundances after fish oil treatment (*P<0.05,**P<0.01, compared with the control group.#P<0.05,##P<0.01, compared with the DSS model group.&P<0.05,&&P<0.01, compared with the acute DSS+FO group)
3 讨论
3.1 鱼油对维持缓解期肠炎小鼠具有更强的抗炎作用
流行病学研究显示,亚洲国家UC发病率快速上升与饮食西方化有关,膳食中n-3/n-6 PUFAs摄入不平衡是重要影响因素[11]。Mozaffari等人近期荟萃分析纳入了5项前瞻性研究和7项病例对照的分析结果表明,膳食中n-3 PUFAs摄入与UC患病风险呈显著性负相关[12]。Wiese等人发现,UC患者血清中PUFAs与肠组织炎症因子呈负相关,活动期UC患者血清PUFAs百分含量明显低于健康人群[13]。34名UC患者组成的一项为期1年的双盲、随机和交叉试验,每天给予2次10 mL鱼油干预(5.0 g/d EPA+1.2 g/d DHA),安慰剂组为橄榄油,鱼油干预可显著改善患者4周以上缓解,6个月无活动性疾病复发症状(直肠出血、大便稀疏、大便频繁)[14]。一项为期6个月的双盲、平行分组和安慰剂对照的研究,18例维持缓解期的UC患者每天给予鱼油干预(3.2 g/d EPA+2.4 g/d DHA),相比于安慰剂组(向日葵油, 2.6 g/d油酸+7.6 g/d亚油酸),鱼油干预可显著减少维持缓解期临床或内窥镜下炎症活动性表现[15]。另一项64例缓解期的UC患者进行2年给予5.1 g/d鱼油干预发现,相比于安慰剂组(玉米油),每日鱼油补充能有效延长缓解期间复发的间隔时间[16]。本研究发现,急慢性期鱼油干预均可显著提高小鼠结肠中n-3 PUFAs含量,干预时间直接影响富集效果。鱼油维持缓解小鼠肠炎的作用与鱼油富集程度相关,小鼠慢性期鱼油干预缓解效果优于急性鱼油干预,主要表现为小鼠体重恢复快,疾病活动指数评分、结肠长度、结肠水肿程度和组织病理学评分明显降低,血清促炎因子IL-1β、TNF-α和IL-6水平明显降低,抗炎因子IL-10水平明显提高。
值得注意的是,慢性期鱼油组小鼠结肠中EPA含量高于DHA。本文推测,鱼油在慢性期表现出优异的维持缓解效果可能与EPA含量有关。Ananthakrishnan等人对17万人长达26年的随访研究发现,EPA的摄入与UC患病风险呈负相关[17]。Perl等人对UC患者的炎性结肠黏膜、非炎性结肠黏膜、静息期结肠黏膜和配对性别对照的结肠黏膜中脂肪酸构成分析发现,与UC患者的非炎性结肠黏膜和对照组结肠黏膜相比,UC患者的炎性黏膜中花生四烯酸和DHA含量升高,α-亚麻酸、亚油酸和EPA显著性下降,结肠炎症程度与EPA呈负相关[18]。对2组缓解期UC患者的安慰剂对照试验中发现,每天给予2次500 mg EPA-FFA(free fatty acid form of EPA, EPA-FFA)治疗,患者无严重的不良事件,补充EPA-FFA可降低粪钙卫蛋白水平,减少UC患者的黏膜损伤,促进杯状细胞(goblet cell, GC)分化[19],调节肠道菌群组成,并维持UC患者的无症状缓解。此外,相比于UC轻中度常用药柳氮磺胺吡啶,CLX-103(EPA偶联氨基水杨酸(aminosalicylic acid, 5-ASA)可靶向结肠黏膜炎症部位,用量少和药效高[20, 21]。在DSS诱导的结肠炎小鼠研究中同样发现,EPA缓解肠炎的效果优于DHA,其DAI评分更低,促炎细胞因子生成和炎性细胞浸润显著下调。这可能与EPA通过抑制Akt和ERK(extracellular signal-regulated kinase)活化,促进紧密连接蛋白表达(例如claudin-1和occludin),维系肠黏膜屏障完整性有关。EPA还抑制DSS诱导的肠上皮炎症细胞浸润和炎症因子表达,抑制NLRP3 /IL-1β和IL-6 /STAT3炎症通路活化[22]。
3.2 鱼油有效改善维持缓解期肠炎小鼠粪便菌群功能与丁酸比例,改善肠道菌群与宿主互作失调
UC患者通常肠道菌群、肠道菌群功能多样性和稳定性受损,产短链脂肪酸菌丰度减少,需氧菌和兼性厌氧菌增加。在小鼠和大鼠肠炎模型中,n-3 PUFAs干预可显著增加Akkermansia[23]、Bifidobacteria[24]和产丁酸菌丰度改善肠道菌群失调。治疗诱导期UC常用药5-ASA可阻止肠杆菌科扩张缓解微生态失调。本研究发现,鱼油干预能影响小鼠粪便肠道菌群结构,特别是鱼油干预可显著提高慢性期肠炎小鼠粪便中产丁酸盐菌群(Clostridiales)和益生菌(Bifidobacteriales)的相对丰度,下调需氧菌、兼性厌氧菌、致病菌和生物膜形成能力菌群的比例。微生物代谢产物是细菌-宿主串扰的主要沟通渠道之一,短链脂肪酸作为肠道菌群的代谢产物,肠道内环境改变直接影响菌群结构,进而影响短链脂肪酸产生。本研究发现,在目水平上,主要产短链脂肪酸的Clostridiales(P<0.05)和益生菌Bifidobacteriales(P<0.01)与丁酸含量呈正相关;兼性厌氧菌Enterobacterales(P<0.01)与丙酸、乙酸和丁酸含量呈负相关。鱼油干预能有效上调丙酸、乙酸和丁酸含量(P<0.01),其中慢性期鱼油干预组对丁酸的上调幅度最明显。
UC一直被报道与肠道菌群有关,有关其病原学的研究主要集中在以下两方面:(1)持续病原体理论认为是艰难梭菌(Clostridiumdifficile)[25]和黏附侵袭性大肠杆菌(adherent invasiveE.coli, AIEC)的持续感染有关[26];(2)大量细菌易位穿过肠黏膜屏障导致微生物屏障紊乱[27]。这些干扰通常会引起结肠上皮结构紊乱和肠道通透性改变,进而促进病原微生物和有害物质的吸收。本研究对小鼠末端结肠组织的蛋白质印迹法检测结果发现:相比于急性期鱼油干预组,慢性期鱼油干预可显著上调紧密连接蛋白质的表达,例如claudin1、occludin和ZO1(P<0.05)。我们推测,DSS破坏小鼠黏膜屏障并下调紧密连接蛋白质的表达,引起肠腔中菌群易位,诱发炎症;而慢性期鱼油干预能更有效维护肠上皮机械屏障,减轻炎症。
UC的病因尚不清楚,1980年Roediger等人曾提出UC是一种由于无法利用丁酸而导致能量代谢损害的疾病,这一理论已被越来越多的证据证明[28]。结肠上皮细胞许多重要功能都依赖于能量,主要包括上皮细胞机械屏障的构建[21]和微生物屏障的稳态[29]等 。影响结肠上皮细胞能量代谢的因素均会促发肠黏膜屏障紊乱,进而诱发UC的发生[30]和发展[31]。丁酸盐是肠道主要的能量来源,为结肠上皮细胞提供了60%~70%的能量需求[32]。用丁酸盐氧化抑制剂2-溴辛酸钠(sodium 2-bromo-octanoate)对大鼠灌肠处理5天后,大鼠呈现UC症状[33]。本研究发现,鱼油能有效维持缓解慢性期肠炎小鼠改善上皮屏障能量代谢功能异常,增强β-氧化,降低肠腔氧含量,进而阻止肠腔微生物易位诱发炎症。我们推测,相比于慢性期鱼油组(维持缓解期),可能与急性期鱼油组(诱导缓解期)肠炎小鼠粪便菌群自身代谢功能异常,产短链脂肪酸菌结构和益生菌比例不足,兼性厌氧菌上调有关。Bacallao等人报道,上皮细胞ATP耗竭时,常引起肌动蛋白细胞骨架结构改变,参与细胞间连接的F-肌动蛋白明显减少和破坏,导致细胞间隙增宽[34]。体外实验同样证实,正常的能量代谢功能对维持Caco-2上皮结构完整性必不可少。能量耗竭使Caco-2单层细胞中claudin 7表达下调,进而引起单层细胞渗透性增大[35]。本研究发现,慢性期鱼油组小鼠结肠中EPA含量显著高于DHA(P<0.05)。最近的研究认为,EPA和DHA对协调结肠炎小鼠微生物和宿主互作失衡存在差异。与DHA相比,EPA更能有效促进杯状细胞分化、黏蛋白质成熟、黏液颗粒组装和分泌强化肠道黏液屏障,增强结肠黏液屏障驯化肠道微生物,促进产短链脂肪酸菌群丰度为结肠上皮细胞提供能量物质,进而缓解肠炎小鼠肠道菌群和宿主互作失衡[10]。本研究发现,DSS下调小鼠结肠上皮细胞紧密连接蛋白质的表达,破坏结肠黏膜机械屏障,促发细菌易位,诱发炎症;而鱼油干预可改善紧密连接蛋白质的表达水平(claudin1、occludin和ZO1)、维护机械屏障,减轻炎症,鱼油对维持缓解期的效果优于诱导缓解期。本研究发现鱼油对维持缓解慢性期小鼠肠炎具有更强的抗炎作用,其作用机制可能与改善维持缓解期肠炎小鼠粪便菌群功能与提高丁酸含量,改善肠道菌群与宿主互作失调有关。
