黄连素及其衍生物抗呼吸系统肿瘤的作用及机制
2022-09-06胡元欣邓婧涵伍春莲
胡元欣, 邓婧涵, 伍春莲*
(1)西华师范大学西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2)西华师范大学生命科学学院生物系细胞遗传教研室,四川 南充 637009)
呼吸系统肿瘤是呼吸系统中各个部位肿瘤的统称,例如肺癌、鼻咽癌以及喉癌等,受环境等因素的影响,呼吸系统癌变人数逐年上升,其中以肺癌为首。世界范围内,2012年肺癌发病人数和死亡人数分别为180万和160万[1],2018年肺癌发病人数和死亡人数分别为210万和177万[2],2020年肺癌的发病人数和死亡人数为221万和180万[3]。逐年快速增长的肺癌发病人数和死亡人数,使研究者迫切寻找有效治疗呼吸系统肿瘤的方法和药物,临床上对肺癌等呼吸系统肿瘤治疗后容易出现病灶向其他正常组织转移的现象,并且会侵袭免疫细胞。此外,肿瘤细胞在化疗药物和放疗射线的反复作用下会出现耐受性。对于化学药品而言,天然中药成分治疗肿瘤的毒副作用相对较小且来源较广。因此,研究中药成分用于临床治疗癌症已成为一种趋势。例如,中药成分紫草素可抑制肺癌细胞增殖[4],厚朴酚能够缓解肺癌细胞炎症反应[5],紫杉醇和白藜芦醇可以促进喉癌细胞凋亡[6]等。基于前人对各种中药成分和肿瘤的研究,发现黄连素这种原本主要用于治疗肠道感染的天然中草药成分也可有效对抗多种呼吸系统肿瘤,有希望成为药物辅助临床治疗。
中药材黄连始载于《神农本草经》,常用于治疗腹泻、呕吐、黄疸、牙痛和湿疹等,主要成分为黄连素(berberine hydrochloride, BBr)[7],是一种异喹啉生物碱。黄连素又名小檗碱,熔点204 ℃~ 206 ℃,常温下为黄色针状结晶,味苦,其化学式为C20H18NO4+,分子量为336.36。由小檗碱为基础人工合成的黄连素的衍生物包括四氢黄连素(tetrahydroberberine)、表黄连素(epiberberine)、小檗红碱(berberrubine)等,部分可以从黄连等小檗科植物中提取,但含量较低[8]。与小檗碱相同,小檗碱衍生物也可作用于呼吸系统肿瘤[9],抑制其增殖[10]和转移等[11]。Fig.1为小檗碱及其衍生物的化学结构式。

Fig.1 The chemical formula for berberine and its derivatives The structural formulas and functional groups of berberine, tetrahydroberberine, epiberberine and berberrubine were shown
近年来,对黄连素及其衍生物的药理活性的研究表明:黄连素及其衍生物有抗菌、抗病毒和抗肿瘤等作用,例如肝癌[12]、肺癌[13-14]、喉癌[15]和鼻咽癌[16]等,对于一些血液肿瘤也有比较好的抑制作用[17]。基于此,本文综述了近些年黄连素及其衍生物对抗呼吸系统肿瘤的作用及机制。
1 黄连素及其衍生物抗肺癌的作用和机制
1.1 诱导肺癌细胞凋亡
用盐酸黄连素依次处理肺癌细胞株H460、A549和H1299,凋亡率分别增加到42.12% ± 4.04%,53.22% ± 2.63%和59.89% ± 3.52%,表明盐酸黄连素可以诱导肺癌细胞凋亡[7]。另一项研究显示,黄连素处理A549细胞和PC9细胞,早期和晚期凋亡比例均不同程度地高于对照组,也证明黄连素能促进肺癌细胞凋亡,并呈剂量依赖性[7]。
非小细胞肺癌发生的重要原因之一是微RNA(microRNAs, miRNAs)表达异常导致蛋白质的功能障碍[18],用不同剂量黄连素处理A549细胞和PC9细胞后检测miR-19a的表达发现,其表达呈剂量依赖性升高。然后,通过转染miR-19a抑制剂来沉默A549细胞和PC9细胞中的miR-19a。用黄连素处理之后,发现A549细胞和PC9细胞的凋亡率下降,说明黄连素能通过上调miR-19a来促进肺癌细胞凋亡[7]。
部分肺癌组织可以合成组织因子(tissue factor, TF)。TF会促进肺癌细胞的生长,抑制其凋亡。TF在PC9细胞中表达水平显著增高,用黄连素处理PC9细胞,发现TF的表达呈剂量依赖性降低,表明黄连素还能通过降低TF的表达来诱导肺癌细胞凋亡[7]。
黄连素可以作用于MAPK信号通路,使肺癌细胞中信号传导受阻,进而诱导肺癌细胞凋亡。TF能激活信号级联MAPK信号通路,所以黄连素作用于TF在促进肺癌细胞凋亡的同时还会作用于MAPK信号通路,加强肺癌细胞凋亡[19]。因此,黄连素能通过上调miR-19a的表达,降低TF的表达,激活MAPK信号传导来诱导肺癌细胞凋亡[20]。
AMPK是一种肿瘤抑制因子的激活因子,可以抑制肿瘤细胞的生长,促使其凋亡[21]。用黄连素处理诱发肺癌的小鼠后发现,AMPK和mTOR上调,NF-κB和AQP-1下调。说明黄连素还可以上调AMPK和mTOR来抑制NF-κB和AQP-1,激活AMPK信号通路诱导细胞凋亡。
活性氧(reactive oxygen species, ROS)可以加速线粒体的去极化和功能障碍,用黄连素处理A549细胞后发现,细胞中ROS含量显著升高,而使用ROS抑制剂时,细胞凋亡率有所下降,表明黄连素可以上调ROS来促进细胞凋亡[22]。另一研究发现,黄连素处理后的A549细胞中ATP含量降低,表明黄连素可能通过限制细胞获取能量的方式来限制肺癌细胞对营养成分的获取,从而达到饥饿肺癌细胞的目的,促使肺癌细胞凋亡[23]。
黄连素可以通过MAPK、AMPK、miR-19a、TFNF-κB、AQP-1、ATP和ROS等分子靶点及信号通路来促进肺癌细胞凋亡。
1.2 抑制肺癌细胞迁移和侵袭
癌细胞迁移和侵袭是癌症转移的重要步骤。伤口愈合实验分别用不同浓度的黄连素处理A549细胞和PC9细胞,发现细胞伤口愈合均会受到抑制,并且呈剂量依赖性降低。说明黄连素会抑制肺癌细胞迁移[24]。Sin3A是一种转录抑制因子的活性介体,用于调控肿瘤细胞侵袭[7],用盐酸黄连素处理之后,Sin3A在H460细胞和A549细胞中的半衰期降低,证明盐酸黄连素能通过缩短Sin3A的半衰期来加速Sin3A分解,进而抑制肺癌细胞侵袭[10]。上皮间质转化(epithelial-mesenchymal transition, EMT)是一种促进细胞转移的程序,可以增强癌细胞的移动性和侵袭性,而TGF-β1是多种癌细胞EMT程序的触发因子,TGF-β1的表达量降低会直接抑制EMT的进程,从而导致MMP-2(matrix metallopeptidase 2,MMP-2)的表达量下降[24-25],而黄连素作用于A549细胞后会使MMP-2、TGF-β1的表达降低,肺癌细胞迁移和侵袭受到抑制[26]。用表黄连素处理A549细胞后发现,钙黏着蛋白(N-cadherin)呈浓度依赖性降低,显示表黄连素能显著抑制肺癌细胞的迁移和侵袭[11]。所以,黄连素可缩短Sin3A半衰期,以及通过EMT直接或间接作用于TGF-β1和MMP-2来抑制肺癌细胞转移和侵袭。
1.3 抑制肺癌细胞增殖
用四氢黄连素处理肺癌细胞H1975,发现细胞的增殖能力明显下降,说明四氢黄连素可以抑制肺癌细胞增殖[10]。体内实验表明,黄连素治疗A549移植瘤裸鼠后发现,30 d孵育后,黄连素组的肿瘤平均大小明显低于对照组,同时检测到TF表达明显降低。说明黄连素能抑制A549细胞增殖[7]。
黄连素作用于肺癌细胞通过影响细胞周期蛋白质的合成和活化,降低其表达水平。用不同浓度的黄连素处理A549细胞,检测细胞周期蛋白的表达发现,除细胞周期蛋白D1(cyclinD1)外,细胞周期蛋白A1、细胞周期蛋白A2和细胞周期蛋白B1都呈下降趋势,提示黄连素可以将细胞阻滞在G0/G1期或G2/M期,抑制A549细胞进入分裂期,抑制肺癌细胞增殖[27]。
用盐酸黄连素处理H460细胞和A549细胞,发现组蛋白H2AX的Ser139发生磷酸化[7],表明盐酸黄连素还能直接作用于肺癌细胞DNA,导致DNA双链断裂,改变DNA的空间构象,使DNA功能发生改变。此外,黄连素及其衍生物能通过由拓扑异构酶所介导的“DNA可切割复合物”来形成DNA三联体或四聚体,从而使肺癌细胞DNA不能正常复制,以此来抑制肺癌细胞增殖[28]。黄连素可以通过阻滞细胞周期的方式抑制肺癌细胞增殖,还能直接作用于肺癌细胞DNA,来抑制其增殖。
1.4 调节肺癌细胞自噬
自噬被称为Ⅱ型程序性细胞死亡,是调节癌细胞死亡的过程。用黄连素处理A549细胞,发现自噬细胞数量明显增多,说明黄连素会刺激肺癌细胞发生自噬[16]。研究表明,在肺癌细胞中,B细胞淋巴瘤蛋白2(B cell lymphoma 2, Bcl-2)可以通过激活mTOR信号通路来促进细胞自噬,而黄连素能提高细胞A549中Bcl-2的表达,以此来促进肺癌细胞自噬。蛋白激酶B(protein kinase B, Akt)是肿瘤发生发展过程中重要的蛋白质,黄连素能抑制Akt的活性,以此来诱导细胞自噬性死亡[29]。
肿瘤细胞自噬和凋亡呈负向关系,即抑制细胞自噬可以促进细胞凋亡,并且当细胞的自噬系统有缺陷时,也会激活细胞凋亡[30]。MAPK信号通路可以调节细胞的凋亡与自噬,黄连素下调肺癌细胞的MAPK信号通路会引起细胞自噬,而当肺癌细胞的自噬发生障碍时,黄连素还能通过上调MAPK信号通路来抑制肺癌细胞自噬,促使肺癌细胞凋亡[31]。因此,黄连素作用于肺癌细胞的Bcl-2、Akt和MAPK信号通路来调节其自噬。
1.5 抑制肺癌细胞血管新生
肿瘤血管新生会促进癌细胞生长和转移,加速癌症的恶化。人类端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)是人类端粒酶的重要组成部分,与肿瘤血管新生密切相关,促使细胞永生,hTERT在人类正常细胞中不表达,过度表达会促使正常细胞转化为癌细胞[31],激活增强子结合蛋白2α(activating enhancer-binding protein-2α,AP-2α)和激活增强子结合蛋白2β(activating enhancer-binding protein-2β,AP-2β)可以启动hTERT的表达。用不同浓度的黄连素处理A549细胞发现,AP-2α、AP-2β和hTERT蛋白质表达均受到了抑制。再用AP-2α和AP-2β的siRNA转染A549细胞,继而用黄连素处理,发现AP-2α和AP-2β蛋白质的表达量均比转染组低。所以,黄连素既能通过抑制AP-2α和AP-2β来抑制hTERT的表达,也能直接作用于hTERT,降低其表达。这些结果证实,黄连素可以通过AP-2/hTERT信号传导途径抑制肿瘤血管新生[32]。
血管内皮生长因子 (vascular endothelial growth factor, VEGF)是血管发生和发展过程中重要的诱发因子,可以促使血管生成。色素上皮衍生因子(pigment epithelium-derived factor,PEDF)是一种血管生成抑制剂,可以抑制VEGF的作用。在肿瘤细胞中,VEGF/PEDF的比例升高[33]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是一种转录因子,可以与VEGF启动子结合使VEGF基因的转录激活。所以在肿瘤细胞中,HIF-1α表达量升高[34]。黄连素可以抑制HIF-1α在肺癌细胞A549中的表达和积累,进而抑制VEGF的表达,从而降低VEGF/PEDF比例,以此来阻止肺癌细胞血管新生[34]。
黄连素通过AP-2/hTERT信号通路及降低VEGF/PEDF比例来抑制肺癌细胞血管新生。
1.6 参与肺癌的免疫疗法
人体的免疫系统是维持人体健康的重要防线,《黄帝内经》中说到“正气存内,邪不可干;邪之所凑,其气必虚”,表达的中医思想就是要养护免疫系统。而近些年,在关于肿瘤的治疗中,肿瘤免疫疗法也成为了十分重要的手段。在非小细胞肺癌细胞中,程序性细胞死亡配体1(programmed death-ligand 1, PD-L1)表达量升高,抑制T细胞免疫激活[35]。CSN5 (constitutive photomorphogenic-9 signalosome 5)蛋白是一种致癌蛋白质,用于调节癌细胞的DNA修复,增强PD-L1的稳定性,帮助癌细胞进行免疫逃逸。而用黄连素处理肺癌细胞可以使CSN5蛋白泛素化,加速PD-L1降解,增强癌细胞对T淋巴细胞的敏感性,从而抑制肺癌细胞的发生发展[36]。
吲哚胺2,3-双加氧酶1(indoleamine 2,3-dioxygenase1, IDO1)是L-色氨酸沿犬尿氨酸途径代谢的关键酶,与STAT1密切相关。IDO1可以积累代谢产物犬尿氨酸,使免疫细胞的功能紊乱甚至凋亡,从而减弱其免疫能力[37]。使用黄连素衍生物处理A549细胞,再用IFN-γ刺激细胞,发现磷酸化的AMPK底物表达升高,而磷酸化的STAT1被显著抑制,说明黄连素衍生物通过IFN-γ来激活AMPK信号通路从而抑制STAT磷酸化。进而下调IDO1的表达,减少犬尿氨酸对T细胞和NK免疫细胞的破坏,促使这两种免疫细胞对肺癌细胞发生免疫作用[38]。
通过PD-L1、IDO1、STAT1以及AMPK信号通路,黄连素及其衍生物可以参与肺癌的免疫疗法。
1.7 降低肺癌细胞耐药性
肿瘤细胞产生耐药性是临床上肿瘤治疗失败的重要原因之一[39]。肿瘤细胞中ROS含量较低,ROS增加会使肿瘤细胞中的大分子物质被破坏,最终导致肿瘤细胞死亡。而ROS作用于肿瘤微环境,与T细胞的活化有密切关系,增强ROS还能提高肿瘤细胞对化疗药物的敏感性[40],而黄连素作用于肺癌细胞A549之后,使A549细胞中ROS含量升高,可以破坏肺癌细胞中的大分子物质,诱导其凋亡,还有助于提高肺癌细胞对化疗药物的敏感性,降低肺癌细胞的耐药性。此外,肿瘤细胞产生耐药性的一大特点是癌细胞内DNA损伤修复,γH2AX蛋白是DNA双链发生断裂的标记物,用黄连素处理肺癌细胞A549时,γH2AX蛋白表达量上升,说明黄连素诱导DNA发生了断裂,减弱其DNA损伤修复的能力,从而阻止肺癌细胞产生耐药性,并且对正常细胞的DNA无损伤作用[15]。因此,黄连素通过ROS和γH2AX可以降低肺癌细胞的耐药性。
综上所述,黄连素及其衍生物通过MAPK、AMPK、mTOR和EMT等信号通路和各种相关蛋白质,诱导肺癌细胞凋亡,抑制肺癌细胞增殖、迁移和侵袭,以及调节肺癌细胞自噬、抑制血管新生。此外,黄连素还有助于降低肺癌细胞的耐药性,参与免疫治疗。黄连素及其衍生物通过多个信号通路和靶点作用于肺癌细胞的各个方面,这对于临床上治疗肺癌提供了一个很好的药物成分,有助于肺癌患者更好地康复。Table 1展示小檗碱对肺癌细胞的作用机制。Fig. 2显示小檗碱抗肺癌多种机制的关系。
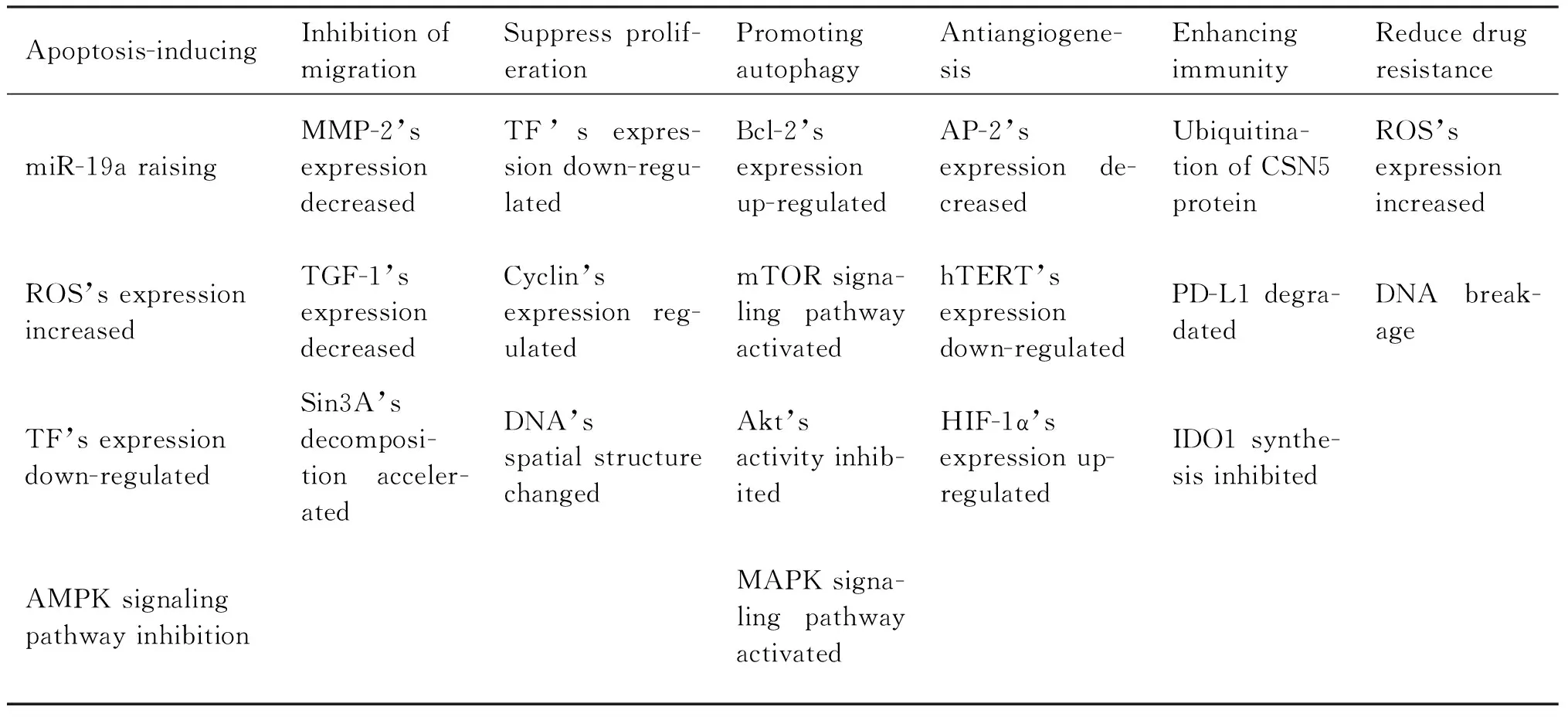
Table 1 Mechanisms of action of berberine on lung cancer cells

Fig.2 Mechanisms of berberine in treating lung cancer Berberine inhibits the proliferation, migration, drug resistance of lung cancer cells and tumor angiogenesis, and promotes cell apoptosis, autophagy, and immunotherapy through various mechanisms which have complex relationship
2 黄连素抗其他呼吸道肿瘤的作用和机制
2.1 黄连素对喉癌细胞的作用
用不同剂量的黄连素处理Hep2细胞,发现细胞增殖率呈浓度依赖性下降、凋亡率呈浓度依赖性上升,且凋亡依赖因子Apaf1、cl-caspase-9和cl-caspase-3表达水平显著上调,表明黄连素可以抑制喉癌细胞增殖,并促使其凋亡。此外,VEGF、MMP-2和MMP-9蛋白质水平均显著降低,表明黄连素还能抑制喉癌细胞血管生成[41]。
NF-κB是一种重要的转录调节因子,进入细胞核中调节与肿瘤发生发展相关基因的表达,上调细胞周期蛋白质的表达,同时激活VEGF相关基因,促进肿瘤细胞血管生成,促使正常细胞转化为癌细胞,通过PI3K/Akt信号通路可以降解NF-κB抑制剂,促进NF-κB入核发挥作用[42]。而黄连素可以作用于Hep2细胞的PI3K/Akt信号通路,抑制NF-κB发挥作用,从而抑制喉癌细胞增殖和血管生成,抑制正常细胞向喉癌细胞转化,并促进其凋亡[35]。
此外,临床上出现耐药性也是困扰喉癌治疗的重要因素,环氧合酶-2(cyclooxygenase2,COX-2)是花生四烯酸代谢过程中重要的限速酶,在肿瘤细胞中过表达,COX-2表达量升高会促进肿瘤细胞生长,并且诱发肿瘤细胞产生耐药性[43]。黄连素作用于Hep2喉癌细胞能够降低喉癌细胞中COX-2的含量,以此来改善喉癌细胞的耐药性。所以,在喉癌的临床治疗中,采用放化疗治疗喉癌或者在手术切除肿瘤之后,黄连素一定程度上还能发挥预防复发的作用,有希望成为辅助药物协助喉癌的治疗。
近些年,采用光动力的方法治疗食管癌、喉癌等管道肿瘤已经取得了显著的疗效,黄连素具有光敏性,可以结合光动力疗法来治疗喉癌,促使喉癌细胞中线粒体发生应激反应,产生活性氧,加速肿瘤细胞死亡[44]。以上发现表明,传统中药成分黄连素能协助临床上的现代光动力技术来治疗喉癌。
总之,黄连素可以通过VEGF、MMPs、NF-κB、COX-2、PI3K/Akt等靶点,对喉癌细胞有抑制血管生成、促进凋亡、改善耐药性和辅助光动力治疗等作用,对临床治疗喉癌提供基础。
2.2 黄连素对鼻咽癌细胞的作用
鼻咽癌是一种常见的上皮性呼吸道恶性肿瘤。由于其对化学药物和放射线非常敏感,目前临床上的治疗方式多采用传统的化疗和放疗。中医认为,“气虚染毒”是鼻咽癌的发病原因,而治疗的方法以益气解毒为主,而黄连素具有清热解毒的功效,从中医角度来看,黄连素是抗鼻咽癌较好的药物。
埃兹蛋白(ezrin)是ERM(ezrin-Radixin-moesin)细胞骨架蛋白家族的成员之一,参与癌细胞的黏附、迁移等,Ezrin在鼻咽癌细胞中表达较高。研究表明,黄连素可以在不影响其他蛋白质表达的情况下,抑制Ezrin的磷酸化,使鼻咽癌细胞的侵袭和转移被抑制[45]。
用黄连素处理鼻咽癌CNE-2细胞,发现相关细胞周期蛋白质表达量降低,细胞阻滞在G0/G1期,同时发现HIF-1α表达下调,说明黄连素可通过抑制肿瘤血管新生方式来抑制其鼻咽癌细胞增殖[46]。
肿瘤细胞中STAT基因被激活,产生相关的抗凋亡蛋白质Bcl-2和Bcl-x,激活肿瘤细胞生长。白介素-6(interleukin- 6,IL- 6)是鼻咽癌细胞STAT基因的激活因子,用黄连素处理鼻咽癌细胞C666-1时,IL-6的含量降低,STAT基因被抑制,泛素化加速,与此相关的抗凋亡蛋白质表达量也降低,上述结果显示,黄连素可以诱导鼻咽癌细胞凋亡[47]。
临床上采用放疗方式治疗鼻咽癌容易使细胞放射敏感性降低。转录因子SP1(transcription factor Sp1,SP1)会降低肿瘤细胞对放射线的敏感性[48],用不同浓度的黄连素分别处理鼻咽癌CNE-2细胞不同时间之后,发现细胞中SP1的mRNA以及SP1蛋白表达量都呈时间和浓度依赖性降低,说明黄连素使鼻咽癌细胞对放射线的敏感性增加,对临床治疗鼻咽癌发挥辅助作用[49]。此外,肿瘤细胞中SP1的含量还可以通过细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号通路来调节。ERK可促进SP1磷酸化,避免其泛素化降解,增强其稳定性。而黄连素作用于ERK信号通路,抑制SP1磷酸化,增加SP1泛素化被降解的概率,降低其表达量,以此增加肿瘤细胞放射线敏感性[50]。
综上所述,黄连素可抑制埃兹蛋白磷酸化,抑制鼻咽癌细胞转移和侵袭、下调HIF-1α表达,抑制肿瘤血管新生、抑制STAT基因来促进鼻咽癌细胞凋亡,通过SP1和ERK信号通路来增加鼻咽癌细胞的放射线敏感性,从而使减慢肿瘤生长速度和改变其生活状态,可以在临床治疗鼻咽癌时加以辅助。
3 问题与展望
近几年,以肺癌为首的呼吸系统肿瘤发病和死亡人数越来越多,已严重威胁到人类健康,给患者带来身心上的痛苦,也使患者家庭承受着巨大的心理压力和经济压力。而临床上对于肿瘤的治疗多为手术切除、化疗及放疗,但容易发生侵袭和转移,出现治疗后复发等现象。而黄连素作为一种传统的小分子中药提取物,可特异性作用于呼吸系统肿瘤细胞,对健康细胞的影响极小。相比于化学药品,天然中草药来源比较广泛,并且更安全。黄连素对呼吸系统肿瘤的作用是抑制癌细胞迁移和侵袭、诱导其凋亡以及抑制其增殖等。此外,黄连素可同时作用于细胞内多种机制,使其协同发生作用,显著提高了黄连素治疗呼吸系统肿瘤的效率,且黄连素可以有针对性地作用于呼吸系统肿瘤细胞,而对正常细胞无害,所以黄连素及其衍生物的药用潜力十分巨大,有望在人类的医药事业中发挥巨大的作用,为治疗呼吸系统疾病开发新药物提供一个线索,为人类呼吸系统肿瘤治疗提供新的方法。
目前,国内外有大量研究发现,黄连素及其衍生物对多种呼吸系统肿瘤具有抑制作用,但仍有一些不足之处:首先,呼吸系统肿瘤除肺癌、喉癌和鼻咽癌外,还有气管癌和支气管癌,而黄连素单独作用或者与其他中药联合作用抗气管癌和支气管癌的研究鲜有报道。其次,黄连素及其衍生物抗呼吸系统肿瘤的研究是为了用于人体治疗,但体外实验以及目前的动物体内实验仍不足以完全模拟黄连素作用于人体的过程。最后,黄连素虽然可以对抗呼吸系统肿瘤,但仍未作为药物应用于临床实验。所以,黄连素及其衍生物对抗呼吸系统肿瘤的研究仍有待进一步完善。
基于此,本文总结了黄连素及其衍生物对抗呼吸系统肿瘤接下来的研究方向:首先,要研究黄连素及其衍生物对其他2种呼吸系统癌症气管癌和支气管癌的作用及机制,以完善黄连素对整个呼吸系统的作用和机制。其次,要同时加强体内研究和临床研究,进一步深入研究黄连素及其衍生物对人体的作用,有助于黄连素更好地用于临床治疗。最后,要研究黄连素及其衍生物的固定制剂并对剂型进行改革,加强黄连素与临床上呼吸系统肿瘤靶向药物联合作用的研究,将中药与西药结合,以期黄连素可以与靶向药物共同作用,辅助临床治疗。