泻白散治疗急性肺损伤作用机制的网络药理学研究*
2022-09-05陈金秀
陶 旺 陈金秀 陈 聪 吴 湘
(1.湖南中医药大学,湖南 长沙 410208;2.广州中医药大学,广东 广州 510000;3.广州中医药大学第二附属医院,广东 广州 510000)
急性肺损伤(ALI)是由各种肺内外致病因素引起的以肺泡上皮细胞和肺内毛细血管通透性增加,导致肺间质及肺泡弥漫性水肿,临床主要表现为咳嗽、进行性呼吸困难等一系列肺部感染及低氧血症[1]。中医典籍中并无ALI的记载,根据其临床表现可归为“咳嗽”“喘证”等范畴。其病机关键在于热毒壅肺、痰瘀互结;病理产物主要为痰、热、水、瘀等,病性属热[2]。中医药多途径多靶点的特点对于ALI的治疗有独特优势。明代医家李时珍[3]称之为“泻肺诸方之准绳”的泻白散,出自北宋·钱乙《小儿药证直诀·卷下诸方》。该方由桑白皮、地骨皮、甘草、粳米4味药组成,是治疗肺热喘咳的经典方剂。方中君药桑白皮,辛甘而寒,独入肺经,不仅能清热肃肺,尚可利水导火热从小便而出,且气薄质液不刚不燥,祛邪而不损正;臣药地骨皮,甘寒入肺肝肾经,既助桑白皮清降肺中伏火,又养阴生津止渴,退骨蒸除五心烦热;君臣相合,清肺热养肺阴,以达金清气肃之妙;甘草、粳米护胃调中,补脾益肺以培土生金,共为佐使药,使泻白散泻肺而不伤正,寒凉而不伤胃[4]。网络药理学是从基因靶点层面分析中药复方活性成分与疾病多靶点之间的相互作用,通过检索数据库以构建“药物-疾病-靶点”的网络图,并预测其治疗疾病的有效成分和机制通路。故本文通过网络药理学分析,筛选泻白散治疗ALI的相关分子机制,以期为泻白散治疗ALI提供一定的理论依据。
1 材料与方法
1.1 泻白散相关靶点筛选 在TCMSP(https://tcmspw.com/tcmsp.php)数据库[5]中,以“桑白皮”“甘草”和“地骨皮”为关键词检索相关有效成分信息,并以类药性(DL)≥0.18、口服生物利用度(OB)≥30%为条件对有效成分进行筛选。筛选结束后,在Uniprot(https://www.uniprot.org/)蛋白数据库中,限定物种为“Homo sapiens”,将所有靶点转化为基因名称,并剔除重复及无法检索的靶点,获得中药有效成分靶点。
1.2 ALI相关靶基因的确定 Genecards数据库自动整合了约150个网络资源的基因中心数据,包括基因组、蛋白质组、临床和功能信息。为获取疾病相关基因靶点,在Genecards数据库(https://www.genecards.org/)中,以“acute lung injury”为检索词进行检索,获得ALI疾病基因靶点。
1.3 泻白散与ALI疾病的PPI网络构建 为明晰泻白散相关靶点与ALI疾病靶点的相互作用,利用Venny 2.1取泻白散相关靶点与ALI疾病基因靶点的交集。进而将两者共同靶基因输入Cytoscape3.7.2中,借助bisogenet插件绘制泻白散成分-ALI靶点的PPI网络图,运用CytoNCA插件对该PPI网络进行相关拓扑分析,包括连接度(Degree)、介度(Betweenness)以及紧密度(Closeness),获得泻白散作用于该疾病的潜在蛋白质靶点,再分析其发展过程中的作用。
1.4 功能与通路的富集分析 Metascape平台为实验生物学家提供了全面的基因列表注释和分析资源[6]。将泻白散治疗ALI疾病的潜在基因导入Metascape平台,设置P<0.01,分析可能的生物学过程和代谢通路并进行富集分析,将相关数据用微生信平台进行可视化。
2 结 果
2.1 泻白散与ALI疾病相关靶点的获取 见表1。共获得桑白皮的有效成分32个,甘草的有效成分92个,地骨皮的有效成分13个。按照OB值大小排列,表1展示了排名前15的活性成分。从Genecards数据库中共获得223个疾病基因靶点,score值越高则代表该靶点与疾病联系越密切。
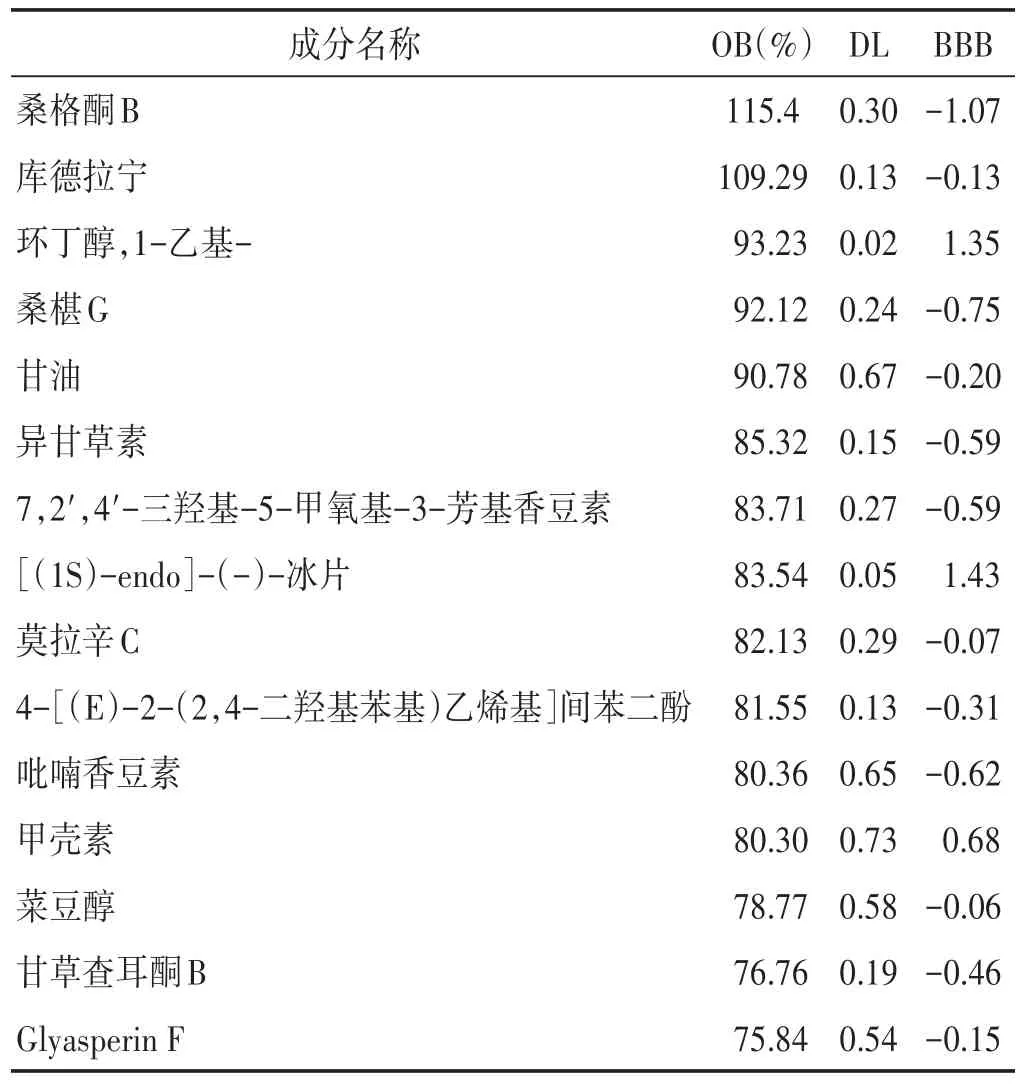
表1 泻白散的活性成分(排名前15)
2.2 泻白散有效成分网络图的构建 利用Cytoscrape 3.7.2构建“泻白散-有效成分-靶点”网络图(如图1),节点之间的连线代表药物与有效成分、有效成分和靶点之间的关系。有效成分对应的靶点越多,其形状也越大。图中A2、A3、B1为泻白散中联系最紧密的活性成分,分别为“quercetin槲皮素”“kaempferol山柰酚”“naringenin柚皮素”。基因序列MOL004328、MOL000449、MOL012681、MOL000296、MOL001792、MOL000239 所代表的基因靶点之间节点最多,连接最紧密,可能为泻白散发挥主要作用的关键靶点。
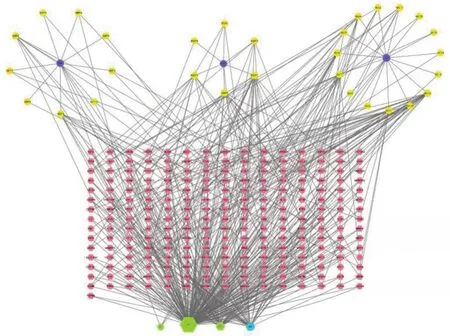
图1 泻白散-有效成分-靶点
2.3 泻白散成分-ALI靶点网络图构建 用Venny 2.1对活性成分靶点与ALI靶点取交集后,共得到194个共同靶点,即为泻白散治疗ALI的潜在靶点,包括PTGS1、CHRM3、SCN5A、PIK3CG等(如图 2)。使用Cytoscape3.7.2将泻白散与ALI的共同靶基因输入bisogenet插件中,绘制泻白散成分-ALI靶点PPI网络图,得到初始PPI网络共1 779个节点,58 260条边,节点(node)代表活性成分、靶点、药物及疾病名称。边(edge)代表各中药与活性成分、活性成分与靶点、疾病与靶点的相互作用关系。运用CytoNCA插件对该PPI网络进行相关拓扑分析,以 Degrees>56,Betweenness>1 241.2212,Closeness>0.086289056为筛选条件进一步精简PPI网络,得到339个节点,11 464条边,再进行二次筛选得到160个节点、3 958条边的PPI核心网络(如图3)。最终筛选得出6个核心靶点(如图4),药物与ALI相关核心蛋白包括 NPM1、TP53、COPS5、MCM2、CUL1、CUL3(如表2)。

表2 泻白散治疗ALI关键靶点(排名前5)
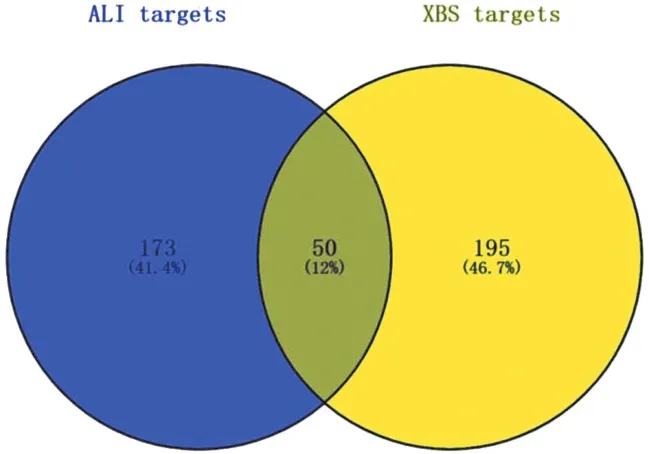
图2 泻白散活性成分靶点与ALI靶点venn图

图3 PPI网络拓扑分析

图4 PPI网络精简图
2.4 靶点功能与通路的富集分析 运用Metascape平台对泻白散治疗ALI疾病相关靶点进行信号通路分析,借助微生信平台进行数据可视化。泻白散治疗ALI疾病潜在通路主要包括靶向肿瘤细胞凋亡通路(Pathways in cancer)、丝裂原活化蛋白激酶(MAPK信号通路)、FoxO转录因子信号通路、cAMP信号通路、急性髓性白血病(acute myeloid leukemia通路)以及JAKSTAT信号通路、AMPK信号通路等(见图5),与调控炎症反应、抗氧化反应、介导细胞凋亡等功能密切相关。泻白散主要参与的生物学过程有激素反应(response to hormone)、细胞对氮化合物的反应(cellular response to nitrogen compound)、对无机物的反应(response to inorganic substance)、细胞对脂质的反应(cellular response to lipid)、对外来刺激的反应(response to xenobiotic stimulus)等(见图6);相关靶点调节血脂的功能主要富集于DNA结合转录因子结合(DNA-binding transcription factor binding)、蛋白质结构域特异性结合(protein domain specific binding)、脂质结合(lipid binding)、蛋白激酶活性(protein kinase activity)、氧化还原酶活性(oxidoreductase activity)、细胞因子受体结合(cytokine receptor binding)等。
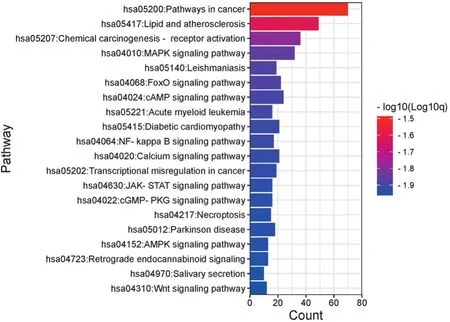
图5 泻白散-ALI KEGG通路分析
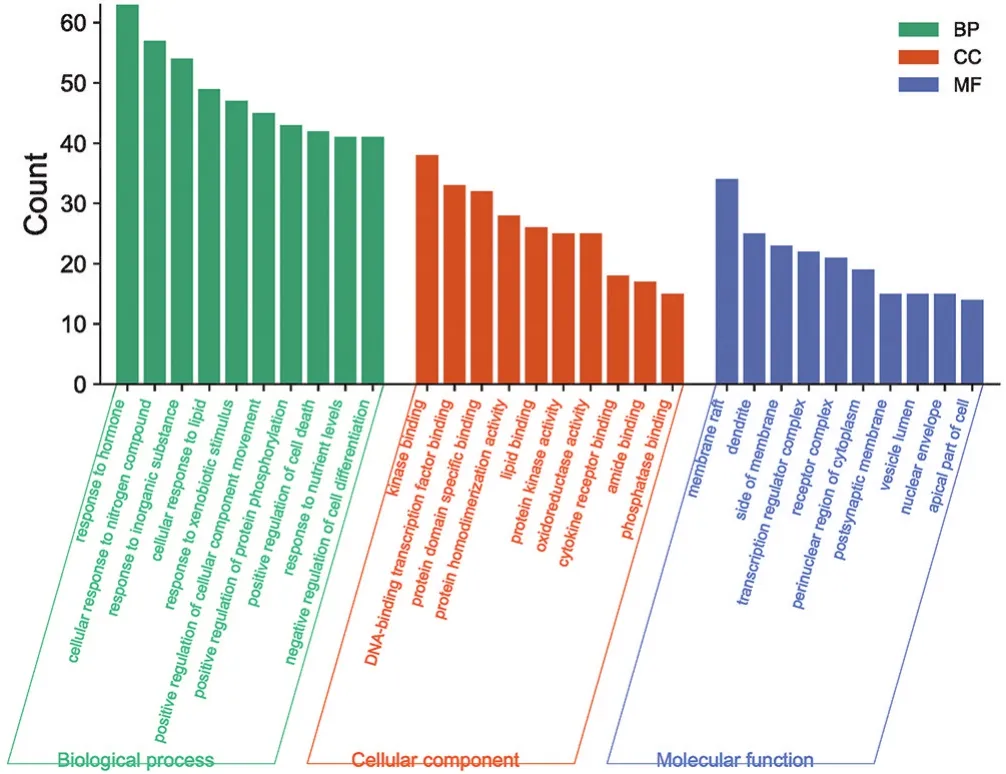
图6 泻白散-ALI GO功能富集分析
3 讨论
《小儿药证直诀·卷下诸方》记载泻白散“既可泻肺之实热,又可泻肺之虚热”,其配伍之妙主要在于桑白皮与地骨皮。首先,两者一清一透:桑白皮以清透为主,性寒能清肺热,辛又透肺中郁火,兼益元气固本;地骨皮既清实热又清虚热,两药配伍使之清而不伤正,透而不郁,滋而不腻。其次,两者一气一血:桑白皮走气分,清泄肺部实热;地骨皮走气血两分,王好古谓其能“降肺中伏火,清胞中火,退热”;又清血分之热,清热凉血止血,防肺热灼伤血络出血。最后,两皮配伍法:清代《成方便读·卷三》所言“桑白皮皮能行皮,根者入土最深;地骨皮直入黄泉,凉血退蒸”。邪气多从皮毛而入,郁闭肺气使肺失于宣降,皮能散表,故二皮运用取其象形思维,更有利于宣散邪气、畅达气机,可用于治疗肺中伏火所致皮肤蒸热、日晡尤甚之皮肤病。《本草害利》曰“地骨皮甘淡而寒,凉血清三焦,降肺中伏火,用地骨皮走表又走里”。中医学认为,ALI的临床表现与《黄帝内经》记载“故肺病者,喘息鼻张”“肺高者上气,肩息咳”相类似,在病机上与“热毒壅肺、痰瘀互结”密不可分。桑白皮与地骨皮两者配伍不仅散外邪又清肺热,表里兼顾;同时气血两清,防瘀血形成及出血等并发症。故泻白散对于治疗ALI从理论角度有一定治疗作用。
ALI的发病机制主要在于全身和肺内炎性细胞的持续激活、炎症与抗炎症介质的失衡以及氧化应激反应造成的一系列炎症风暴,治疗ALI首要关键是控制炎症。药理研究发现,泻白散中桑白皮总黄酮、桑白皮苷能拮抗5-羟色胺和致炎介质组胺、抑制肥大细胞释放炎性介质而起到抗炎作用[7];地骨皮水提取物在脂多糖刺激小鼠巨噬细胞中可显著降低脂多糖诱导的细胞内炎症介质、一氧化氮、前列腺素E2和促炎细胞因子、白细胞介素-1(IL-1)和IL-6的生成,从而发挥抗炎作用[8]。在通过鼻腔滴入LPS诱发的肺部组织病变中,甘草黄酮抑制TNF-α、IL-6、IL-1β等促炎因子的产生,而有显著的改善作用[9]。通过网络药理学基于基因靶点层面进一步分析发现,泻白散与ALI之间存在较多的共同靶点基因,网络连接紧密,中药活性成分以槲皮素、山柰酚、β-谷甾醇连接最多。三者对ALI的炎症反应及肺损伤均有保护作用,槲皮素[10]能抑制细胞凋亡和减少炎性细胞因子IL-6和TNF-α的产生;山柰酚[11]能够抑制促炎因子 NF-κB、IL-1β、TNF-α等的表达;β-谷甾醇[12]可防止肺组织气道炎症的发生,具有良好的抗炎及免疫调节作用。PPI蛋白互做分析,核心蛋白涉及TP53、CUL3、MCM2等,研究者发现TP53、CUL3表达细胞的比例与炎症强度相关,在ALI模型中CUL3、ERCC2、TP53等蛋白因子会显著增加[13-14]。
交集基于KEGG通路分析Fox O家族参与调节细胞增殖分化、代谢及凋亡等多过程,与炎症反应及氧化应激有关。何靖等[15]在脂多糖诱导的小鼠ALI模型中发现肺组织的FoxO1发生磷酸化,能上调肺组织中α亚基ENαC的表达,从而改善ALI的预后;丝裂原活化蛋白激酶(MAPK信号通路)主要包括p38 MAPK、ERK和JNK 3条经典的信号传导通路,均参与炎症因子的调控。侯帅红等[16]发现在小鼠ALI模型中MAPK家族中p-p38、p-ERK和p-JNK蛋白表达量也明显上升,说明MAPK信号通路与ALI的炎症反应起着重要作用。JAK2/STAT3信号通路与细胞增殖、炎症基因的调控密切相关[17],石青青等[18]发现通过抑制该通路能有效抑制ALI触发的炎症反应,及时遏制炎症风暴。
综上所述,泻白散虽药物精简,但配伍巧妙、内涵丰富,临床上经加减广泛运用于多系统疾病。从网络药理学基因靶点与生物信息相结合,预测泻白散治疗ALI的有效成分-靶点-通路机制,发现泻白散可能通过槲皮素、山柰酚、β-谷甾醇等有效成分,与TP53、CUL3、MCM2等蛋白结合,通过MAPK、FoxO、cAMP或JAK-STAT等信号通路调节细胞代谢以及参与炎症反应,从而一定程度上抑制ALI。研究结果也进一步论证中医药多途径、多靶点治疗疾病,这与中医整体观念和辨证论治也相符合,同时为中医治疗ALI提供参考与新思路。
