快速响应组氨酸的铱(Ⅲ)配合物荧光探针
2022-09-05沈舒婷王亚轩谷晓霞
王 慧,胡 磊,沈舒婷,于 坤,王亚轩,谷晓霞
皖南医学院 药学院,安徽 芜湖 241002
0 引 言
金属配合物因其优良的光物理性质,如斯托克斯位移较大、光稳定性好、损伤阈值高、光学寿命长、量子产率高和发光波段易调节等优势,在生物成像、化学传感、有机发光二极管、光动力学治疗和抗肿瘤等多个领域有着广泛应用[1~3]。在众多金属配合物中,环金属铱配合物(cyclometalated iridium complex)因磷光寿命短、量子产率高、激发态丰富,且其光物理化学性质在环境或辅助配体改变时易呈现多种响应,从而受到国内外学者的青睐[4,5]。目前,铱配合物已被广泛用于检测阳离子(如Pb2+、Ag+、Hg2+等)、阴离子(如F-、Cl-、ClO-等)、氨基酸(如半胱氨酸、核苷酸、高半胱氨酸)、氧分子、pH 值等[6,7]。铱配合物荧光探针与有机分子荧光探针相比,可检测的物质范围较小,如在氨基酸检测中,铱配合物荧光探针大多用于检测半胱氨酸和高半光氨酸[8,9],而对于组氨酸的检测还鲜见报道。组氨酸(histidine,His)作为一种人体必需氨基酸和神经递质,在人体生理活动中有着重要作用。组氨酸水平异常与一些疾病有关,如慢性肾疾病、急性肝衰竭等[10]。因此,开发对组氨酸响应快、灵敏度高的铱配合物探针仍具有挑战性和潜在应用价值。
鉴于此,本文以苯并噻唑为母体,以弱配位能力的乙腈分子作为受体单元,引入不同的末端基团,设计合成了两种铱配合物探针(IrSN1 和IrSN2),并借助质谱研究了探针响应组氨酸的机理,借助荧光光谱研究了探针对组氨酸的识别性质。此外,本文还考察了探针IrSN1 用于细胞成像的可行性。
1 实验部分
1.1 试剂及仪器
试剂:对羟基苯甲醛(98%)、2-氨基苯硫酚(96%)、三氯化铱(Ir>52%)、4-(三氟甲基)苯甲醛(97%)、硝酸银(99.8%)、四丁基溴化铵(99%)、二乙二醇单甲醚(99%)、对甲苯磺酰氯(99%),其他试剂为分析纯,购自阿拉丁试剂有限公司,实验用水为超纯水。
仪器:Bruker Avance 400 型磁共振仪(Bruker公司,TMS 为内标),UV-5900PC 型紫外分光光度计(上海元析仪器有限公司),F-4600 型荧光分光光度计(HITACHI 公司),Nicolet FT-IR-is5 型傅里叶 变换红外光谱仪(Thermo Fisher 公司,KBr 压片),Aglient 7250& JEOL-JMS-T100LP AccuTOF型高分辨质谱仪(Agilent 公司),TCS SP8 型激光共聚焦显微成像仪(Leica 公司),Infinite 200 pro 型酶标仪(Tecan 公司)。
1.2 铱配合荧光探针IrSN1 和IrSN2 的合成与表征
铱配合物探针IrSN1,IrSN2 的合成路线如图1所示。
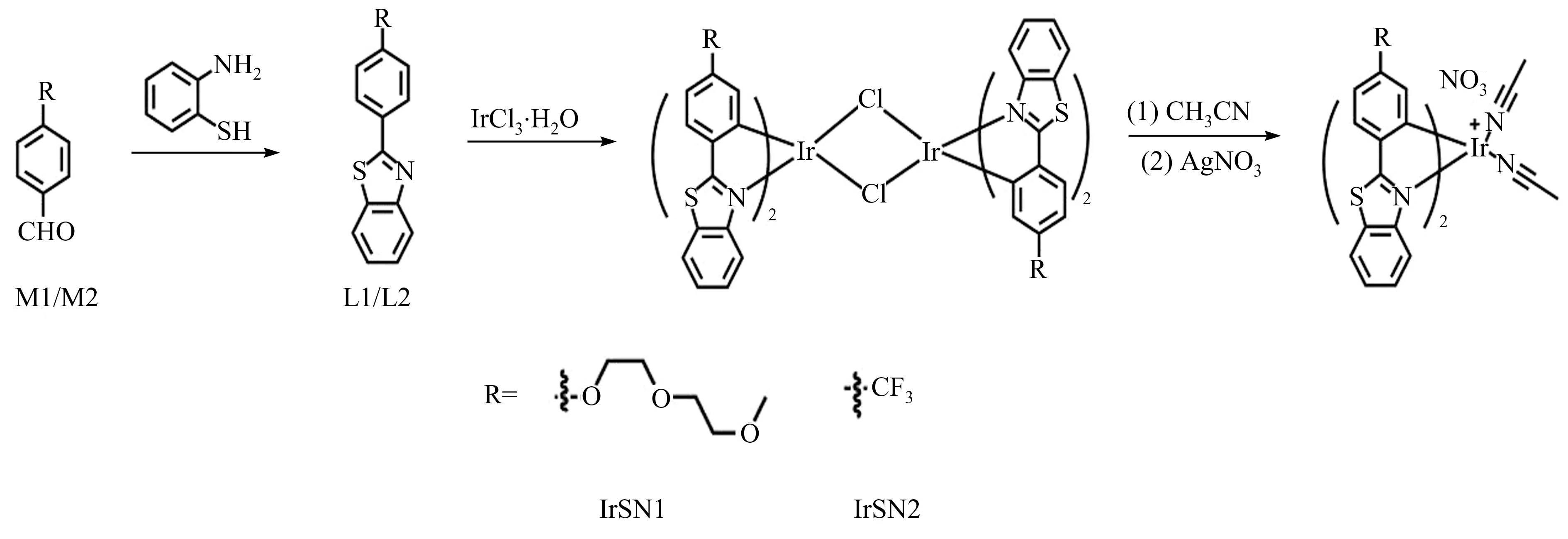
图1 探针IrSN1,IrSN2 的合成路线Fig.1 The synthesis routes of probes IrSN1 and IrSN2
1.2.1 配体L1 的合成与表征
在100 mL 圆底烧瓶中,依次加入中间体4-(2-(2-甲氧基乙氧基)乙氧基)苯甲醛(M1)[11](2.24 g,10 mmol)、2-氨基苯硫酚(1.25 g,10 mmol)和15 mL 无水乙醇,加热回流6 h 后,减压蒸出大部分乙醇,冷却至室温,加入少量甲醇分散,析出淡黄色固体,减压过滤,收集滤饼,真空干燥,得淡黄色固体L1(2.23 g),产率67%,磁共振氢谱(1H NMR,400 MHz,d6-DMSO)化学位移值δ:8.11(d,J=7.8 Hz,1H),8.03(t,J=6.3 Hz,3H),7.53(t,J=7.6 Hz,1H),7.43(t,J=7.6 Hz,1H),7.13(d,J=7.7 Hz,2H),4.19(m,2H),3.78(m,2H),3.61(m,2H),3.48(m,2H),3.25(s,3H)。
1.2.2 配体L2 的合成与表征
在100 mL 圆底烧瓶中,依次加入4-(三氟甲基)苯甲醛(M2)(1.74 g,10 mmol)、2-氨基苯硫酚(1.25 g,10 mmol)和15 mL 无水乙醇,加热回流反应6 h 后,冷却至室温,析出淡黄色固体,减压过滤,收集滤饼,真空干燥,得淡黄色片状固体L2(1.87 g),产率64%,1H NMR(400 MHz,d6-DMSO)化学位移值δ:8.32(d,J=8.1 Hz,2H),8.22(d,J=7.9 Hz,1H),8.14(d,J=8.1 Hz,1H),7.95(d,J=8.2 Hz,2H),7.61(t,J=7.6 Hz,1H),7.53(t,J=7.5 Hz,1H)。
1.2.3 IrSN1 和IrSN2 的 合 成 与 表 征
氩气保护下,在避光的100 mL 三口烧瓶中,依次加入IrCl3·3H2O(0.70 g,2 mmol)和相应配体L1或L2(4 mmol),溶 剂 为15 mL 乙 二 醇 单 乙 醚 和5 mL 水的混合溶剂,110oC 反应24 h,冷却至室温,析出固体,减压过滤,收集滤饼用乙醇重结晶,得相应的中间体铱二氯聚物。氩气保护下,在避光的100 mL 三口烧瓶中,依次加入中间体铱二氯聚物(0.163 mmol)、硝酸银(0.07 g,0.326 mmol)和30 mL 乙腈,加热回流24 h 后,冷却至室温,减压过滤,除去生成的氯化银,收集滤液,蒸馏浓缩滤液后,加入少量二氯甲烷,有固体(为过量的硝酸银)析出,减压过滤,收集滤液,蒸出溶剂得相应的产物IrSN1或IrSN2。
IrSN1为紫黑色固体,0.10 g,收率62%。1H NMR(400 MHz,d6-DMSO)数据:8.77(m,2H),8.32(m,3H),7.71(m,7H),6.56(m,2H),3.75(m,4H),3.51~3.41(m,16H),3.17~3.11(m,8H),2.08(s,8H)。磁共振碳谱13C NMR(101 MHz,d6-DMSO)数据:178.23,158.49,148.47,132.12,129.48,126.41,123.79,122.06,118.09,116.43,105.72,69.31,67.97,66.62,64.96,56.33。高分辨质谱(ESI-MS):理论值993.2964,实验值890.1895[M-NO3--CH3CN]+。IrSN2 为橘红色固体,0.11 g,收率78%。1H NMR(400 MHz,d6-DMSO)数据:8.89(d,J=8.3 Hz,2H),8.50(d,J=8.0 Hz,2H),8.06(d,J=7.9 Hz,2H),7.80(m,4H),7.23(t,J=9.5 Hz,2H),6.24(s,2H),2.09(s,6H)。13C NMR(101 MHz,d6-DMSO)数 据:177.97,148.07,143.49,138.84,130.24,128.30,128.00,127.19,127.05,125.34,122.72,119.01,117.69,116.45。ESI-MS数据:理论值893.055 2,实验值791.042 3[MNO3--CH3CN+1]+。
1.3 荧光光谱测定
探针IrSN1 和IrSN2 用二甲基亚砜溶解,配制成浓度为1.0×10-3mol/L 的母液。选取牛血清白蛋白(BSA)、组蛋白(Histone)、谷胱甘肽(GSH)、焦磷酸钠(ppi)以及16 种氨基酸(L-半胱氨酸(Cys)、L-苯丙氨酸(Phe)、L-丙氨酸(Ala)、L-谷氨酸(Glu)、L-谷氨酰胺(Gln)、L-精氨酸(Arg)、L-赖氨酸(Lys)、L-络氨酸(Tyr)、L-亮氨酸(Leu)、L-脯氨酸(Pro)、L-色氨酸(Try)、L-丝氨酸(Ser)、L-苏氨酸(Thr)、L-缬氨酸(Val)、L-异亮氨酸(Iso)、L-组氨酸(His))作为分析物来源,其中BSA、组蛋白的浓度为5 mg/mL,其余分析物的浓度为1.0×10-2mol/L。分别移取50 μL 探针溶液和200 μL 上述各种分析物,置于5 mL 的容量瓶中,用DMF/PBS(体积比2/3)的混合溶液定容。荧光光谱测试条件:激发波长为405 nm,狭缝宽度均为10.0 nm,电压为500 V。
1.4 细胞毒性测试与细胞成像方法
细胞毒性测试:采用3-(4,5-二甲基噻唑-2)2,5-二苯基四氮唑溴盐(MTT)法研究探针IrSN1 对人肝癌细胞株(HepG2 细胞)的毒性。在37oC,5%CO2条件下,将可传代HepG2 细胞接种于96 孔细胞培养板中,待细胞生长至密度85%左右时,移去孔中培养基,加入提前配制好的含不同浓度IrSN1 探针的培养基溶液,每孔加入溶液体积为100 μL,探针终浓度分别为4、8、10、15、20、25 μmol/L,同时设置对照组和调零组,每组设3 组平行实验。与细胞共培养24 h 后,每孔加入10 μL MTT 溶液(10 mg/mL),继续孵育4 h。移去孔中培养基,每孔加入100 μL 二甲基亚砜溶液,恒温低速振荡10 min,用酶标仪测定490 nm 波长处每个孔中溶液吸光度值。
细胞成像测试:将HepG2 细胞接种于共聚焦小皿中,待皿内细胞生长至密度50%左右时,将探针IrSN1(20 μmol/L)溶液加入到小皿中,与细胞共培养不同时间后,用磷酸盐缓冲液(PBS)清洗两遍,直接用于显影。
2 结果与讨论
2.1 探针设计及反应机理研究
在分子设计中,以弱配位能力的乙腈分子作为辅助配体,在配体中引入醚氧链和三氟甲基作为不同的供吸电子基团,考察不同结构单元对探针识别组氨酸的影响。根据文献报道[12],在探针溶液中加入组氨酸后,组氨酸中咪唑环上的N 原子和氨基中的N 原子可与Ir 配位形成相应的产物。基于此,利用高分辨质谱研究了探针与组氨酸作用后的产物,结果如图2 所示。探针IrSN1 和IrSN2 与组氨酸结合后,在质谱图中发现一个与产物相对应的峰,峰位分别在1 004.233 6 和904.083 5,表明这两种探针中的乙腈分子已被组氨酸取代并形成了相应的产物。2021 年,Kostko 等[13]研究了水溶液中组氨酸的局部电子结构,发现在pH 7.0 时,胺基氮被质子化,羧基碳被去质子化,形成两性离子结构。因此,我们推测探针与组氨酸结合后的配位模式如图3 所示,当探针中的乙腈分子被组氨酸取代后,组氨酸中的羧基以羧酸根离子形式存在。
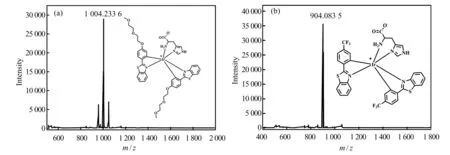
图2 探针IrSN1(a)和IrSN2(b)与组氨酸作用后的质谱图Fig.2 MS spectra of probes IrSN1 (a)and IrSN2 (b)in the presence of excess His

图3 推测的探针IrSN1 和IrSN2 与组氨酸的作用机理Fig.3 The possible mechanism of probes IrSN1 and IrSN2 reacting with His
为进一步理解探针对组氨酸的光学响应,通过激发态密度泛函理论研究了探针与组氨酸反应前后的分子轨道能级图。理论计算采用Gaussian09程序包,对于激发态的优化及荧光光谱的计算采用6-31g 基组(对于C、H、O、N、S、F 原子)及Lanl2dz基组(对于Ir 原子),实验结果如图4 所示。根据计算,探针IrSN1 和IrSN2 的发射峰分别位于524 nm和549 nm,是最高占据分子轨道(HOMO)到最低未占分子轨道(LUMO)跃迁,轨道间能级差ΔE分别为2.336 4 eV 和2.259 8 eV,振子强度f分别为0.001 0 和0.002 4,其中,HOMO 轨道电子云主要集中在配体L1 或L2 上,LUMO 轨道电子云主要集中在辅助配体乙腈分子上,可归属于配体与配体之间(L1L2CT,此处L1代表配体L1 或L2,L2代表辅助配体乙腈)的跃迁。探针IrSN1、IrSN2 与组氨酸反应后,分别形成新的化合物IrSN1+His 和IrSN2+His。根据计算,IrSN1+His 的荧光发射峰位于537 nm,为HOMO-1 到LUMO 跃迁,ΔE=2.306 0 eV,f=0.012 0,其中,HOMO-1 轨道电子云主要集中在配体L1 和铱原子上,LUMO 轨道电子云主要集中在组氨酸上,是金属到配体(MLCT,此处M 代表金属铱原子,L 代表配体L1)和配体与配体之间(L1L2CT,此处L1代表配体L1,L2代表组氨酸)的混合跃迁;IrSN2+His 的荧光发射峰位于571 nm,为HOMO 到LUMO+2 跃 迁,ΔE=2.172 4 eV,f=0.010 9,其中,HOMO 轨道电子云主要集中在组氨酸分子上,LUMO+2 轨道电子云主要集中在铱原子和配体L2 上,是配体与配体(L1L2CT,此处L1代表组氨酸,L2代表配体L2)和配体到金属之间(LMCT,此处L 代表组氨酸,M 代表金属铱原子)的混合跃迁。探针与组氨酸反应前后电子云的转移以及振子强度的提高,有助于提高配合物的荧光强度。

图4 探针IrSN1(a)和IrSN2(b)与组氨酸反应前后的分子轨道能级图Fig.4 The molecular orbitals distributions of probes IrSN1 (a)and IrSN2 (b)before and after the reaction with His
2.2 探针对组氨酸的选择性和动力学研究
首先测试了探针IrSN1 和IrSN2 在DMF/PBS(体积比2/3)溶液中的紫外-可见吸收光谱。由图5(a)可知,探针IrSN1 和IrSN2 在280~380 nm 之间有强吸收峰,在380~550 nm 之间吸收峰相对较弱,可归因于配体内π-π*跃迁以及混合的单线态和三线态的金属-配体电荷转移(1MLCT 和3MLCT)。以405 nm 为激发波长,考察了在DMF/PBS 溶液中探针IrSN1 或IrSN2 与20 倍当量的组氨酸作用前后的荧光光谱。如图5(b)所示,在探针溶液中加入组氨酸后,探针IrSN1 和IrSN2 的荧光强度分别增强了约4.5 倍和1.5 倍。与IrSN2 相比,探针IrSN1 的荧光强度增强更为明显,表明探针IrSN1 对组氨酸的识别性能更强。
进一步考察了探针IrSN1 对组氨酸的特异性识别能力。在DMF/PBS 溶液中加入组氨酸或20 倍当量的其他分析物(包括15 种氨基酸、牛血清白蛋白(BSA)、组蛋白、ppi、谷胱甘肽(GSH)),检测荧光强度比值的变化。如图5(c)所示,只有组氨酸的加入才会引起探针IrSN1 的荧光强度发生明显变化,而其他分析物的加入并没有引起明显的荧光强度变化,表明探针IrSN1 对组氨酸具有较好的选择性。
本文还考察了探针IrSN1 识别组氨酸的速度。在10 μmol/L 探针IrSN1 溶液中加入20 倍当量的组氨酸后,每间隔1 min 扫描一次荧光光谱,取537 nm处的荧光强度值绘制动力学曲线。如图5(d)所示,探针在537 nm 处的荧光强度随时间的增加而逐渐增强,在15 min 时探针的荧光强度达到最大并趋于稳定。与 已报道探 针[12,14]相比,探 针IrSN1 对组氨酸的响应更快。
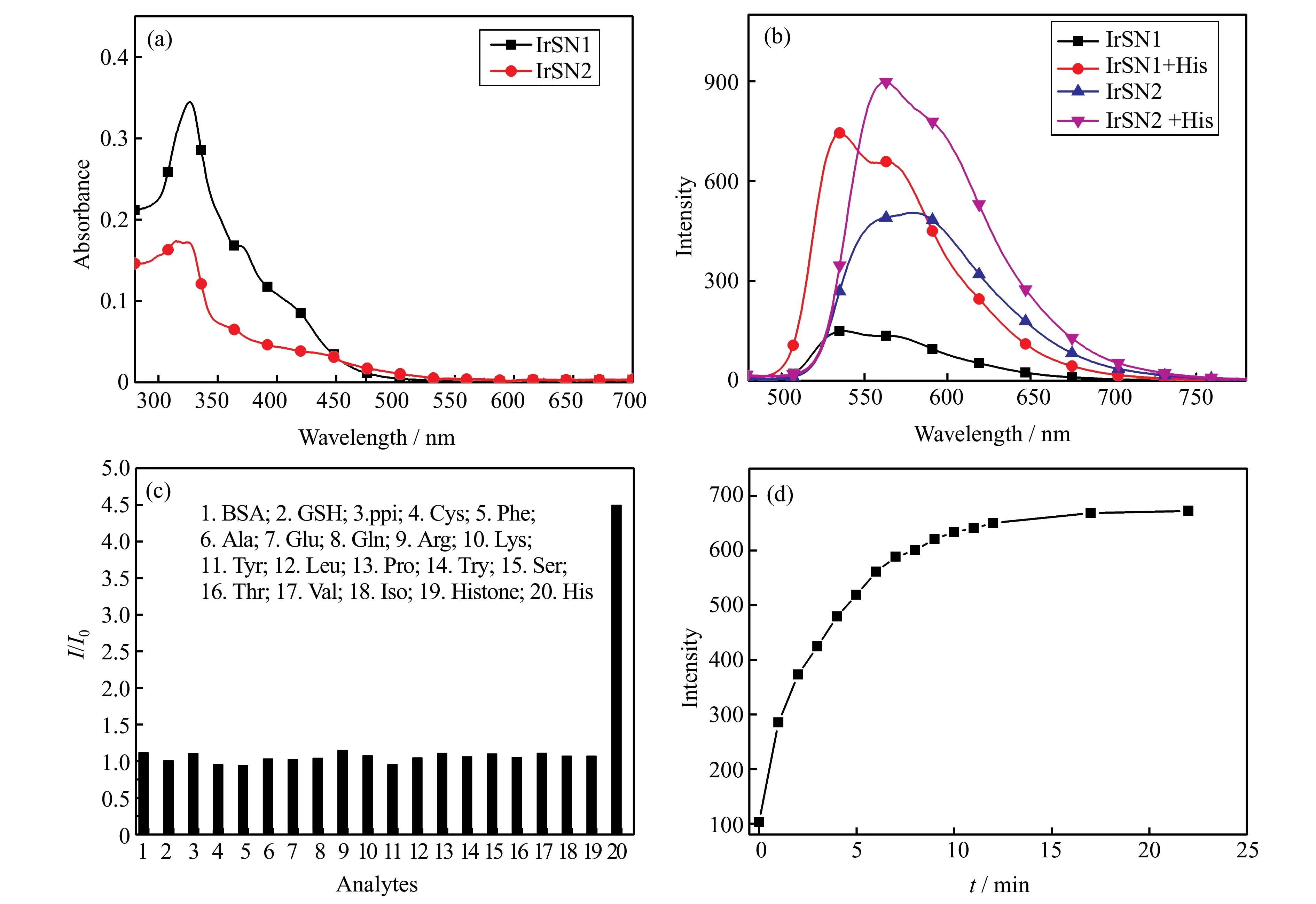
图5 (a)探针IrSN1 和IrSN2 的紫外-可见吸收光谱;(b)探针IrSN1 和IrSN2 与组氨酸作用前后的荧光光谱;(c)探针IrSN1 与不同分析物作用后的荧光强度比值变化;(d)探针IrSN1 与组氨酸作用的动力学曲线Fig. 5 (a)UV-Vis absorption spectra of probes IrSN1 and IrSN2;(b)fluorescence spectra of probes IrSN1 and IrSN2 before and after reaction with His;(c)the fluorescence intensity change ratio of probe IrSN1 after adding various analytes;(d)kinetic curves of the interaction between probe IrSN1 and His
2.3 探针对组氨酸的检测
图6(a)为探针IrSN1 与不同浓度组氨酸作用后的荧光发射光谱图。可以看出,探针IrSN1 的荧光强度随着组氨酸浓度的增加逐渐增强,当组氨酸的浓度达到2.5×10-4mol/L 时,探针IrSN1 的荧光强度趋于稳定。以组氨酸的浓度为横坐标、探针IrSN1在537 nm处荧光强度为纵坐标作图,结果如图6(b)所示。探针IrSN1 的荧光强度与组氨酸的浓度在0~2.5×10-4mol/L 范围内呈现出良好的线性关系,线性回归方程为y=2.38×106x+137.55,相关系数R2=0.992 6,利用公式3σ/斜率[15](斜率=2.38×106)计算探针IrSN1对组氨酸的检出限为9.67 μmol/L。

图6 (a)探针IrSN1 与不同浓度的组氨酸作用后的荧光光谱;(b)探针IrSN1 的荧光强度值与组氨酸浓度间的线性关系Fig.6 (a)Fluorescence spectra of probe IrSN1 upon the addition of His with different concentration;(b)fluorescence titration curves of probe IrSN1 with the concentration of His 1-21:0, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 μmol/L
2.4 探针IrSN1 的细胞成像
采用MTT 法考察了探针IrSN1 对HepG2 细胞的细胞毒性。不同浓度(4、8、10、15、20、25 μmol/L)探针IrSN1 溶液与HepG2 细胞共培养24 h 后,细胞存活率均高于80%,表明探针IrSN1 细胞毒性较低,适用于细胞成像研究。
利用共聚焦显微镜评估了探针IrSN1 对HepG2细胞内组氨酸的检测能力。将探针IrSN1(10 μmol/L)与HepG2 细胞在37oC 下共培养不同时间(0、15、30、40、60 min)后,用PBS 清洗3 次,直接进行共聚焦显微成像,结果见图7。由图7 可知,当共培养时间小于15 min 时,细胞内的荧光主要来源于细胞质区域;当共培养时间超过30 min 时,可在整个细胞区域观察到较强荧光信号。这说明随着时间延长,探针IrSN1 与细胞内组氨酸结合越多,导致细胞内荧光信号增强。
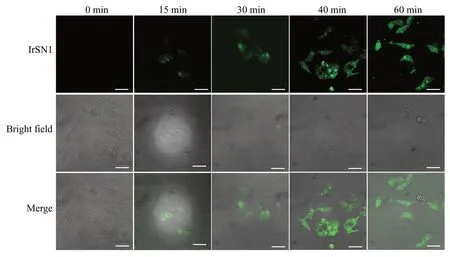
图7 探针IrSN1 与HepG2 细胞共孵育不同时间的细胞成像图(标尺:20 μm)Fig.7 Cell imaging of HepG2 cells incubated with probe IrSN1 for different time(scale bar:20 μm)
3 结 语
本文设计、合成了两种荧光增强型铱配合物探针IrSN1 和IrSN2,并将IrSN1 用于组氨酸的检测及细胞内成像。结果表明,探针中的乙腈分子可被组氨酸取代并参与配位,形成一种新的配合物。与探针IrSN2 相比,探针IrSN1 对组氨酸的响应具有更高的灵敏度。在DMF/PBS 混合溶液中,探针IrSN1 对组氨酸的检出限为9.67 μmol/L,其荧光强度能在15 min 内达到最大并趋于稳定,同时还能够克服BSA、组蛋白、ppi、GSH 和其他15 种氨基酸等多种分析物的干扰,具有较好的选择性。另外,探针IrSN1 细胞毒性较低,能够全部着色细胞,可用于细胞内组氨酸的成像分析。该实验结果可望为设计、合成识别组氨酸的铱配合物探针提供实验依据。
