基于两种荧光染料的内标比率型荧光探针检测水体中银离子
2022-09-05熊威威李文恒向东山
汪 鹏,熊威威,李文恒,翟 琨†,向东山†
1. 湖北民族大学生物资源保护与利用湖北省重点实验室,湖北恩施445000;2. 湖北民族大学化学与环境工程学院,湖北恩施445000
0 引 言
银(silver,Ag)是一种重要的过渡金属,广泛应用于医药、电子、摄影、化妆品等领域[1]。Ag+是银在自然界中一种常见的存在形式,在低浓度时具有很强的抗菌活性[2],可以通过抑制游离巯基蛋白酶的活性抑制其生物学功能。随着银在各个领域的广泛应用,排放到自然界中的Ag+越来越多,Ag+进入到水和土壤后,可以被植物根系吸收,再通过食物链进入人体,对人类健康构成威胁。据报道,人体内Ag+过多会导致精氨酸缺乏症,还会对脑部、皮肤、眼睛、肝脏、肾脏和肠道造成损害[3]。因此,建立简单、快速且准确的Ag+定量检测方法具有十分重要的意义。
分子荧光定量检测法具有选择性好、灵敏度及准确度高、检测速度快等优点,因此基于分子荧光分光光谱法对Ag+的检测近年来引起了国内外科研工作者的较多关注[1,4,5]。但目前的工作多是利用单一发射波长的荧光信号对Ag+进行定量检测,测定结果受环境因素影响较大,检测结果的重复性较差。比率型荧光探针是一种通过两个荧光信号强度比值的变化实现对目标物的定量检测的方法,检测结果受环境因素影响小,方法重复性更好、准确度更高[6~8]。目前,基于比率型荧光探针对Ag+进行定量检测已有报道:Lu 等[9]利用离子印迹比率荧光探针实现了对Ag+的定量检测;Jiao 等[10]利用无标记的比率荧光碳点实现了对Ag+的定量检测;Li等[11]合成一种硫黄素T 的有机/无机杂化纳米材料实现了Ag+的比率荧光定量检测。但这些方法还存在一些不足之处:一是需要合成纳米材料或有机物作为荧光探针,且合成过程较为复杂;二是荧光探针所产生的信号强度较弱,不适于Ag+的痕量检测。
核酸适配体(aptamer)是一种能特异性识别相应靶标分子的单链核酸[12,13]。据报道,Ag+的核酸适配体已被筛选出来且得到了较多应用[14~17]。SG(SYBR GreenⅠ)是一种非常灵敏的核酸染料,在水溶液中的背景荧光很弱,但与双链DNA(dsDNA)结合后荧光信号会显著增强[18,19]。本文拟利用荧光染料TAMRA 标记的核酸适配体及核酸染料SG 构建一种能特异性识别Ag+的比率型荧光探针,实现对Ag+高选择性的定量检测。
1 实验部分
1.1 主要仪器及试剂
仪器:RF-5301PC 型分子荧光光谱仪(Shimadzu公司),AA800 型原子吸收光谱仪(Perkin-Elmer 公司)及Ethos Plus 型微波消解系统(Milestone公司)。
试剂:硝酸银(AgNO3)为优级纯,其他化学试剂均为分析纯,购于国药集团化学试剂有限公司;SG 生物试剂原液(上海瑞安生物技术有限公司)是用无水二甲基亚砜(DMSO)配制的10 000 倍浓缩液,使用时用双蒸水稀释10 000 倍配制成工作液;缓冲溶液为0.1 mol/L 的Tris-HNO3缓冲溶液(50 mmol/L NaNO3,pH 7.8);荧光染料TAMRA 标记的Ag+核酸适配体委托上海生工生物技术有限公司合成,其核苷酸碱基序列为:5′-TCTC TCT TCT CTT CAT AAA TCA ACA CAA CAC ACA-(CH2)6-TAMRA-3′(斜体部分为Ag+的适配体);实验用水均为双蒸水。
1.2 荧光探针的制备
将TAMRA 标记的Ag+核酸适配体用0.1 mol/L Tris-HNO3缓冲溶液配制成浓度为5×10-7mol/L 的储备液。先将50 μL 不同浓度(4×10-8~2.4×10-6mol/L)的AgNO3溶液加入到50 μL 5×10-7mol/L TAMRA 标记的核酸适配体中,再加入100 μL SG工作液,最后加入Tris-HNO3缓冲溶液至终体积为500 μL,混合均匀,用水浴锅加热至35 ℃,反应9 min。停止反应,冷却至常温后测定体系的荧光强度。在优化实验条件时,TAMRA 标记的核酸适配体浓度均为5×10-8mol/L,Ag+的浓度均为2.4×10-7mol/L。
1.3 水样的采集与消解
自来水样取自湖北民族大学生物资源保护与利用湖北省重点实验室,天然矿泉水样取自湖北省恩施市龙洞河源头,取样时间均为2019 年10 月8 日中午。自来水取样时,先放水5 min 后再采集,天然矿泉水在水深20 cm 处采集水样,所取水样清澈透明、无色、无悬浮杂质和沉淀,水样带回实验室后冷藏保存。水样的消化步骤为:准确量取10 mL 水样于消解罐中,加入6 mL 浓HNO3和4 mL H2O2,置于微波消解系统中进行消解。消化的升温程序为:先加热到120 ℃保持30 min,再升温到140 ℃保持20 min,最后升温至180 ℃保持20 min,消解完成后自然冷至室温。将消解液转移至100 mL 容量瓶中,用1% 稀HNO3洗涤消解罐2~3 次,将洗涤液也倒入容量瓶中,然后定容至100 mL,摇匀,待测。
1.4 Ag+的检测
Ag+的检测通过测定SG 与TAMRA 荧光强度比值(ISG/ITAMRA)的变化来实现。SG 与TAMRA 的荧光信号采用同步荧光分析法测定。TAMRA 的最大发射波长(584 nm)与最大激发波长(560 nm)之差(Stokes 位移)为24 nm[20],SG 最大发射波长(525 nm)与最大激发波长(499 nm)之差为26 nm[21],它们的Stokes 位移很接近,可通过同步荧光分析法同时获得它们的荧光信号。为了使两种荧光染料同时获得较好的荧光信号,本实验将同步扫描的波长间隔(Δλ)设置为25 nm,激发及发射狭缝的宽度均设置为10 nm。利用火焰原子吸收分光光度法测定Ag+时,先对样品浓缩50 倍后再检测。
1.5 方法的选择性实验
本实验主要考察水样中常见的金属离子和水样消解后有可能与Ag+发生反应的阴离子对测定结果的影响。具体步骤为,在一系列Ag+浓度为2.0×10-7mol/L 的溶液中分别加入浓度为2.0×10-5mol/L 的Na+、K+、Ca2+、Mg2+、Hg2+、Mn2+、Cd2+、Cu2+、Ni2+、Fe3+、Cr3+、Al3+、SO42-及PO43-溶液,然后在相同的条件下与浓度为2.0×10-7mol/L的Ag+溶液(CK)进行对照实验。
2 结果与讨论
2.1 检测方法的原理
利用荧光染料标记的核酸适配体及核酸染料SG 检测Ag+的基本原理如图1 所示。该方法中,在Ag+核酸适配体的3′端标记了荧光染料TAMRA,在没有目标物Ag+存在时,TAMRA 标记的核酸适配体呈单链状态,与SG 几乎不发生作用,因此体系中SG 的荧光信号很弱。在有Ag+存在时,TAMRA标记的核酸适配体中的C 碱基(胞嘧啶)通过“CAg+-C”特异性结合形成双螺旋结构(双链DNA),SG 可进入双链DNA 的双螺旋小沟区域并与之结合,导致体系中SG 的荧光强度显著增强。溶液中Ag+越多,与TAMRA 标记的核酸适配体反应后得到的双链DNA 就越多,与双链DNA 结合的SG 也就越多,作用后SG 的荧光也就越强。但荧光染料TAMRA 在适配体与Ag+反应前后荧光强度不会发生变化,即荧光染料TAMRA 的荧光强度与溶液中Ag+的浓度没有关系。因此,可通过SG与TAMRA荧光强度比值(ISG/ITAMRA)的变化实现对Ag+的定量检测。

图1 基于比率型荧光探针对Ag+检测的基本原理Fig.1 The basic principle of detection for silver ion based on ratiometric fluorescent probe
2.2 实验条件的优化
2.2.1 SG 工作液用量
在反应温度为35 ℃、反应时间为9 min 及缓冲溶液的pH 值为7.8 的条件下,考察了体系中Ag+浓度为2.4×10-7mol/L 时加入SG 工作液的用量对测定结果的影响。结果(图2)表明,当SG 的用量小于70 μL 时,ISG/ITAMRA随着SG 用量的增加而增大,当SG 工作液的体积达到70 μL 后,继续增加SG 工作液的体积,ISG/ITAMRA几乎不再发生变化。为保证SG 工作液相对过量,本实验选择加入的SG 工作液的体积为100 μL。
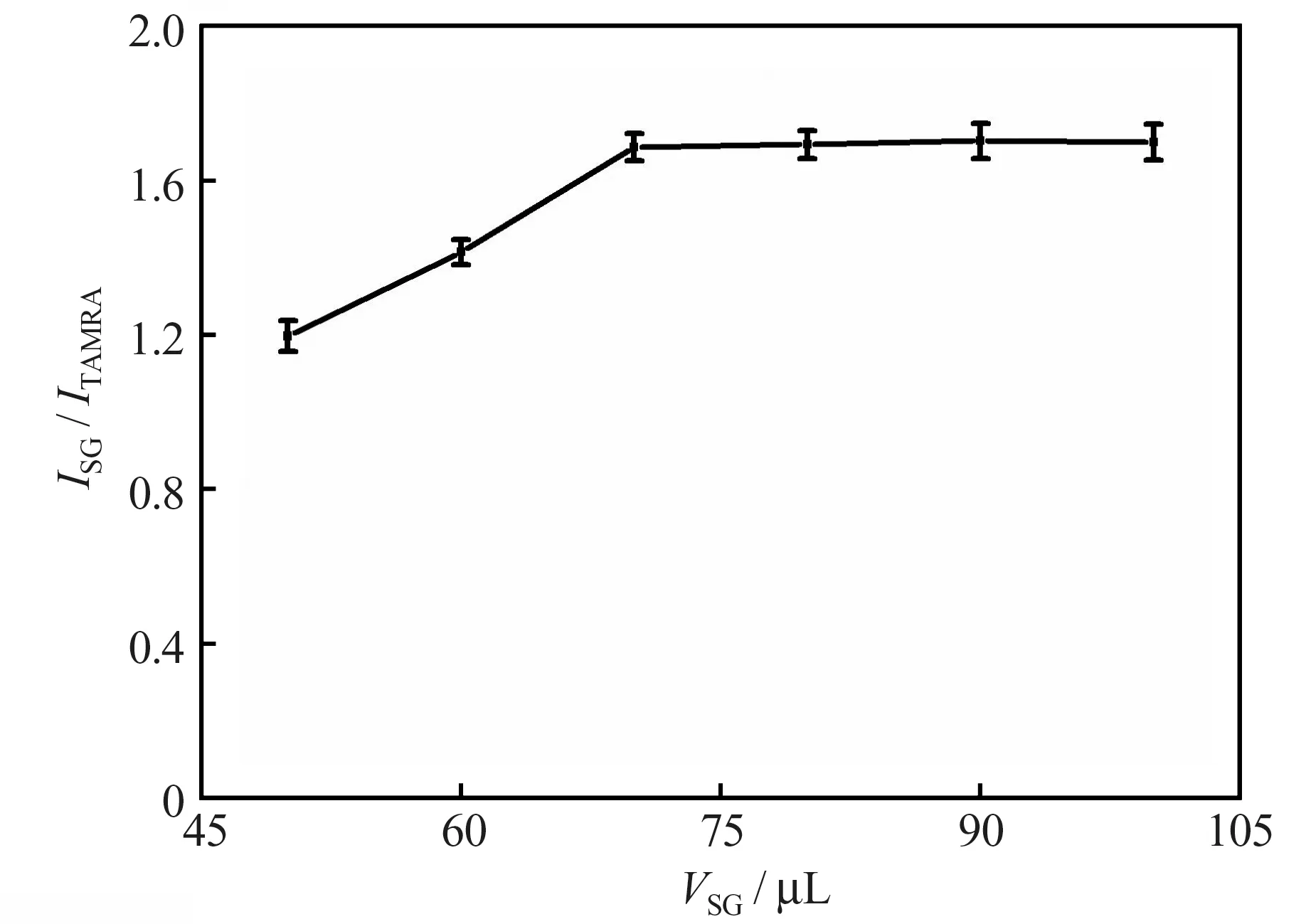
图2 SG 用量对测定结果的影响Fig.2 Effect of SG volume on measurement results
2.2.2 缓冲溶液pH 值
本实验中,缓冲溶液pH 值对测定结果的影响可能表现在3 个方面:一是影响Ag+与核酸适配体反应后形成双链DNA 的稳定性;二是影响TAMRA及SG 的发光效果;三是影响Ag+在溶液中的存在形式,Ag+在碱性条件下能与OH-反应生成难溶的AgOH(AgOH 的溶度积KSP=2×10-8,本实验中Ag+检测最大浓度为240.0 nmol/L 时,pH>12.92会生成沉淀)。因此,本实验在反应温度为35 ℃、反应时间为9 min 的条件下对缓冲溶液的pH 值进行了考察。结果(图3)表明,当缓冲溶液的pH 值在6.6~7.8 之间时,ISG/ITAMRA随pH 值的增加而增大;当pH 值大于7.8 时,ISG/ITAMRA随pH 值的增大而逐渐减小。因此,本实验选择缓冲溶液的pH 值为7.8,此时,ISG/ITAMRA值最大,且在检测范围内不会生成沉淀。
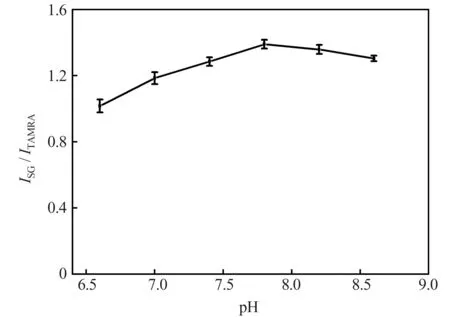
图3 pH 值对测定结果的影响Fig.3 Effect of pH value on the detection results
2.2.3 反应温度
在反应时间为9 min、pH 7.8 的条件下对反应温度的影响进行了考察。结果(图4)表明,当反应温度在20~35 ℃之间时,ISG/ITAMRA随温度的升高而增大;当温度高于35 ℃时,ISG/ITAMRA随温度的升高而快速减小。这主要是因为在温度较低时,升高温度可以加快Ag+与核酸适配体的反应速率,但当温度较高,超过了Ag+与核酸适配体反应后所形成双链DNA 的解链温度时,双链DNA 不能稳定存在,导致ISG降低,ISG/ITAMRA值减小。因此本实验选择的反应温度为35 ℃。
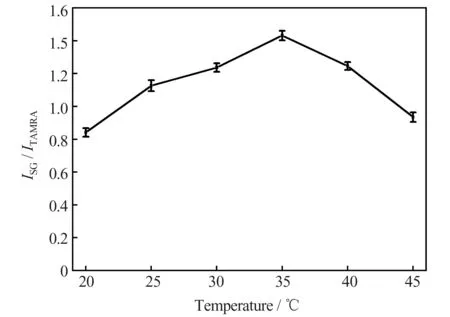
图4 反应温度对测定结果的影响Fig.4 Effect of reaction temperature on the detection results
2.2.4 反应时间
在反应温度为35 ℃、pH 7.8 的条件下,对Ag+、TAMRA 标记的核酸适配体及SG 的反应时间进行了考察。结果(图5)表明,当反应时间小于9 min时,ISG/ITAMRA随反应时间的增加而增大;当反应时间大于9 min 后,ISG/ITAMRA随反应时间的增加变化较小。因此,本实验选择的反应时间为9 min。
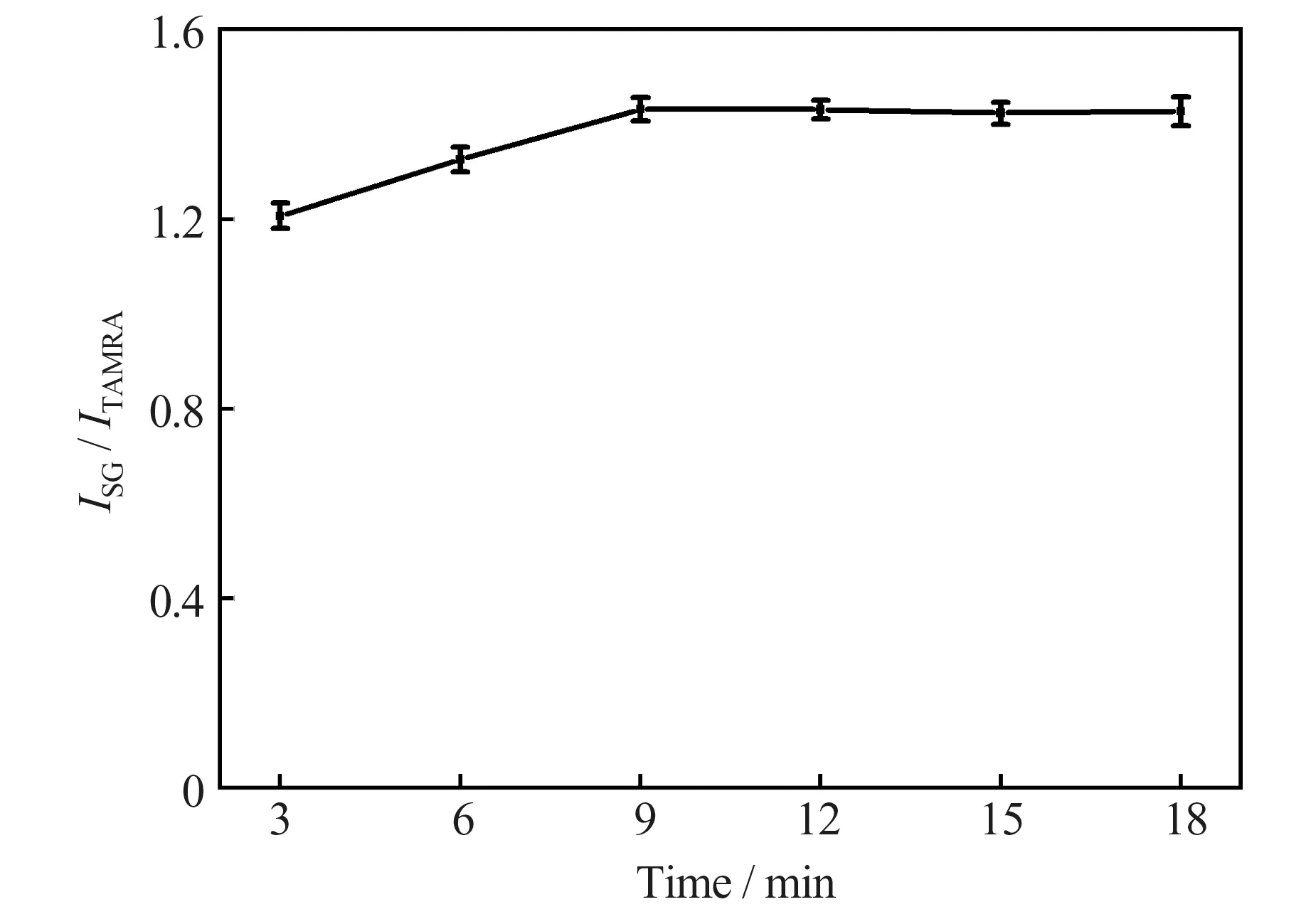
图5 反应时间对测定结果的影响Fig.5 Effect of reaction time on the detection results
2.3 工作曲线、检出限及精密度
在优化的实验条件下,考察了ISG/ITAMRA与Ag+浓度之间的关系,图6(a)为不同浓度Ag+体系所对应的同步扫描荧光光谱,图6(b)为ISG/ITAMRA与Ag+浓度(c)的线性关系图。图6(b)结果表明,在4.0~240.0 nmol/L 范围内,ISG/ITAMRA与Ag+浓度具有良好的线性关系,拟合的回归方程为ISG/ITAMRA=0.006 0c+0.050 4(R2=0.998 1),方法的检出限为2.0 nmol/L(3σ,n=9)。为了考察方法的精密度,对9 个相同浓度的Ag+(20 nmol/L)样品分别用本文的比率法(以ISG/ITAMRA作荧光信号)和单色荧光法(以ISG作荧光信号)进行测定,计算了两种方法的相对标准偏差(RSD),比率法的RSD 为1.7%,单色荧光法的RSD 为3.5%,比率法具有更好的精密度。

图6 不同浓度Ag+所对应体系的同步扫描荧光光谱(a)以及ISG/ITAMRA与Ag+浓度的线性关系(b)Fig.6 Synchronous scanning fluorescence spectra of different concentrations of Ag+ for the detection system (a)and the linear relationship between ISG/ITAMRA and the concentration of Ag+ (b)a-j: 0, 2.0, 4.0, 8.0, 16.0, 30.0, 60.0, 120.0, 180.0, 240.0 nmol/L
2.4 方法的选择性
在240.0 nmol/L 的Ag+溶液中分别加入100 倍浓度的其他金属离子及阴离子SO42-、PO43-等干扰离子溶液,检测体系ISG/ITAMRA的变化,考察方法的选择性。结果(图7)显示,虽然上述干扰离子的浓度远大于Ag+浓度,但各样品所对应的体系ISG/ITAMRA均无明显变化,表明该方法对Ag+具有很高的选择性。
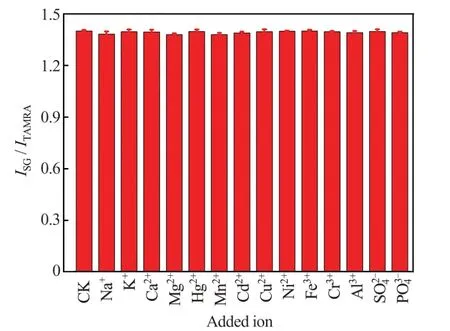
图7 其他离子对Ag+检测的影响Fig.7 Effect of other ions on Ag+ detection
2.5 实际样品分析
为了验证方法的准确性,用本方法及火焰原子吸收分光光度法(AAS 法,国标法)分别对实际水样(自来水和天然矿泉水)中的Ag+进行了检测,并进行加标回收实验。 分别取4 份自来水(编号T1~T4)和天然矿泉水(编号S1~S4)样品,加入不同浓度的AgNO3溶液,消解后分别采用本方法和AAS 法(检测前对样品浓缩50 倍)[22]对各样品中Ag+的浓度进行检测。结果(表1)表明,利用本方法测定的自来水和天然矿泉水中Ag+的含量分别为12.3 nmol/L 和21.2nmol/L,利用AAS 法测定的自来水和天然矿泉水中Ag+的含量分别为12.6 nmol/L和21.4 nmol/L,结果接近,且均低于饮用水中Ag+的国家限量标准(463.5 nmol/L)[23];本方法的回收率在98.5%~101.8% 之间,AAS 法的回收率在98.0%~102.3% 之间,结果相差不大;本方法的RSD 均较小,说明本方法具有更好的重复性。

表1 本方法与AAS 法测定结果的比较(n=3)Table 1 Comparison of detection results between this method and AAS (n=3)
2.6 与已有检测方法的比较
如表2 所示,与已报道的Ag+检测方法[9~11,17,24]相比,本方法灵敏度更高,检出限更低,适于Ag+的痕量检测。

表2 本方法与已有的Ag+检测方法的比较Table 2 Comparison of this method and other reported detection methods for Ag+nmol/L
3 结 语
本文利用荧光染料TAMRA 标记的核酸适配体及核酸染料SG 建立了一种高选择性定量检测水体中Ag+的方法。与已有的基于比率型荧光探针检测Ag+的方法相比,该方法具有以下两个特点:一是荧光探针合成较容易,检测过程相对简单;二是利用高灵敏的核酸染料SG 产生荧光信号,检出限更低,灵敏度更高。该方法检出限远低于饮用水中Ag+的国家限量标准,且受环境因素干扰较小,对自来水和天然矿泉水测定结果的RSD 均在2%以下,加标回收率在98.5%~101.8%之间,可望用于实际饮用水的检测。
