基于染料标记的核酸适配体对氯霉素的比率定量检测
2022-09-05熊威威李文恒向东山
熊威威,汪 鹏,李文恒,向东山†,翟 琨†
1. 湖北民族大学生物资源保护与利用湖北省重点实验室,湖北恩施445000;2. 湖北民族大学化学与环境工程学院,湖北恩施445000
0 引 言
氯霉素(chloramphenicol, CAP)是一种应用广泛的广谱抗生素,对大多数霉菌感染都有良好的抑制作用[1,2]。研究表明,人体吸收过量的CAP 会导致再生障碍性贫血、白血病和灰婴综合征等疾病[3]。CAP 在许多国家已被禁止使用,在我国也被禁止用于畜牧和水产养殖[4]。然而,由于CAP 的低成本和广谱性,现在仍然被广泛使用[5]。因此,建立一种快速、灵敏及简便的定量检测CAP 的新方法具有十分重要的意义。目前,CAP 的定量分析方法主要有高效液相色谱法(HPLC)[6]、气相色谱-质谱(GC-MS)联用法[7]、液相色谱-质谱联用法[8]、拉曼散射法[9]和基于抗体技术分析法[10]等。然而,在这些分析方法中,拉曼散射法和基于抗体技术分析法检测过程复杂、耗时长,GC-MS 法及液相色谱-质谱联用法需要昂贵的仪器和专业的操作人员,高效液相色谱法在复杂样品中分离效果不理想,检测特异性相对较差,不适合对CAP 进行快速而准确的检测。
核酸适配体(aptamer)是通过体外筛选技术得到的一段可与目标物特异性结合的寡核酸片段[11~15]。随着核酸适配体技术的发展与应用,很多物质的适配体被筛选出来[16,17]。CAP 特异性适配体于2011年被Mehta 等人[18]筛选出来,并成功地应用于CAP的检测中[19,20]。与已有的CAP 检测方法相比,基于核酸适配体的CAP 检测方法具有选择性好、准确度高、操作简单及检测成本低等优点。
SYBR Green Ⅰ(SG-Ⅰ)是一种可与双链DNA无选择性结合的核酸染料[21],毒性低、稳定性好,在水溶液中背景信号较低,与单链DNA 几乎不发生作用,而与双链DNA 作用后产生强荧光信号,常用于无标记荧光分析检测中[22]。
基于上述工作,本文利用荧光染料ROX 标记的CAP 核酸适配体及核酸染料SG-Ⅰ构建了一种比率型荧光探针,并利用该荧光探针实现了对CAP 高选择性的定量检测。与利用单一荧光信号建立的检测方法相比,本方法具有两个主要的优势:第一,利用高灵敏的核酸染料SG-Ⅰ产生荧光信号,可显著提高方法的灵敏度,降低检出限,适合低浓度CAP 的定量检测;第二,利用两种荧光信号的比值实现CAP 的定量检测,可显著减少环境因素对检测结果的干扰,从而提高检测结果的重复性和准确度。
1 实验部分
1.1 仪器与试剂
所有的荧光数据和荧光光谱均由RF-5301PC型荧光光谱仪(Shimadzu 公司)测定和采集;缓冲溶液的pH 值由PHS-3C 型pH 计(INESA 公司)测定。核酸染料SG-Ⅰ(用二甲基亚砜DMSO 配制的10 000倍浓缩液)由上海瑞安生物技术有限公司提供;氧化石墨烯(GO)购于中科院成都有机化学研究所。
实验中所用化学试剂均为分析纯,购自中国国药化学试剂有限公司;CAP 核酸适配体PLV 与有机猝灭基团标记且与CAP 核酸适配体部分互补的单链DNA(PC)均由上海生工生物技术有限公司合成并用高效液相色谱法纯化,PLV 的3′端标记荧光染 料6-carboxy-x-rhodamine(ROX),PC 的5′端 标记猝灭基团Black Hole Quencher 2(BHQ-2)。其核酸的碱基序列如下:

1.2 样品的制备及检测
基于比率型荧光探针检测CAP 的样品配制中,用0.1 mol/L 的Tris-HCl(pH 7.7)缓冲溶液将CAP配制成不同浓度的溶液,并放置于4 °C 下冷藏备用;用0.1 mol/L 的Tris-HCl 缓冲溶液分别将PLV和PC配制成1×10-7mol/L 和1.2×10-7mol/L 的溶液备用;用Tris-HCl 缓冲溶液将核酸染料SG-Ⅰ稀释10 000 倍得到SG-Ⅰ工作液,放置于4 °C 下储存备用。样品制备时,分别取50 μL 配制好的CAP和PLV溶液于离心管中,然后加入50 μL 的PC 溶液与50 μL 的SG-Ⅰ工作液,并补充缓冲溶液至总体积为500 μL,在温度为37 °C 的水浴锅中反应30 min,冷却到常温后对其进行同步荧光分析。在进行同步荧光分析时,初始激发波长设置为454 nm,同步扫描的波长间隔(Δλ)设置为26 nm,荧光检测范围为480~700 nm,激发光狭缝的宽度设置为10 nm,发射光狭缝的宽度设置为5 nm。SG-Ⅰ和ROX 的最大发射波长分别为525 nm 和613 nm,在进行定量分析时所使用的数据为SG-Ⅰ和ROX 的最大发射波长处的荧光强度。
基于GO 猝灭的单色荧光样品的配制中,用0.1 mol/L 的Tris-HCl 缓冲溶液(pH 7.7)将PLV 配制成1.4×10-7mol/L 浓度。样品制备时,分别取50 μL配制好的PLV 溶液和10μL浓度为0.5 mg/mL 的GO 溶液于离心管中,在室温下孵育10 min,然后加入50 μL 的CAP 溶液,补充Tris-HCl 缓冲溶液至总体积为500 μL,在37 °C 的水浴锅中反应30 min 后,冷却到常温后对其进行同步荧光分析。在进行同步荧光分析时,初始激发波长设置为536 nm,同步扫描的Δλ设置为28 nm,荧光检测范围为564~670 nm,激发光狭缝的宽度设置为10 nm,发射光狭缝的宽度设置为5 nm。在进行定量分析时所使用的数据为ROX 最大发射波长处的荧光强度。
1.3 实际样品的处理与检测
主要对CAP 纯牛奶和滴眼液中CAP 的含量进行测定。1)对于纯牛奶中CAP 的检测。取5 mL纯牛奶置于10 mL 离心管中,加入5 mL 乙酸乙酯后进行振荡,然后离心10 min (4 000 r/min),取上清液,再加入5 mL 乙酸乙酯重复上述操作两次。将收集的上清液用氮气吹干,然后用0.01 mol/L 的Tris-HCl(含10%甲醇)定容至100 mL,再用本方法进行检测。2)对于CAP 滴眼液中CAP 的检测。根据其说明书中标注的浓度,在本实验可检测浓度范围内,用Tris-HCl 缓冲溶液将样品稀释成3 组不同浓度的溶液,然后分别用本方法进行检测,计算检测结果的平均值并与说明书中标注的浓度进行比较。
2 结果与讨论
2.1 检测原理
利用PLV、PC 及SG-Ⅰ检测CAP 的基本原理如图1 所示。其中,CAP 核酸适配体的3′端标记了荧光染料ROX,与CAP 核酸适配体部分互补的单链DNA 的5′端修饰了猝灭基团BHQ-2。当体系中不存在CAP 时,PLV 与PC 通过碱基互补配对形成双链DNA,荧光染料ROX 与猝灭基团BHQ-2 相互靠 近,ROX 的荧光被BHQ-2 猝灭,ROX的荧光信号很弱,但形成的双链DNA 与核酸染料SG-Ⅰ结合,使SG-Ⅰ的荧光强度显著增强,此时IROX/ISG-Ⅰ较小。当体系中存在CAP 时,由于CAP 与PLV 的亲和力更强,CAP 优先与PLV 结合形成稳定性更好的复合物,此时PLV 不能与PC 反应形成双链DNA,荧光染料ROX 无法靠近猝灭基团BHQ-2,荧光不能被BHQ-2 猝灭,ROX 荧光信号很强。另外,由于体系中没有双链DNA,SG-Ⅰ只能游离于溶液中,其荧光信号很弱,此时IROX/ISG-Ⅰ较大。体系中CAP 的浓度越大,与PLV 结合形成的复合物就越多,ROX 的荧光信号就越强,SG-Ⅰ的荧光信号就越弱,IROX/ISG-Ⅰ就越大。根据体系中加入CAP 后IROX/ISG-Ⅰ的变化即可实现对CAP 定量分析。
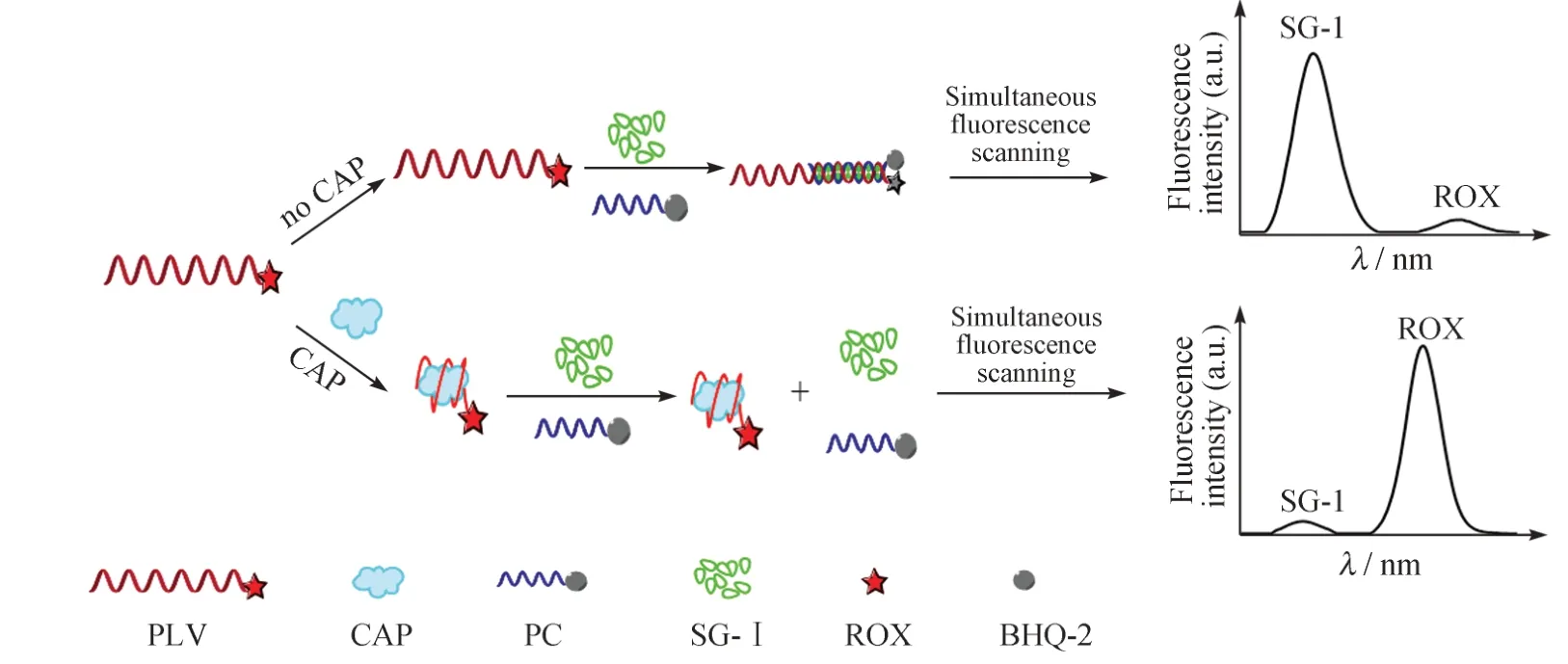
图1 基于比率型荧光探针检测CAP 的原理Fig.1 The principle of detection for CAP based on ratiometric fluorescent probe
利用PLV 和GO 对CAP 定量检测的基本原理如图2 所示。当体系中存在目标物CAP 时,CAP 与PLV 结合形成稳定的复合物,PLV 的空间结构发生变化,导致ROX 远离GO,ROX 与GO 之间的荧光共振能量转移效应消失,ROX 的荧光得到恢复,体系荧光信号很强;当体系中不存在目标物CAP 时,PLV 中的单链DNA 与GO 通过强烈的π-π 堆叠作用使PLV 吸附在GO 的表面[23],标记在PLV 上的荧光染料ROX 靠近GO,其荧光通过荧光共振能量转移的方式被GO 猝灭,体系荧光信号很弱。据此,通过体系荧光强度恢复的程度即可实现CAP 的定量分析。
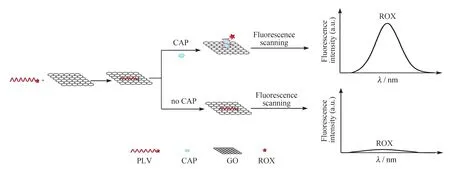
图2 基于核酸适配体与GO 检测CAP 的原理Fig.2 The principle of detection for CAP with aptamer and GO
2.2 方法的可行性分析
图3 为基于比率型荧光探针检测CAP 分析法中,PLV 与不同浓度的CAP 反应后,体系中核酸染料SG-Ⅰ和荧光染料ROX 的同步荧光光谱图。结果表明,当体系中不存在CAP 时,荧光染料ROX 的荧光信号很弱而核酸染料SG-Ⅰ的荧光信号很强;当体系中存在CAP 时,荧光染料ROX 的荧光信号显著增强而SG-Ⅰ的荧光信号明显减弱。体系中CAP 的浓度越大,荧光染料ROX 荧光信号就越强,SG-Ⅰ的荧光信号就越弱,这说明利用该方法对CAP 进行定量检测是可行的。
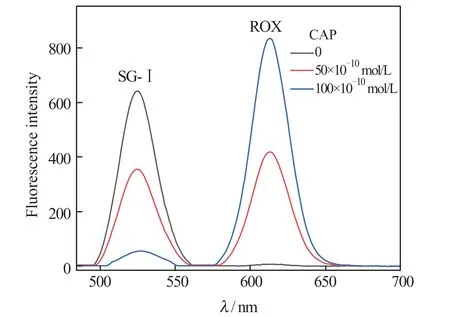
图3 不同浓度的CAP 所对应体系的同步荧光光谱Fig.3 The synchronous fluorescence spectra of system at different concentrations of CAP
2.3 实验条件的优化
核酸染料SG-Ⅰ工作液的加入量对检测结果具有很大影响。根据检测CAP 的原理,SG-Ⅰ工作液应该保持相对过量,但过量太大又会产生一定的背景荧光,因此本实验对SG-Ⅰ工作液的体积进行了优化。如图4 所示,当SG-Ⅰ工作液的体积小于50 μL 时,SG-Ⅰ的荧光强度随体积的增加而增强;当SG-Ⅰ工作液的体积达到50 μL 后,再增加SG-Ⅰ工作液的体积,其荧光强度几乎不再变化。这说明在PLV 的浓度为1×10-8mol/L,PC 的浓度为1.2×10-8mol/L 时,SG-Ⅰ工作液的体积达到50 μL 时即可满足本实验的需求。本实验所有样品中SG-Ⅰ工作液的体积均选择为50 μL。
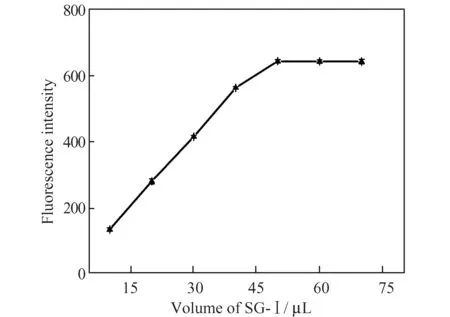
图4 SG-Ⅰ工作液体积的影响Fig.4 Effect of working solution volume of SG-Ⅰ
PLV 与CAP 的反应时间直接影响着PLV 与CAP 配位反应的程度,因此本实验考察了PLV 与CAP 配位反应的时间。如图5 所示,当反应时间在10~30 min 之间时,IROX/ISG-Ⅰ随着反应时间的增加逐渐增大;当反应时间超过30 min 后,IROX/ISG-Ⅰ基本保持不变。这表明在30 min 之内,PLV 与CAP 配位反应已基本完成。因此本实验所有样品中PLV与CAP 的反应时间均选择为30 min。

图5 反应时间对IROX/ISG-Ⅰ的影响Fig.5 Effect of reaction time on IROX/ISG-Ⅰ
缓冲体系的pH 值会直接影响荧光染料ROX和核酸染料SG-Ⅰ的荧光强度,同时也会影响PLV与CAP 的配位反应,因此本实验考察了缓冲溶液的pH 值。如图6 所示,当缓冲体系的pH 值在6.8~7.7 之间时,IROX/ISG-Ⅰ随 着pH 值的增加逐渐增大;当pH 值大于7.7 时,IROX/ISG-Ⅰ随着pH 值的增加逐渐减弱。因此,本实验中缓冲溶液的pH 值为7.7 时效果最好。
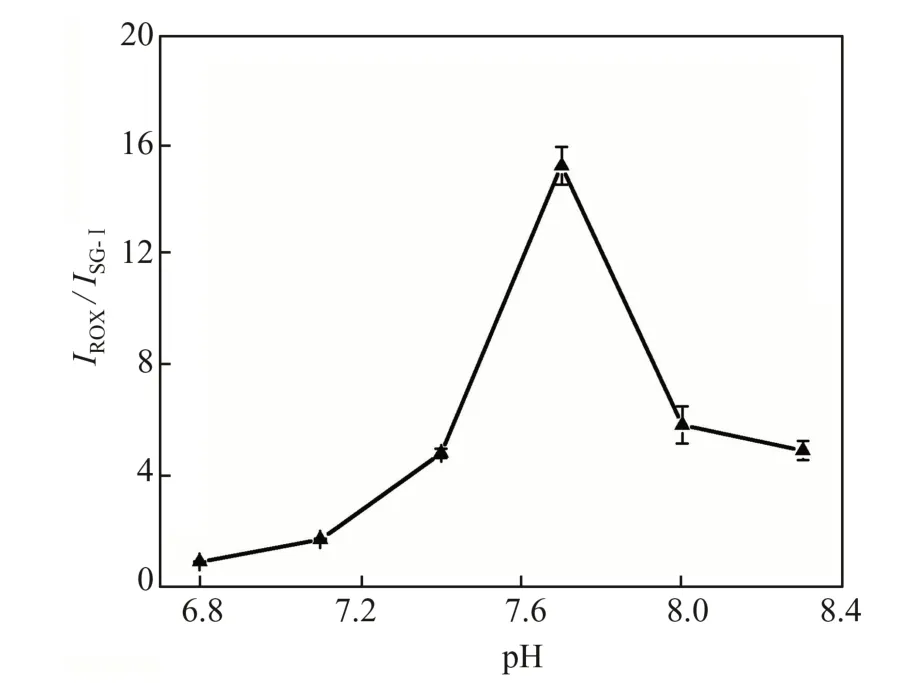
图6 pH 值对IROX/ISG-Ⅰ的影响Fig.6 Effect of pH value on IROX/ISG-Ⅰ
反应体系中溶液的离子强度会影响PLV 与CAP 形成配合物的稳定性,因此本实验通过加入不同浓度的NaNO3溶液,考察了溶液离子强度对检测结果的影响。如图7 所示,当NaNO3浓度低于60mmol/L 时,IROX/ISG-Ⅰ随着NaNO3浓度的增大而 增大;当NaNO3浓度大于60 mmol/L 时,IROX/ISG-Ⅰ趋于稳定。因此,本实验选择NaNO3溶液的浓度为60 mmol/L。
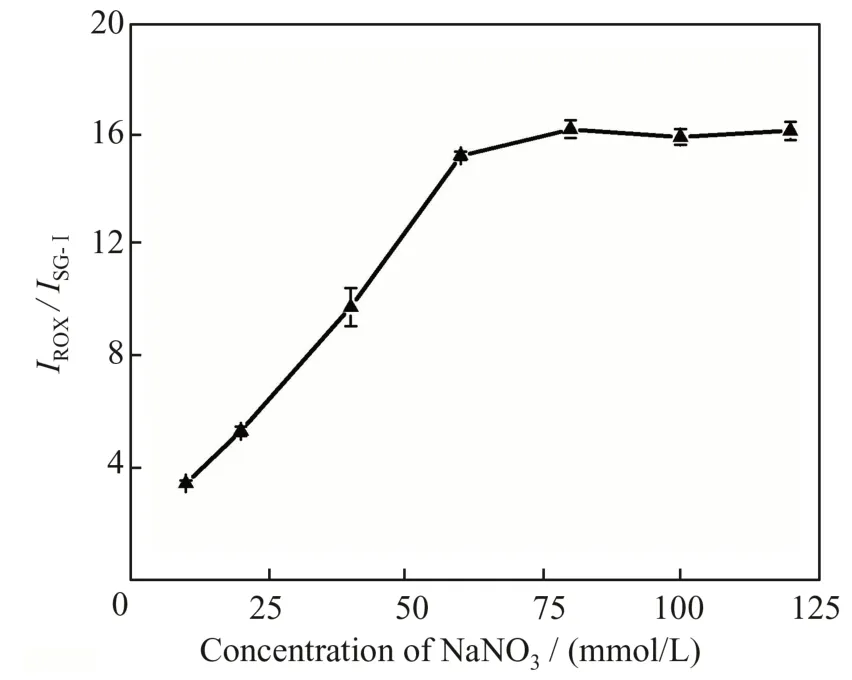
图7 NaNO3浓度对IROX/ISG-Ⅰ的影响Fig.7 Effect of NaNO3 concentration on IROX/ISG-Ⅰ
2.4 工作曲线及检出限
在优化条件下,考察了IROX/ISG-Ⅰ与CAP 浓度之间的关系。图8(a)为不同浓度CAP 所对应体系中ROX 及SG-Ⅰ的同步荧光光谱图,图8(b)为ROX与SG-Ⅰ在最大发射波长处荧光强度的比值(IROX/ISG-Ⅰ)与CAP 浓度c(mol/L)之间拟合的回归曲线图。结果表明,在CAP 浓 度 为2×10-10~100×10-10mol/L 范围内,IROX/ISG-Ⅰ随CAP 浓度的增大而增大,拟合的回归方程为IROX/ISG-Ⅰ=0.072e0.055c(相关系数R=0.993)。将空白样品平行测定11 次,分别计算ROX 和SG-Ⅰ荧光强度的标准偏差,再将它们标准偏差比值的3 倍代入上述回归方程,计算得到方法的检出限为8×10-11mol/L。对9 个浓度均为1×10-9mol/L 的平行样品进行测定,其相对标准偏差(RSD)为1.05%,说明该方法具有良好的精密度。
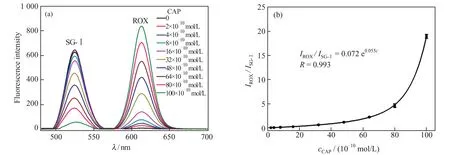
图8 (a)不同浓度CAP 所对应体系中ROX 与SG-Ⅰ的同步荧光光谱图;(b)IROX/ISG-Ⅰ与CAP 浓度之间拟合的回归曲线Fig.8 (a)The synchronous fluorescence spectra of ROX and SG-Ⅰin the system with different concentrations of CAP;(b)the fitting regression curve between IROX/ISG-Ⅰand the concentration of CAP
2.5 与单色荧光定量检测的比较
利用PLV 和GO 建立单色荧光定量检测CAP的方法,并与比率型荧光探针进行比较。首先对单色荧光定量检测CAP 方法的条件进行优化,得到了最佳检测条件为:GO 的浓度为10 μg/mL,PLV 与CAP 的反应时间为30 min,缓冲溶液的pH 值为7.7,缓冲溶液中NaNO3的浓度为60 mmol/L。然后,在优化的条件下,考察了ROX 荧光强度的变化值ΔI(ΔI=I-I0,I为CAP 存在时ROX 的荧光强度,I0为CAP 不存在时ROX 的荧光强度)与CAP 浓度之间的关系。图9(a)为不同浓度CAP 所对应体系中ROX 的同步荧光光谱图,图9(b)为ROX 最大发射波长处的荧光强度与CAP 浓度之间的线性关系。结果表明,CAP浓度在2.8×10-10~140×10-10mol/L 范围内,ROX 荧光强度的变化值与CAP 浓度之间具有良好的线性关系,拟合工作曲线的回归方程为ΔI=6.776c+0.574 (R2=0.998)。将空白样品平行测定11 次,计算标准偏差,用3 倍的标准偏差除以工作曲线的斜率得方法检出限为1.6×10-10mol/L;对9 个浓度均为1×10-9mol/L的平行样品进行测定,其相对标准偏差(RSD)为5.52%,说明该方法也具有较好的精密度,但与比率荧光分析法较差。
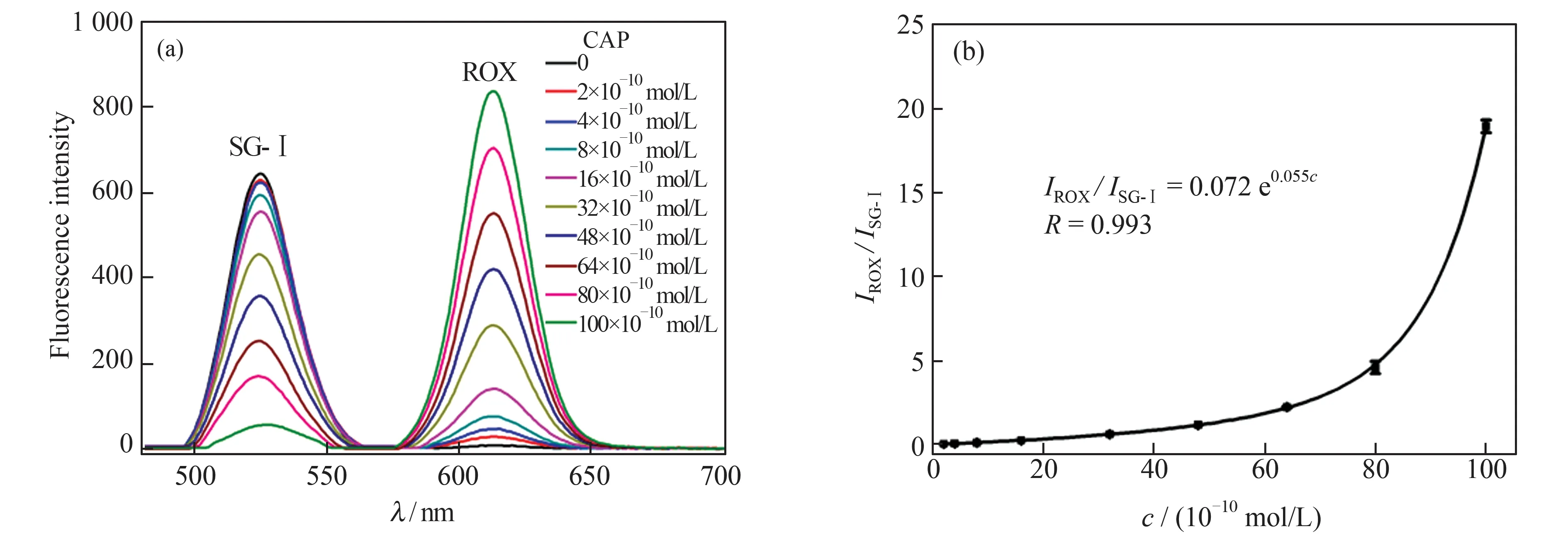
图9 (a)不同浓度CAP 所对应体系中ROX 的同步荧光光谱;(b)ROX 的荧光强度与CAP 浓度之间的线性关系Fig.9 (a)The synchronous fluorescence spectra of ROX in the system with different concentrations of CAP;(b)the linear relationship between the fluorescence intensity of ROX and the concentration of CAP
2.6 加标回收实验
进一步地比较两种方法的准确性。分别用两种方法对加入牛奶样品中CAP 标准品的含量进行检测。取4 份相同的纯牛奶样品,按1.3 节中的步骤对纯牛奶处理后,按表1 所示加入不同浓度的CAP 标准品溶液,然后分别用单色荧光分析法(A1~A4)及比率荧光分析法(B1~B4)进行检测,计算回收率。结果(表1)表明,比率荧光分析法的RSD 更小,回收率更接近100%,这说明在复杂的检测环境中,比率荧光分析法对CAP 的检测重复性更好,准确度更高。
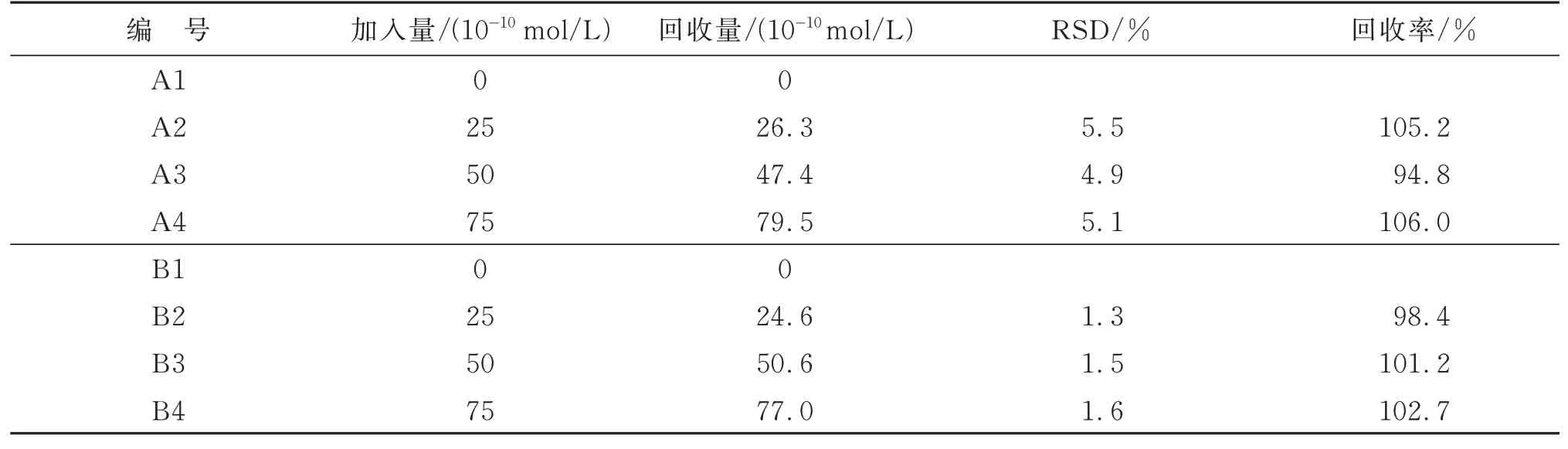
表1 采用两种检测方法测定牛奶中CAP 的含量(n=3)Table 1 Determination of CAP in milk using two assay methods (n=3)
2.7 特异性分析
为了考察方法的特异性,本实验选择与CAP 性质相近的几种抗生素:卡那霉素(kanamycin)、甲砜霉素(thiamphenicol)、土 霉 素(oxytetracycline)、四 环 素(tetracycline)、链霉素(streptomycin),进行对比实验。分别配制1×10-6mol/L 的各种抗生素溶液,在最优条件下使用比率荧光分析CAP 的方法进行检测。如图10 所示,在其他抗生素浓度远高于CAP 浓度(1×10-8mol/L)的情况下,体系中ROX 的荧光信号很弱,而SG-Ⅰ的荧光信号很强,说明该检测方法具有很高的特异性。
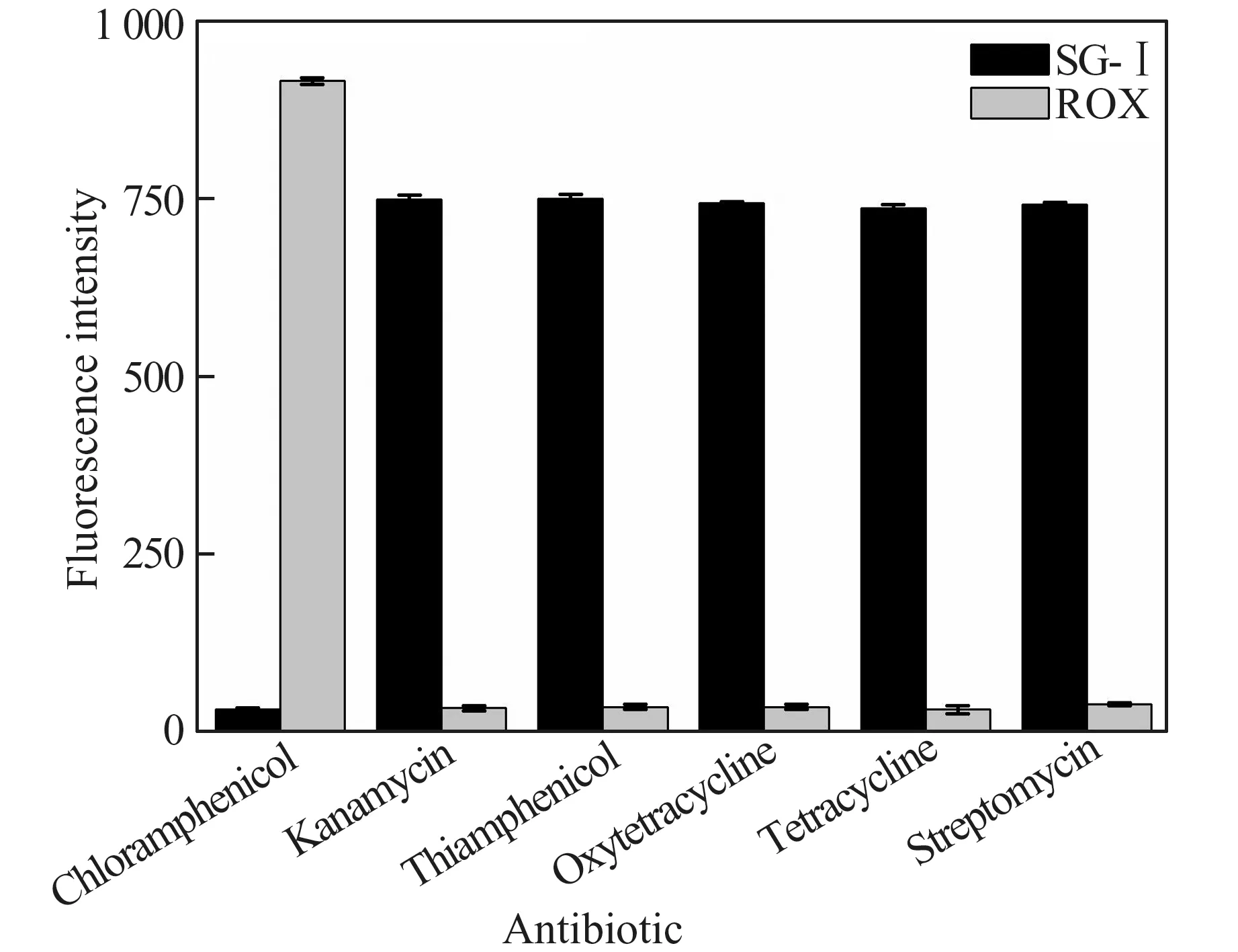
图10 方法的特异性分析Fig.10 The specificity analysis of the method
2.8 实际样品分析
为了验证方法的实用性,本实验对CAP 滴眼液中的CAP 含量进行了测定。结果表明,滴眼液中CAP 的含量为2.486 mg/mL,与说明书中标注的CAP 含量2.500 mg/mL 基本一致,说明该方法对实际样品的检测具有较高的准确度。
3 结 语
本实验基于PLV、PC 及核酸染料SG-Ⅰ构建了一种比率型荧光探针,并利用该探针建立了一种CAP 的定量检测新方法。与单色荧光定量检测CAP 的方法相比,该方法重复性更好、检出限更低、准确度更高。同时,该方法操作简单、检测时间短,能用于实际样品中CAP 的分析与检测。
