非活动性乙型肝炎病毒表面抗原携带者的治疗
2022-09-05曾达武朱月永
曾达武 朱月永
福建医科大学附属第一医院肝内科、肝病研究所,福建省肝病与胃肠疾病临床医学研究中心,福州 350005
全球慢性HBV 感染者约2.9 亿例, 在我国,HBsAg 流行率为6.1%,估计慢性HBV 感染者8 600万例[1],其中非活动性 HBsAg 携带状态(IHC)患者的比例约36.08%[2],以此推算中国IHC 人群约3 096万,接近于慢性乙型肝炎(CHB)患者人数(3 232 万例)。 目前,各国/地区的 CHB 防治指南(美国、欧洲、亚太、中国)对IHC 的治疗推荐意见并非完全一致:欧洲指南[3]推荐有肝细胞癌(HCC)或肝硬化家族史或有肝外表现且HBV DNA 阳性患者进行抗病毒治疗;亚太指南[4]建议对患者定期随访6~12 个月,对于非侵入性测试表明有明显纤维化的证据,年龄>35岁或有HCC 或肝硬化家族史的患者, 根据HBV DNA 结果和肝穿刺结果来决定是否进行抗病毒治疗;中国指南[5]建议每 6~12 个月进行随访,也是根据HBV DNA 结果和肝穿刺结果决定是否行抗病毒治疗;美国指南[6]则建议定期6~12 个月随访。
随着对乙型肝炎自然史的深入研究及抗病毒治疗方案不断探索,慢性HBV 感染管理模式正在逐渐改变。 各国针对是否扩大抗病毒治疗适应症进行深入的探索,但在扩大适应症方面,主要是针对免疫耐受期和不确定期(未经治疗的慢性HBV 感染者随访1年, 其 HBV DNA 和 ALT 模式不同于 4 个传统的慢性HBV 感染分期[7])的HBV 感染患者,针对IHC的探讨甚少。 就IHC 是否应该抗病毒治疗,本文分析已有的临床研究结果,并进行了讨论。
一、IHC 的定义
对于处于免疫控制期的患者,不同国家/地区有不同的命名, 并根据 HBsAg、HBeAg、抗-HBe、HBV DNA 和ALT 水平及肝脏组织学进行相应的定义,见表 1。 IHC 早期定义未设定 HBV DNA 和 HBsAg 的水平,随着HBsAg 稀释定量检测的普遍开展,结合HBV DNA<2 000 IU/mL 和 HBsAg<1 000 IU/mL 定义IHC, 可发现患者发生肝硬化及HCC 的概率更低;以上述HBV DNA 和HBsAg 水平来区分IHC 究竟是非活动性CHB 或者HBeAg 阴性CHB 的灵敏度和特异性分别为71%和85%[8-10]。
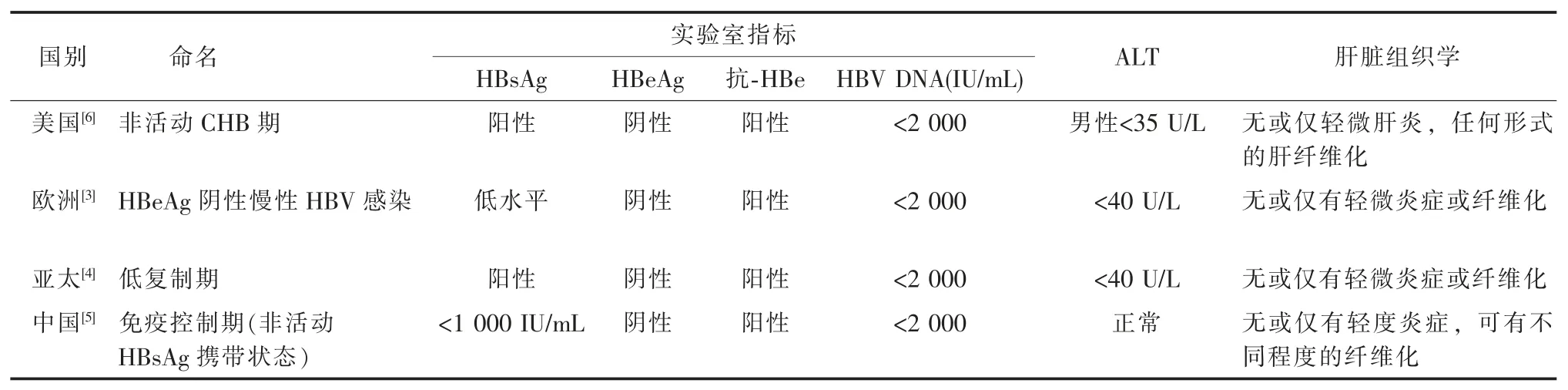
表1 不同国家或地区的非活动性HBsAg 携带状态定义
二、关于IHC 人群开展抗病毒治疗的争议
IHC 是在乙型肝炎自然史中具有良好结局的阶段, 既往指南对这类人群不推荐进行抗病毒治疗。虽然最新的国外指南[11-13]及中国扩大CHB 抗病毒治疗的专家意见[7]对于CHB 抗病毒治疗的适应证均已经逐步放宽,但针对IHC 患者,仍然有大部分不符合现有的抗病毒治疗指征。 目前针对IHC 是否抗病毒治疗,仍存在争议。
1. 部分研究认为抗病毒治疗无助于缓解IHC结局
从自然史的队列研究角度来看,HBV 感染是HBV、肝细胞与宿主免疫系统相互作用的动态过程,从而导致乙型肝炎自然史的不同阶段。 IHC 处于免疫控制阶段,其疾病进展相对缓慢,相对于CHB 而言,发展为HCC 的概率明显减少。 随着HBsAg 定量(qHBsAg) 检测方法在临床中的广泛应用以及HBsAg 动力学研究的深入,为IHC 患者的临床管理提供了新的思路。早在 2010年,Brunetto 等[14]在评估慢性HBV 基因D 型感染的IHC 患者时, 发现ALT水平正常、HBV DNA≤2 000 IU/mL 和 qHBsAg<1 000 IU/mL 联合判断IHC 的阳性预测值 (PPV)为88%,阴性预测值(NPV)为97%,IHC 患者再激活的概率极低。 近期1 项研究表明 HBsAg<1 000 IU/mL可用于识别具有高再激活风险的IHC 患者[15]。 在1项亚洲研究中, 在HBV DNA<2 000 IU/mL 的患者中,HBsAg<1 000 IU/mL 的人群 20年累计肝癌发生率仅 2%,而 HBsAg>1 000 IU/mL 的人群 20年累计肝癌发生率率高达8%[16]。
根据上述 3 个标准(ALT 正常,HBV DNA<2 000 IU/mL 和 HBsAg<1 000 IU/mL) 定义的 IHC 患者每年的肝炎复发率为1.1%, 而HBV DNA<2 000 IU/mL 但 HBsAg>1 000 IU/mL 的患者发生肝炎复发的风险为前者的1.5 倍[16]。 长期的随访研究发现血清 HBsAg 越低,其清除率越高,HBsAg<200 IU/mL时HBsAg 开始自发性清除的阈值,其水平急剧下降(2年内下降>1 lg IU/mL 或 1年内下降>0.5 lg IU/mL),1~3年内可消失,并且HBsAg 水平越低,肝脏终末事件发生率越低。 队列研究发现, 在发生HBeAg 血清学转换后进入IHC 期且没有发生肝硬化的患儿中, 通过30年的随访发现IHC 患者没有发生肝硬化[17-18]。
从抗病毒治疗的角度来看, 有1 项REVEAL-HBV 前瞻性队列研究发现,HBeAg 阴性CHB 患者,HBV DNA>2 000 IU/mL 与HCC 和肝脏疾病进展高度相关[19-20],提示HBV DNA 是肝脏疾病进展的危险因素,但该研究没有分层分析ALT 正常的IHC 患者的临床结局。 韩国在1 项随访近10年的队列研究中发现,通过倾向性匹配(PSM)后,有475例ALT>2倍正常上限(ULN)且接受核苷(酸)类似物(NUCs)抗病毒治疗的HBeAg 阴性CHB 患者及475例未进行病毒治疗的IHC 患者,治疗组显示出与IHC 患者相当的死亡/移植风险 (HR=0.68, 95% CI: 0.38~1.22, P=0.26),但 IHC 患者发生HCC 风险低于治疗组(HR=1.18,95% CI:1.00~1.39,P=0.049)[21]。 一项研究 纳 入 1 378 名HBeAg 阴性、ALT>2×ULN 且 HBV DNA ≥2 000 IU/mL、 初治并开始 NUCs 治疗的 CHB患者和 1 014 名 IHC 患者, 比较各组之间的累计HCC 发病率,结果发现基线为肝硬化的CHB 患者5年HCC 累计发生率为 17.4%,而IHC 仅为 6% (P=0.015);基线无肝硬化的CHB 患者5年HCC 累计发生率为7.2%,而IHC 仅为0.8% (P<0.001),另外无论是否存在基线肝硬化, CHB 组5年HCC 累计发生率为 11.4%,而 IHC 仅为 1.5%[22]。 另一项比较了1 291例用 NUCs 治疗的病毒学应答HBeAg 阴性CHB 患者和741例 IHC 患者的临床结局, 随访7年,在匹配了年龄、肝硬化及肝脏硬度之后,两组的HCC 累计发生率相当[23]。 上述研究表明IHC 患者即使未进行抗病毒治疗,累计HCC 的发生率仍相当于甚至低于那些进行抗病毒治疗的CHB 患者,故学者认为IHC 患者不需要进行抗病毒治疗。
2. 建议我国对IHC 采取抗病毒治疗
我国是HBV 感染高流行区,但诊断率及治疗率较低,据估算我国CHB 诊断率为22%、治疗率仅为17%[7],这与 WHO 提出的“2030年消除病毒性肝炎公共卫生威胁”的目标相差甚远。 我国IHC 患者人群庞大,而为了达到WHO 提出的目标,亟需循证学证据来扩大抗病毒治疗适应症并提高乙型肝炎临床治愈率。 目前,部分学者不支持IHC 患者进行抗病毒治疗的原因有以下三点。
首先, 他们认为与CHB 患者相比,IHC 患者疾病进展相对缓慢,预后较好,但事实上IHC 人群仍然有较高的HCC 发生风险。多项研究提示,IHC 人群中仍有约 20%可进展为 HBeAg 阴性 CHB,约20%可逆转为HBeAg 阳性 CHB[24-26],证实 IHC 患者在随访过程中仍存在免疫失控导致疾病的进展。 虽然未抗病毒治疗的IHC 患者与进行抗病毒治疗的CHB 患者的HCC 发生率相当, 但IHC 与健康人群对比,HCC 等肝病终末事件发生率明显升高。 我国台湾地区一项对1 932例IHC 患者长达13年的随访研究发现,其HCC 发生风险和肝病相关死亡的年发生率是健康人的 4.6 倍和 2.1 倍[27],提示 IHC 患者仍有进展为终末期肝病的风险。 且IHC 进展为HCC 的风险与种族相关,Fattovich 等[28]认为亚洲IHC患者发生HCC 的风险是欧美IHC 患者的10 倍。
其次,他们还认为IHC 患者没有或仅有轻微肝脏炎症。然而先前的研究发现很大一部分ALT 水平持续正常的患者有中重度肝坏死性炎症和/或纤维化[29],多项研究的肝穿也证实10%~46.2%的IHC 人群存在中重度肝脏炎症[30-32]。 即使基线时IHC 无肝脏组织损伤,随访过程中ALT 正常,仍可能存在免疫活动,鉴于免疫活动的动态变化、肝组织学的性质以及重复肝活检的风险和成本, 常常无法及时地对应该治疗的IHC 患者进行抗病毒治疗,导致IHC 患者发生HCC 等终末肝病事件的概率明显升高,尤其是在 CHB 高发地区。 美国指南或中国指南定义默认IHC 可以存在2 级以上的肝纤维化,而这些患者需要抗病毒治疗。 针对IHC 的随访研究发现,发生HCC 的IHC 患者,其手术样本中发现91.3%的癌旁组织存在晚期肝纤维化[21], 该研究结果间接提示IHC 应该严格定义肝脏组织炎症和肝脏纤维化,而针对2 级以上的肝纤维化患者, 也应该尽早进行抗病毒治疗。
最后, 还有一个重要原因是目前仍无特效的治疗药物。 Yeo 等[33]对 34 项抗 HBV 治疗的队列研究进行荟萃分析, 结果显示HBeAg 阴性CHB 患者1年的HBsAg 清除率为1.33%,与IHC 自发HBsAg清除概率相当。 聚乙二醇 IFN-α(Peg-IFNα)治疗 CHB患者1年的HBsAg 血清学清除率也仅有3%[34],但随着抗病毒药物的普及与治疗方案的探索,HBsAg的清除率逐渐升高。 另一项荟萃分析发现,与NUCs单药治疗相比,联合 IFN 治疗(RR=15.59)或换用IFN (RR=12.15) 治疗可以显著提高 CHB 患者HBsAg 阴转率[35]。针对NUCs 经治的特定优势人群,NUCs 联合或序贯Peg-IFNα 治疗可显著提高CHB患者的 HBsAg 阴转率[36]。 近年来,关于 IHC 治疗获得 HBsAg 阴转的研究陆续有报道 (见表 2)[37-47]。2017年Cao 等[38]开展了首个针对IHC 患者治疗的前瞻性临床研究,该研究的治疗组应用Peg-IFNα-2a单药治疗或联合阿德福韦治疗,对照组未接受治疗,结果发现治疗组48 周及96 周HBsAg 清除率分别为29.8%及44.7%,显著高于对照组(P < 0.001),该结果可见延长治疗提高了HBsAg 清除率 (P=0.049)和 HBsAg 血清学转换率(20.2%vs.38.3%,P<0.001)。Song 等[48]通过对 Peg-IFNα 治疗 IHC 患者的 11 项临床研究荟萃分析发现, 9 项Peg-IFNα 治疗 IHC疗程为48 周的研究中,HBsAg 总体清除率为47%;6 项报道了HBsAg 总体转换率为26%。 相比于对照组, 经 Peg-IFNα 治疗增加 IHC 患者 HBsAg 清除的概率(RR=16.46, P < 0.001)。

表2 非活动性HBsAg 携带状态人群聚乙二醇干扰素-α 治疗的临床研究
从经济学角度,以HBsAg 清除为目标的药物经济学评价NUCs 与Peg-IFNα 联合并延长的个体化抗病毒治疗策略的成本效益, 与NUCs 单药治疗相比, 针对特定HBeAg 阴性CHB 患者的长期联合治疗策略可能会延长质量调整生命年。 Li 等[49]认为HBsAg≤10 IU/mL 的CHB 患者是该策略下最具成本效益的人群。
三、如何更精准地判断IHC
以往关于IHC 的队列研究,多数采用影像学或者生化指标来排除肝硬化, 未严格按照病理标准来定义IHC,导致入组的IHC 患者中有部分存在中度以上肝脏组织炎症, 也可能存在除了肝硬化以外任何形式的肝纤维化, 如果排除中等程度以上的肝组织损伤的IHC 患者,则IHC 患者会有更好的临床结局。
指南推荐采用肝脏硬度检测、 天冬氨酸氨基转移酶/血小板比值指数(APRI)等肝脏纤维化无创检测方法,但是如何更精准和动态地判断IHC,有待进一步研究。 有研究发现APRI≥1.5 或肝脏硬度值≥9.4 kPa,对显著肝纤维化(F≥2)的灵敏度和特异性约为80%[50-51],但针对ALT 正常的慢性HBV 感染人群,APRI 的诊断价值有争议。 在 ALT<50 U/L 的慢性 HBV 感染者中,APRI 诊断 F≥3 的 AUC 值可高达 0.81[52],而在 ALT<40 U/L 的 CHB 患者中,APRI诊断F≥2 的AUC 值仅为0.518[53]。目前还没有专门针对IHC 开展的研究证实APRI 在IHC 患者中的诊断价值。 同样的, 肝脏硬度值虽然被各大指南推荐用于评估肝纤维化, 近期我们的研究发现使用肝脏硬度值预测肝脏纤维化时, 肝脏组织显著炎症会影响肝脏肝脏硬度值的诊断价值[54]。 虽然HBsAg<1 000 IU/mL 能较好的预测 IHC,但 Pfefferkorn 等[55]在研究如何更好地诊断IHC 患者时发现,乙型肝炎外膜大蛋白比HBsAg 具有更好的预测IHC 的价值(AUC: 0.89 vs 0.62), 表明外膜大蛋白在确定 IHC的的敏感度和特异度优于HBsAg。 由于pgRNA 在IHC 中具有更低的水平[56-57], 研究发现 pgRNA 和HBcAg 在 IHC 中与 APRI 和 FIB-4 成正相关[58],提示pgRNA 可能可以预测肝脏纤维化。
四、结语
综上所述, 作者认为IHC 并非良性疾病状态,需要更严格的病理标准来定义, 同时需要更好的标志物或需要更精准的无创纤维化检测手段来动态判断IHC 的动态变化。 考虑到已有的一些临床研究显示,不同于高加索人群,我国IHC 人群由于感染的HBV 的基因型及人种因素,导致许多IHC 并非良好结局。 由于目前针对IHC 患者进行peg-IFN 为主的治疗,获得不同比例的临床治愈,因此一些中国学者倾向于对IHC 进行抗病毒治疗,但治疗后长期的临床获益数据未知,且以往的研究多为单中心、小样本的临床研究。 虽然现有的一线口服药物抗病毒能力强,耐药发生率低,长期治疗安全有效,但没有IHC进行口服抗病毒药治疗的临床证据。 建议开展对IHC 患者治疗的研究,提供更多的循证医学证据,如(1)回顾性+前瞻性或前瞻性队列研究:比较IHC 治疗组、 未治疗组和 HBeAg 阴性CHB 治疗组终末肝病事件发生率;(2)随机对照研究:比较IHC 治疗组和未治疗组终末肝病事件发生率。 最后通过药物经济学评价方法获取最佳获益人群,从而指导IHC 患者的管理。 近期由国内学者领衔开展的针对IHC 人群的多中心、大样本临床研究“星光计划”,有望将来为IHC 的诊治提供有力的循证证据。
利益冲突所有作者均声明不存在利益冲突
