表达人CD137 配体重组腺病毒的构建及其抗肿瘤免疫作用的研究
2022-09-05吴洁张柯欣安彤李思奇朱赟陈刚庄昉成高孟
吴洁 张柯欣 安彤 李思奇 朱赟 陈刚 庄昉成 高孟
杭州医学院基础医学院与法医学院,杭州 310053
CD137 配体(CD137L),又名 4-1BBL,属于 TNF超家族成员,是一种Ⅱ型跨膜糖蛋白,以延伸的三叶样螺旋结构发挥其生物学功能。它作为CD137 的高亲和力配体,表达于巨噬细胞、B 细胞、DC 和多种肿瘤细胞等活化的APC 表面[1]。 作为一对重要的共刺激分子,CD137L 与CD137 通过在免疫细胞间传递活化、增殖或者凋亡信号来调节T 细胞介导的免疫反应[2]。 CD137L 与其受体结合,可启动双向信号转导:正向信号可刺激T 细胞活化和增殖,反向信号可刺激B 细胞增殖[3-5]。研究发现,CD137L 及其受体在正常组织及炎症中表达不显著,而在肿瘤组织中呈现高水平表达, 这种表达异常与肿瘤发生、恶化存在一定的相关性[6-8]。因此,以CD137L 与其受体结合作为靶点开展相关研究已成为当前抗肿瘤免疫研究领域的一大热点。 本研究拟采用重组技术用腺病毒表达人的CD137L, 并探索该重组腺病毒在小鼠模型中的抗肿瘤免疫效果,现报告如下。
材料与方法
一、实验材料及仪器
HEK293 细胞和TC-1 肿瘤细胞均购自美国菌毒种库保管中心(ATCC),由杭州医学院基础医学院与法医学院(病毒病所)建库保存;DMEM 液体培养基、 胰蛋白酶、 胎牛血清, 购自 GIBCO 公司;Lipofectamine 2000 转染试剂购自赛默飞公司;PCR反应试剂套盒、 兔抗羊-HRP 酶标抗体、 兔抗羊-FITC、ECL 显色试剂盒购自北京康为世纪;CD137L特异性单抗(sc-11817)购自英国SantaCruz 公司;小鼠特异性IFN-γ ELISPOT kit 购自北京达科为生物技术有限公司;CD137L 重叠多肽库由南京金斯瑞公司合成;PCR 引物由北京擎科生物科技有限公司合成;SOURCE 30Q 和 Sepharose 4FF 购自 Cytiva 公司;SPF 级C57bl/6 小鼠在浙江中医药大学实验动物中心饲养和实验[SYXK(浙)2018-0012]。
主要仪器包括SANYO 细胞培养箱、Olympus 免疫荧光显微镜、BIO-RAD 凝胶成像系统。
二、重组腺病毒的构建
委托北京中美泰和生物技术有限公司对CD137L 氨基酸序列 (Genebank No. NP_003802.1)进行表达密码子优化,使其能在哺乳动物细胞中高效表达, 所得优化后的核苷酸序列通过人工合成,以 Mlu Ⅰ和 Hind Ⅲ两个限制性酶切位点插入pDC316 质粒中,获得pDC316-CD137L 重组穿梭质粒。 用BglⅡ限制性内切酶对pDC316-CD137L 重组穿梭质粒进行线性化, 并与腺病毒骨架质粒pBHGloxΔE1,3Cre 一 起 , 在 脂 质 体 Lipofectamine 2000 作用下共同转染HEK293 细胞单层细胞,培养所得病毒原液再经过3 次挑板纯化,即得所需Ad5-CD137L 重组腺病毒种子。
三、重组腺病毒样本的制备
接种HEK293 至培养瓶中,用含有10%胎牛血清的DMEM 培养基在细胞培养箱中培养(培养条件为37 ℃,5% CO2), 待细胞汇合度达到 90%以上时接种Ad5-CD137L 进行病毒扩增, 收集细胞病变后上清, 用相对分子质量为300 000 的膜胞进行切向流超滤浓缩,再通过SOURCE 30Q 阴离子交换层析和Sepharose 4FF 凝胶排阻层析进行纯化,所得病毒纯化液即为所需的重组病毒样本。
四、重组腺病毒的检测
1. 病毒滴度测定
接种HEK293 至96 孔细胞培养板中, 待细胞汇合度达到90%以上时, 取病毒液按10-1~10-10进行梯度稀释, 取10-3~10-10稀释度的病毒液分别接种至细胞培养板孔中,37 ℃,5% CO2培养箱持续培养5 d 后,显微镜下观察细胞形态各稀释度病毒液的细胞病变情况, 计算出病毒的感染性滴度(IU)[9]。
2. 插入目的基因的鉴定
取病毒样本经沸水浴孵育裂解10 min 后,所得裂解产物以CD137L-F:GCAGAGCTGGTTTAGTGAA CCGTCA 和 CD137L-R:GGACAACCACAACTAGAA TGCAG 为引物对,进行 PCR 扩增,扩增程序:98 ℃预变性 3 min;98 ℃变性 10 s,68 ℃退火 20 s,72 ℃延伸 20 s,29 个循环,72 ℃延伸 5 min。 反应结束,用琼脂糖凝胶电泳鉴定扩增产物的大小,所得PCR产物同时送擎科生物进行测序。
3. 目的蛋白表达的Western 印迹鉴定
取108IU 重组腺病毒Ad5-CD137L 接种至汇合度达到 90%以上 HEK293 单层细胞中,37 ℃、5%CO2条件下培养48 h, 同时以空的腺病毒载体为对照。 收集感染细胞,沸水浴裂解后,行SDS-PAGE 胶电泳并转印至硝酸纤维素膜上。 经脱脂奶粉封闭后,加 CD137L(C-20)单克隆抗体(1∶500)4 ℃孵育过夜,洗膜 3 遍后,加兔抗羊 HRP 酶标抗体(1∶2 000)室温孵育30 min 后,经ECL 增强后曝光显色。
4. 目的蛋白表达的免疫荧光法鉴定
分取106和108IU 的重组腺病毒Ad5-CD137L接种至汇合度达到90%以上的HEK293 单层细胞中,37 ℃、5%CO2条件下培养 48 h,同时以空腺病毒载体为对照;用胰酶消化细胞,1 500 转/min(离心半径为3 cm) 离心5 min 弃上清, 将细胞滴在载玻片上,用封闭液作用10 min 后晾干;加CD137L(C-20)单克隆抗体(1∶100)4℃孵育过夜;洗涤 3 遍后加兔抗羊-FITC (1∶200)37 ℃孵育 1 h, 洗涤 3 遍后加95%甘油封片,在荧光显微镜下观察结果并拍照。
五、重组腺病毒的抗肿瘤免疫实验
1. 小鼠特异性细胞免疫检测
将重组腺病毒 Ad5-CD137L 免疫 6 ~8 周龄C57BL/6 小鼠,同时以空腺病毒为对照,并以未接种的小鼠作为空白组,每组3 只小鼠,按108IU /只剂量接种;在初次免疫第14 天处死小鼠,制备脾脏淋巴细胞悬液,按每孔5×105个细胞量,接种至预包被IFN-γ 抗体的酶联细胞免疫检测板中, 每个样本都作复孔。用CD137L 的重叠多肽库作为刺激物,按照Elispot 试剂盒说明书操作检测。 结果取两复孔的平均值作为免疫小鼠的效应细胞数。
2. 小鼠TC-1 肿瘤模型的抑制试验
培养TC-1 肿瘤细胞,按2×104个的细胞量将细胞接种于每只C57BL/6 小鼠左腿皮下, 获得小鼠TC-1 肿瘤模型。 在肿瘤模型建立的24 h 后,重组腺病毒Ad5-CD137L 组和空腺病毒载体组按每只小鼠108IU 的剂量接种于小鼠大腿右侧肌肉,每个实验组设10 只肿瘤模型小鼠,同时设立对照组。观察对各个小鼠的肿瘤生长情况并进行肿瘤大小检测,根据肿瘤半径(r)和长度(L)计算瘤块体积
六、统计学分析
采用GraphPad Prism 5.01 进行统计分析,组间比较采用t 检验。 P<0.05 表示差异有统计学意义。
结 果
一、重组腺病毒Ad5-CD137L 的构建
密码子优化后的CD137L 蛋白表达基因, 通过MluⅠ和HindⅢ两个酶切位点插入pDC316 质粒,获得重组穿梭质粒pDC316-CD137L(图1)。 所得重组穿梭质粒pDC316-CD137L 和腺病毒骨架质粒pBHGloxΔE1,3Cre 用脂质体 Lipofectamine 2000 共同转染HEK293 细胞, 转染后7~10 d 显微镜下观察:HEK293 细胞形态由贴壁的梭形、多角形,胞浆透亮,逐渐改变为细胞圆缩,胞内颗粒增多,细胞间隙增大,出现明显的病毒噬斑,随着时间的推移最后细胞完全脱落(图2)。

图1 pDC316-CD137L 重组穿梭质粒图

图2 重组穿梭质粒和腺病毒骨架质粒共转染后细胞病变图(×100)
二、重组腺病毒的检测结果
1. 插入目的基因的鉴定
利用特异性引物对病毒样本基因组进行PCR检测, 所得PCR 产物在约1 000 bp 处有一特异性条带(见图3),条带大小与理论相符,且所得PCR产物的测序结果也与理论一致。
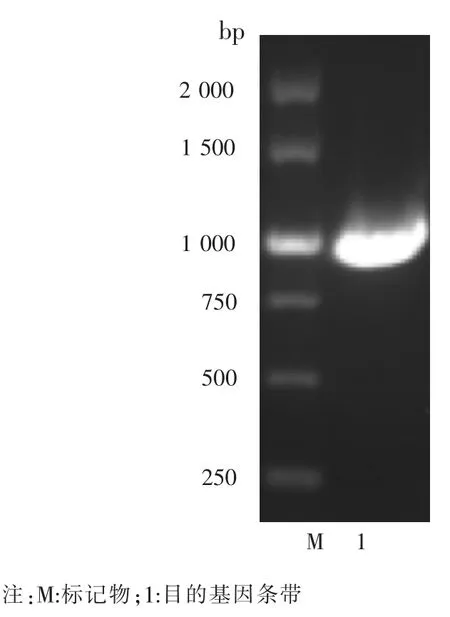
图3 重组腺病毒插入目的基因PCR 电泳图
2. 目的蛋白表达的免疫印迹鉴定
图 4 所示, 感染 Ad5-CD137L 重组腺病毒的HEK293 细胞在相对分子质量约25 000 处有一条特异的免疫印迹条带, 而感染空腺病毒的HEK293细胞则未见特异性条带。

图4 免疫印迹法鉴定重组腺病毒目的蛋白表达的结果
3. 重组腺病毒Ad5-CD137L 蛋白表达的免疫荧光鉴定
如图5 所示,Ad5-CD137L 感染后细胞与特异性抗体结合后通过荧光标记二抗的捕获,在荧光显微镜下可观察到荧光细胞,而Ad5 空病毒未观察到荧光细胞。
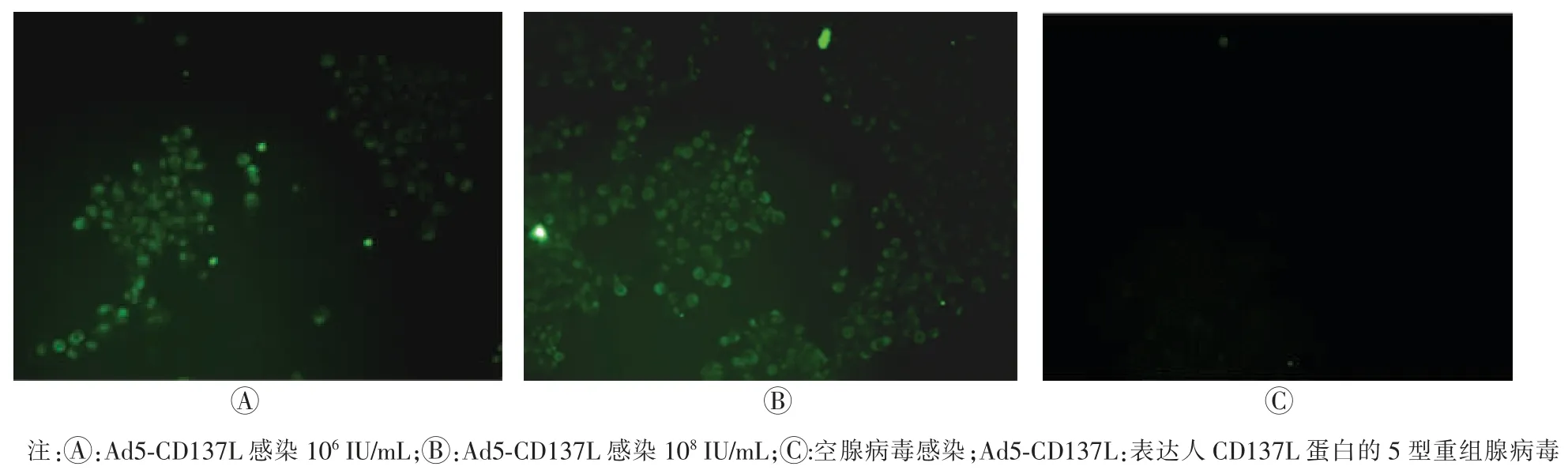
图5 免疫荧光法鉴定重组腺病毒目的蛋白表达的结果(×100)
三、 重组腺病毒Ad5-CD137L 诱导小鼠体内特异性细胞免疫作用
空白组小鼠脾淋巴细胞分泌IFN-γ 的效应T细胞数为(4±4)SFC/5×105cells;空腺病毒免疫组为(10±5)SFC/5×105cells,与空白组比较差异无统计学意义 (t=1.707,P=0.163);Ad5-CD137L 重组腺病毒组为(288±76)SFC/5×105cells,显著高于空腺病毒组(t=6.315,P=0.003)。
四、 重组腺病毒Ad5-CD137L 在小鼠体内的抗肿瘤免疫效果
肿瘤模型建立后小鼠TC-1 肿瘤均处于生长初期,在第 14、21、29 和 39 天观察肿瘤生长状况并测量大小,结果显示在不同的观察时间空腺病毒组与空白组间肿瘤大小的差异均没有统计学意义 (t14d=0.504, t21d=0.755, t29d=2.018, t39d=1.884,P 均>0.05)。
肿瘤模型建立第14 天时,Ad5-CD137L 重组腺病毒组的肿瘤体积小于空白组,两组间比较差异有统计学意义(t14d=2.908,P=0.012); 第 21、29 和 39 天时,Ad5-CD137L 重组腺病毒组相比空腺病毒组、空白组的肿瘤体积均缩小,组间比较差异有统计学意义 (t21d=8.275、7.798;t29d=4.492、7.113;t39d=5.101、10.540;P 均<0.001)。 具体结果见图 6。

图6 重组腺病毒Ad5-CD137L 抑制TC-1 小鼠肿瘤模型实验结果
讨 论
肿瘤细胞介导的CD137L/CD137 异常表达已在很多肿瘤中被发现,包括直肠癌、黑色素瘤、卵巢癌等恶性肿瘤[10-12]。目前,已有一些CD137 抗体药物被批准开展用于恶性肿瘤免疫治疗的临床试验,并且展现出一定的抗肿瘤治疗效果[13-14]。 因此推测,基于表达CD137L 的重组腺病毒作为肿瘤免疫治疗的策略具有一定的可行性。
由于在临床应用中已表现出良好的安全性[15-16],本文选择非复制型的5 型腺病毒作为载体。 本研究构建的表达CD137L 的重组5 型腺病毒载体, 在免疫小鼠体内产生显著的特异性细胞免疫反应,同时在抗肿瘤免疫效果试验中,Ad5-CD137L 重组腺病毒组肿瘤大小明显缩小, 表明Ad5-CD137L 重组腺病毒能在一定程度上抑制了TC-1 肿瘤细胞在小鼠体内的增殖,展现了出较好抗肿瘤免疫效果。 Zhang等[17]构建了一个共表达PD-1 和CD137L 的重组腺病毒,该重组腺病毒也能在小鼠体内诱导产生显著的特异性细胞免疫反应,且具有抑制体内肝癌细胞增殖的效果,与本研究的结果具有相似的效果。
综上所述, 以CD137L/CD137 为靶抗原开展药物研究,通过诱导机体产生特异性细胞毒性T 淋巴细胞来实现抗肿瘤免疫治疗有着一定的临床应用潜力。应用生物技术,将CD137L 通过病毒载体在体内表达或CD137L cDNA 定向转移至肿瘤细胞并高效表达,进而与T 细胞表面CD137 结合,共刺激T细胞,这种转染或转导修饰肿瘤细胞的策略在抗肿瘤免疫治疗及疫苗制备中具有广阔应用前景[18-20]。后续,我们将开展进一步的研究,包括免疫剂量效应、免疫细胞的分化情况、不同肿瘤模型的适应性以及高等级非人灵长类动物实验等,从而进一步验证临床前研究的可行性。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明吴洁:整理资料、论文撰写;张柯欣、安彤、李思奇:收集资料;朱赟、陈刚:处理数据,分析统计;庄昉成、高孟:设计、指导、修改稿件
