D-二聚体与免疫球蛋白A比值对初诊伴胃肠道受累的过敏性紫癜患儿急性期肾损害的评估价值
2022-09-03肖梦宇魏圣洁窦留瑞李梦丽牛晓娜牛俊伟白炎亮
李 丹, 刘 炜, 肖梦宇, 魏圣洁, 窦留瑞,李梦丽, 牛晓娜, 牛俊伟, 白炎亮, 孙 恺
(1. 郑州大学人民医院 血液科, 河南 郑州, 450003; 2. 河南省儿童医院 血液科, 河南 郑州, 450003;河南省人民医院, 3. 儿科, 4. 血液科, 河南 郑州, 450003)
过敏性紫癜(HSP)是儿童最常见的系统性血管炎,其临床特征包括非血小板减少性可触及的紫癜,以及胃肠道、关节和肾脏等受累[1]。皮肤受累是HSP最常见的临床特征,胃肠道受累常表现为腹痛、恶心和呕吐,甚至会出现胃肠道出血[2]。肾脏受累的特点是出现血尿或蛋白尿,而且HSP的长期预后是由肾脏损害的严重程度决定的[3], 因此应密切监测肾功能,并及时进行治疗。临床上诊断肾脏损害的方法主要是常规尿液分析和肾活检。尿液分析具有简单、无创且快速等优点,但敏感度和特异度较差。肾活检是评估肾脏损伤程度的金标准,但其有创性导致临床应用受限[4]。研究[5-6]显示,肾脏损害除了与发病年龄、持续1个月以上的紫癜和凝血因子减少等因素有关,还与胃肠道症状和D-二聚体(D-D)水平升高有关。本研究探讨D-D、免疫球蛋白A(IgA)、D-D与IgA比值(D-D/IgA)与初诊时伴有胃肠道受累的HSP患儿急性期肾脏损害的关系,现将结果报告如下。
1 资料与方法
1.1 一般资料
采用回顾性研究设计,选取2018年12月—2021年5月在郑州大学人民医院及河南省儿童医院治疗的148例HSP患儿为研究对象。纳入标准: ① 符合2008年欧洲风湿病联盟/儿童风湿病国际研究组织/儿童风湿病联盟(EULAR/PRINTO/PRES)的HSP诊断标准者[7]; ② 所有患儿均为首发病例,既往无HSP和其他慢性病病史; ③ 在接受检查前未使用过糖皮质激素和其他免疫抑制剂者。排除既往有慢性炎症疾病和慢性肾脏疾病的患儿。
148例初诊HSP患儿的年龄为1~17岁,中位年龄8岁; 男81例,女67例; 患儿确诊时均有不同程度的皮肤紫癜,其中仅双下肢皮肤紫癜者126例,同时出现臀部、双上肢和(或)腘窝皮肤紫癜者64例; 初诊时即伴有肾脏损害患儿38例; 初诊时即伴有胃肠道受累患儿70例,其中51例出现腹部疼痛, 40例出现胃肠道出血; 初诊时有关节症状者51例; 20例患儿在急性期出现肾脏损害。
胃肠道受累是指出现腹痛、呕吐或便血、呕血的临床症状和(或)大便隐血。肾脏损害是指出现血尿(每个高倍镜视野中>5个红细胞)和(或)蛋白尿[尿中蛋白含量≥30 mg/dL, 或尿蛋白与肌酐比值<0.5(<2岁的儿童)或<0.1(≥2岁的儿童)]。急性期定义为患儿出现任何与HSP相关的临床症状(如关节炎、腹痛、血尿或紫癜)的时期。根据胃肠道受累的临床表现将HSP患儿分为无胃肠道受累组(n=78)、胃肠道受累组(n=70)。根据急性期肾脏损害发生情况将胃肠道受累组分为2个亚组,即肾脏损害组(n=20)、无肾脏损害组(n=50)。胃肠道受累组患儿在初诊时均未出现肾脏损害。本研究严格遵守《赫尔辛基宣言》的相关要求,获得医院研究伦理委员会的批准,纳入研究的患儿父母或法定监护人均对本研究内容知情同意。
1.2 评价指标
记录患儿的临床信息,包括年龄、性别、D-D、IgA、纤维蛋白原水平、肌酐水平、尿素水平、白细胞计数、中性粒细胞计数、淋巴细胞计数、血红蛋白水平、血小板计数、尿液分析和大便隐血试验结果,分析皮疹、腹痛及血尿和(或)蛋白尿的表现。计算中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)。
1.3 统计学分析
应用SPSS 26.0软件和GraphPad Prism 8.0进行统计分析,非正态分布连续性计量资料以中位数(四分位数)[M(Q1,Q3)]表示,组间比较采用非参数秩和检验Mann-WhitneyU检验; 计数资料比较采用χ2检验; 采用多因素Logistic回归分析探讨初诊时伴有胃肠道受累患儿急性期肾脏损害的影响因素;P<0.05为差异有统计学意义。
2 结 果
2.1 胃肠道受累组与无胃肠道受累组患儿的临床特征比较
胃肠道受累组与无胃肠道受累组在年龄、性别分布、D-D水平、纤维蛋白原水平、IgA、D-D/IgA、白细胞计数、中性粒细胞计数、NLR、血小板计数、PLR方面比较,差异有统计学意义(P<0.05或P<0.01), 表现为胃肠道受累组患儿年龄、IgA水平较无胃肠道受累组患儿更低,其他指标均较高,见表1。
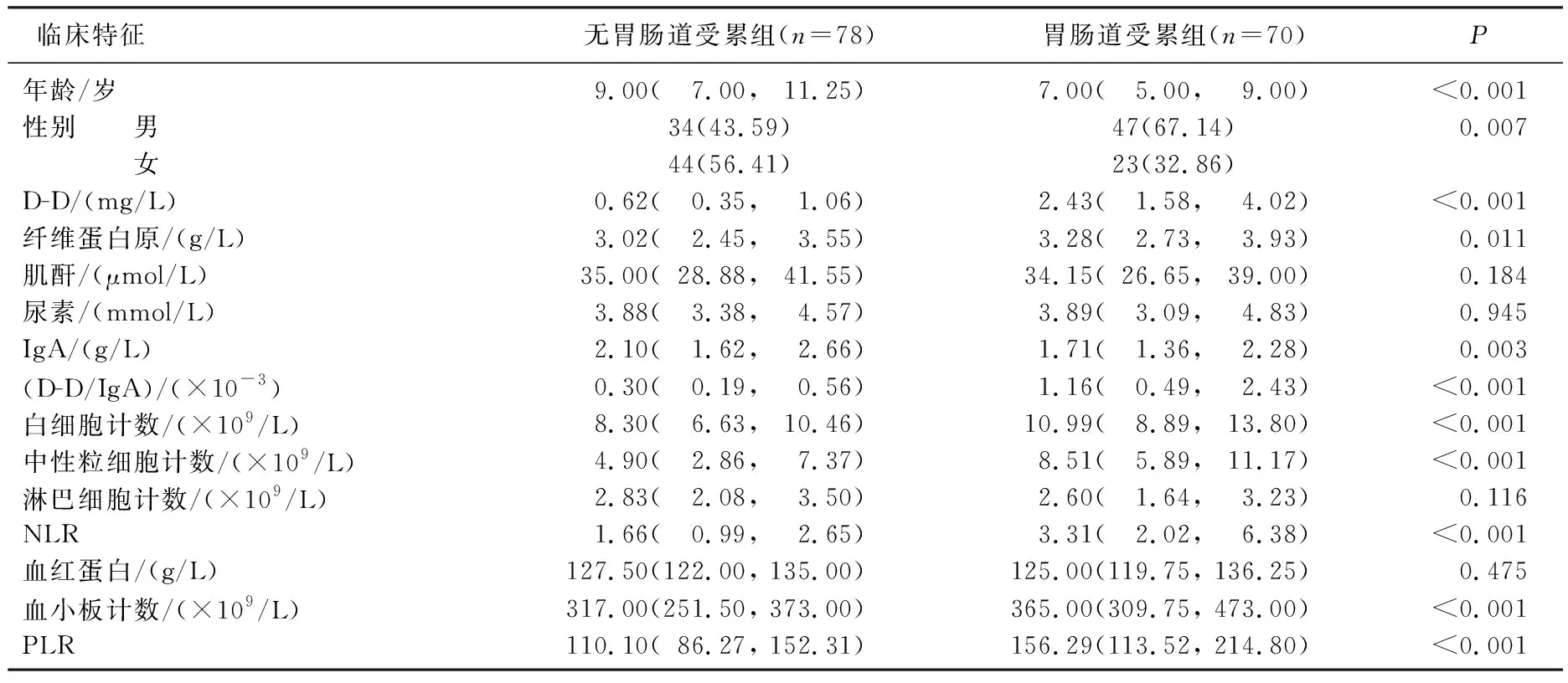
表1 初诊时伴有胃肠道受累与无胃肠道受累患儿的临床特征比较[n(%)][M(Q1, Q3)]
2.2 胃肠道受累组中肾脏损害与无肾脏损害患儿的临床特征比较
在胃肠道受累组中,有20例患儿发生了急性期肾脏损害,从诊断到出现肾脏损害的时间为4~16 d, 中位时间为7 d。肾脏损害组患儿年龄、IgA水平、D-D/IgA低于无肾脏损害组患儿, D-D水平高于无肾脏损害组患儿,差异有统计学意义(P<0.01), 见表2。

表2 胃肠道受累组中肾脏损害与无肾脏损害患儿的临床特征比较[n(%)][M(Q1, Q3)]
2.3 初诊时胃肠道受累合并急性期肾脏损害的HSP患儿的多因素Logistic回归分析
以初诊时伴有胃肠道受累且急性期出现肾脏损害为因变量,将年龄、IgA、D-D/IgA纳入Logistic回归模型(D-D与D-D/IgA在初诊时伴有消化道受累的HSP患儿中存在强线性相关关系,故只纳入D-D/IgA), 结果表明D-D/IgA(OR=1.999, 95%CI: 1.245~3.349,P=0.005)是初诊时伴有胃肠道损害的HSP患儿急性期发生肾脏损害的唯一相关因素,见表3。受试者工作特征(ROC)曲线显示, D-D/IgA的曲线下面积(AUC)为0.783(95%CI: 0.668~0.873,P<0.001), 当D-D/IgA的最佳截断值为1.48×10-3时,敏感度和特异度分别为62%和85%, 见图1。

表3 初诊时伴胃肠道受累且急性期出现肾脏损害的HSP患儿的多因素分析
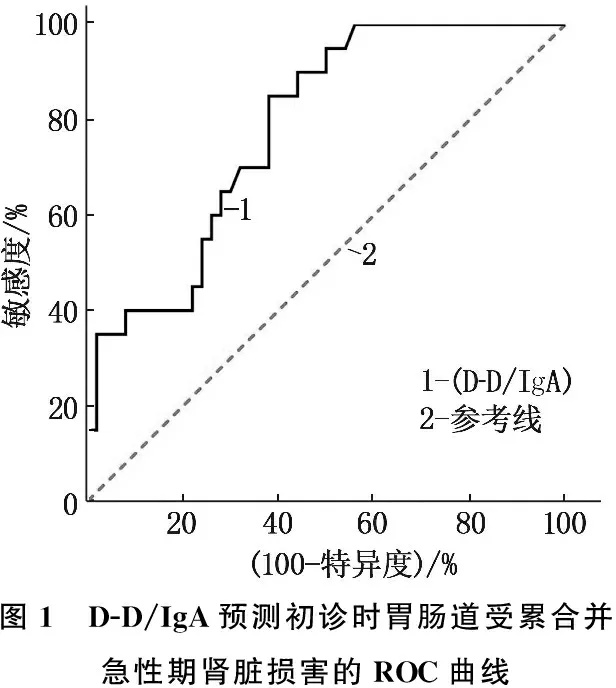
图1 D-D/IgA预测初诊时胃肠道受累合并急性期肾脏损害的ROC曲线
3 讨 论
目前,HSP的确切发病机制尚未完全阐明,临床多认为其是一种免疫复合物介导的小血管炎。以IgA为主的免疫复合物沉积在HSP患儿的皮肤、胃肠道毛细血管和肾小球中[8]。肾脏损害是影响HSP患儿预后的重要因素, 20%~54%的HSP患儿可能出现肾脏损害[6]。本研究胃肠道受累组患儿在初诊时并未出现血尿和(或)蛋白尿,但有20例患儿出现急性期肾脏损害,从诊断到出现肾脏损害的中位时间为7 d。肾脏损害可能延迟数周,很容易被忽略,进而发展为慢性肾脏病,影响患儿身体健康[9]。伴有胃肠道症状的患儿有发生肾脏损害的风险[10-11], 因此需要对此类患儿进行密切监测。
HSP主要是由免疫复合物沉积引起的,可引发血管内皮细胞损伤,激活凝血系统和微血栓的形成[12]。本研究发现,胃肠道受累组与无胃肠道受累组在年龄、男性患儿数量、D-D水平、纤维蛋白原水平、IgA、D-D/IgA、白细胞计数、中性粒细胞计数、NLR、血小板计数、PLR等方面比较,差异有统计学意义(P<0.05或P<0.01), 表现为胃肠道受累组患儿年龄、IgA水平较无胃肠道受累组患儿更低,其他指标均较高。研究[13]表明, D-D水平可反映HSP急性期的胃肠道受累情况,而且D-D与临床症状的关系更为密切。研究[14]表明,与无肾脏损害的患儿相比,有肾脏损害的HSP患儿的D-D水平更高。本研究发现在伴有胃肠道受累的HSP患儿中,发生急性期肾脏损害者的D-D水平高于无肾脏损害者。
研究[15]表明, HSP发生肾脏损害时IgA会升高,也有研究[16]表明IgA与肾脏损害之间没有必然的联系。本研究中,与初诊时不伴有胃肠道受累的患儿相比,伴有胃肠道受累的患儿IgA水平降低; 初诊时伴有胃肠道受累且发生急性期肾脏损害患儿的IgA水平低于未发生肾脏损害的患儿,推测可能是IgA沉积引起HSP组织损伤,当其沉积在肾脏组织时可激活肾小球系膜细胞,从而使机体释放多种炎症介质,引起肾小球损伤。
本研究中,20例初诊时有胃肠道受累的患儿出现了急性期肾脏损害的表现,这些患儿的D-D水平升高,但IgA、D-D/IgA水平低,年龄也较小。分析原因为本研究纳入的均为初诊时伴有胃肠道受累的患儿,且年龄越小的患儿胃肠道受累越严重[17], 则D-D水平越高越容易发生肾脏损害[6, 18]。Logistic回归分析显示, D-D/IgA是初诊时伴有胃肠道受累的HSP患儿出现急性期肾脏损害的相关因素。
综上所述,对于初诊时有胃肠道损害的HSP儿童,可通过D-D/IgA监测出现急性期肾脏损害的风险,进而采取有效的措施来保证患儿的生命安全。
