体外膜肺氧合患者医院感染病原菌分布及危险因素分析
2022-09-03郑瑞强李向惠
宋 琳, 林 华, 郑瑞强, 蒋 伟, 李向惠, 邵 俊
(1. 扬州大学医学院, 江苏 扬州, 225001;2. 江苏省苏北人民医院/扬州大学临床医学院 重症医学科, 江苏 扬州, 225001;3. 大连医科大学, 辽宁 大连, 116044;4. 江苏省苏北人民医院/扬州大学临床医学院 心脏大血管中心ICU, 江苏 扬州, 225001)
体外膜肺氧合(ECMO)是一种改良的心肺旁路术,其工作原理是将静脉血从体内引出,通过人工膜肺进行氧合后泵入患有严重心肺衰竭患者的体内,进而维持体外呼吸与循环[1]。ECMO起源于20世纪60年代末,HILL J D等[2]在1971年成功应用其救治了1例严重呼吸窘迫综合征(ARDS)的成年男性患者。近10年来, ECMO在中国的应用迅速增多,尤其在新型冠状病毒肺炎疫情期间,ECMO在难治性低氧性呼吸衰竭患者的治疗中发挥了重要的作用[3-4]。尽管ECMO的效果显著,但接受ECMO治疗患者的病死率仍很高[5], 这是因为接受ECMO治疗的患者病情多危重,而作为侵入性的有创操作, ECMO也会造成一系列的并发症,其中医院感染是最常见的并发症之一。研究[6]报道40.8%的接受ECMO治疗的心脏术后患者会发生医院感染,其病死率高达55.1%。本研究分析接受ECMO治疗的患者的医院感染情况及病原菌耐药性,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2016年8月—2021年2月在江苏省苏北人民医院重症医学科接受ECMO治疗的患者为研究对象。纳入标准: ① 年龄≥18岁者; ② 接受ECMO治疗≥48 h者。排除标准: ① ECMO治疗48 h内撤机或死亡者; ② 在外院接受过ECMO治疗者。根据《医院感染诊断标准(试行)》, ECMO相关医院感染定义为: ECMO启动后24 h至ECMO停止后48 h内发生的医院感染。
1.2 研究方法
采用回顾性观察性研究方法,根据ECMO术后感染情况,将患者分为感染组和非感染组。收集并比较2组患者临床资料,包括年龄、性别、基础疾病史、机械通气及ECMO辅助时间、中心静脉置管时间及导尿管留置时间,以及是否发生医院感染、感染部位、病原菌及药敏结果、抗菌药使用时间、ICU转归等。采用Vitek-2细菌鉴定仪或API系统鉴定分离菌落(均购自法国生物梅里埃公司)。质控菌株为鲍曼不动杆菌(ATCC19606)、肺炎克雷伯菌(ATCC700603)等,均来自国家临床实验室中心。
1.3 统计学方法

2 结 果
2.1 一般情况
共纳入76例接受ECMO治疗的患者,男49例,女27例,平均年龄为(52.49±16.00)岁; 重症肺炎28例,呼吸心跳骤停5例,急性心肌梗死9例,肺栓塞4例,病毒性心肌炎19例,其他疾病11例; ECMO辅助模式为V-A模式57例, V-V模式19例。治疗期间共计发生医院感染41例、48例次,医院感染发病率为53.95%, 例次发病率为63.16%。76例患者ICU病死率为55.26%, 感染组ICU病死率为53.66%,非感染组ICU病死率为57.15%, 差异无统计学意义(P=0.761)。
感染来源包括下呼吸道感染51例,血液感染9例,泌尿道感染4例,皮肤及软组织感染2例。共检出病原菌67株,其中革兰氏阴性杆菌57株(85.07%),革兰氏阳性球菌6株(8.96%), 真菌4株(5.97%)。送检标本中,痰标本51株(76.12%), 其次为血标本9株(13.43%)。51例下呼吸道感染样本中,革兰氏阴性杆菌47例(92.16%), 其中鲍曼不动杆菌19例(37.25%), 是最常见的致病菌; 9例血液感染样本中,革兰氏阴性杆菌5例(55.56%),凝固酶阴性葡萄球菌3例(33.33%)。不同部位病原菌分布情况见表1。

表1 ECMO术后医院感染病原菌分布及构成比(n=67)[n(%)]
2.2 病原菌耐药分析
共检出多重耐药菌45株(67.16%), 以革兰氏阴性杆菌为主,鲍曼不动杆菌对替卡西林、米诺环素、哌拉西林耐药率达100.00%; 肺炎克雷伯菌对哌拉西林、替卡西林、哌拉西林/他唑巴坦耐药率达100.00%; 鲍曼不动杆菌、肺炎克雷伯菌对美罗培南耐药率分别为68.42%、77.78%,对亚胺培南耐药率分别为73.68%、66.67%。见表2。6株革兰氏阳性球菌中,4株葡萄球菌对万古霉素敏感,对苯唑西林耐药率为75.00%。见表3。
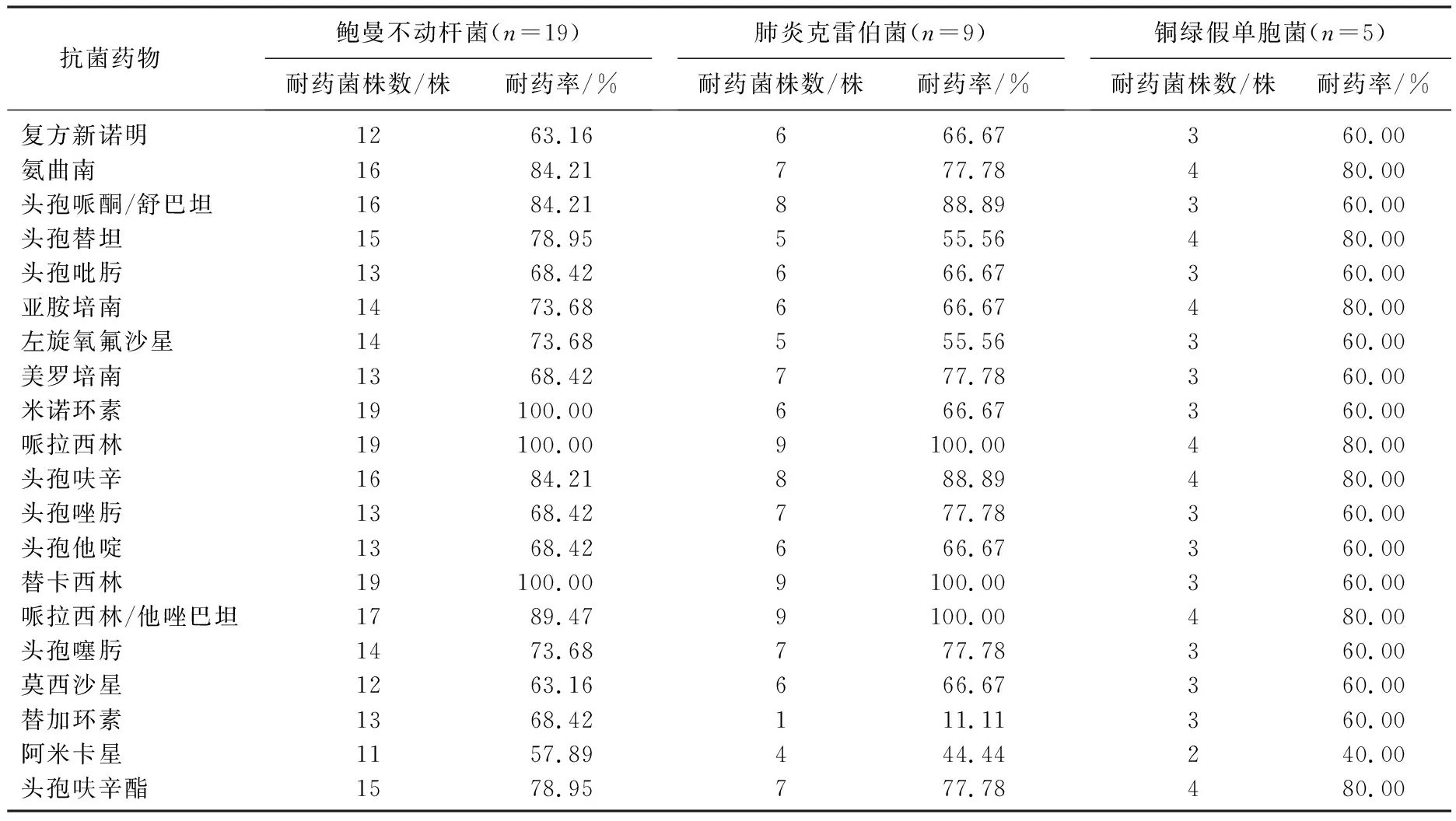
表2 主要革兰氏阴性菌对抗菌药物的耐药率
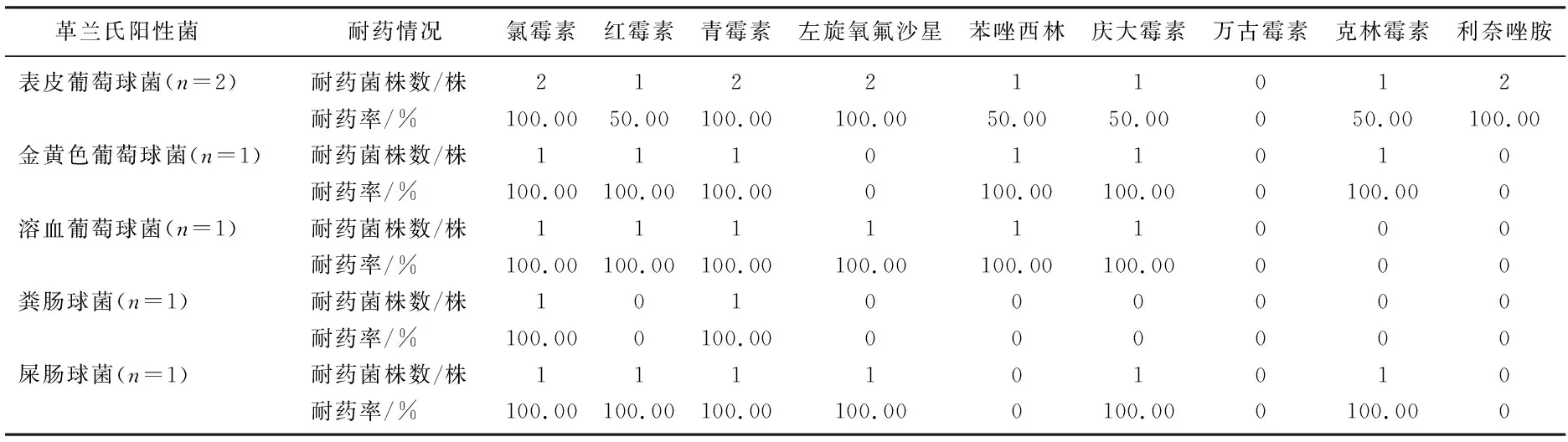
表3 主要革兰氏阳性菌对抗菌药物的耐药率
2.3 ECMO术后相关医院感染危险因素分析
单因素分析显示, 2组患者在年龄、机械通气时间、ECMO辅助时间、抗菌药物使用时间、中心静脉置管时间、导尿管置管时间方面比较,差异有统计学意义(P<0.05或P<0.01), 见表4。二元Logistic回归分析显示, ECMO辅助时间、机械通气时间是发生医院感染的独立危险因素(P<0.05), 见表5。ROC曲线分析显示, ECMO辅助时间预测ECMO后医院感染的曲线下面积(AUC)为0.812, 最佳临界值为128.04 h, 敏感性为68.3%, 特异性为85.7%; 机械通气时间预测ECMO后医院感染的AUC为0.873, 最佳临界值为64.48 h, 敏感性为97.6%, 特异性为68.6%。见表6、图1。
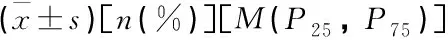
表4 ECMO术后医院感染的单因素分析
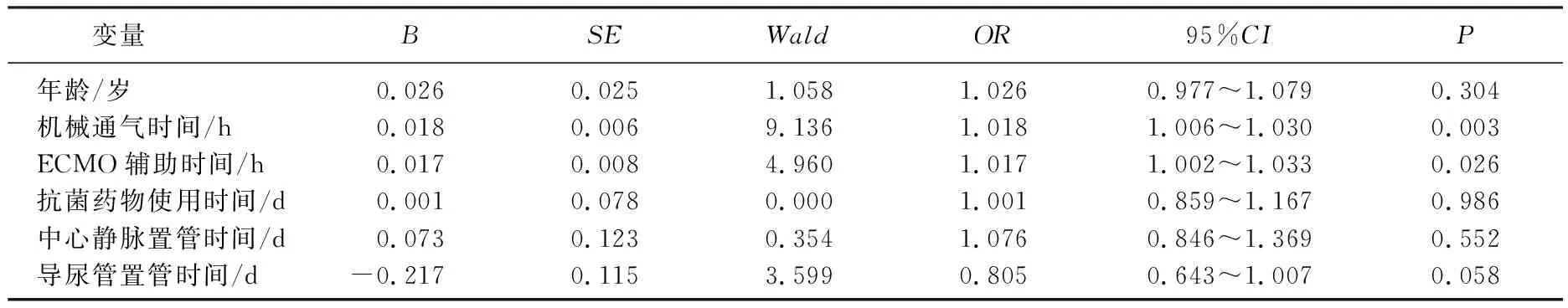
表5 ECMO术后发生医院感染危险因素的Logistic回归分析

表6 ECMO辅助时间及机械通气时间对ECMO后医院感染预测价值的ROC曲线分析结果

图1 ECMO辅助时间及机械通气时间对ECMO后医院感染预测价值的ROC曲线
3 讨 论
在接受ECMO治疗的患者中,医院感染可使患者死亡风险大幅增高[7], 因此评估ECMO相关医院感染的发生率和危险因素对预防和控制ECMO相关医院感染尤为重要。研究[8-10]显示, ECMO相关医院感染发病率为8.7%~64.0%, 本研究共纳入了76例接受ECMO支持治疗的患者,医院感染发病率为53.95%, 与GRASSELLI G等[11]研究显示的55.0%医院感染发病率相近。本研究中,术后主要感染部位为下呼吸道(76.12%), 主要为呼吸机相关性肺炎,与相关研究[12]结果一致。研究[13]显示, ECMO术后医院感染以血流感染为主,这可能与纳入研究的患者自身疾病特征有关。重症肺炎、呼吸衰竭等患者的机械通气时间长,长期机械通气破坏原有黏膜屏障,阻碍纤毛运动,使得口腔菌群下移,易导致细菌滋生。心源性疾病患者机械通气时间短,心脏机械辅助治疗措施如主动脉内球囊反搏术、临时起搏器置入等各种导管置入较多,血管内留置血导管时间长,故血流感染发生率高[14]。
KUMAR S等[15]研究结果显示,近年来医院感染病原菌以革兰氏阴性菌为主,其他研究[16]也得到了相似结果。本研究检出病原菌也以革兰氏阴性杆菌(57株)为主,与上述研究结果一致。值得注意的是,本研究共检出多重耐药菌45株(67.16%), 以鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌为主,其中鲍曼不动杆菌、肺炎克雷伯菌对美罗培南耐药率分别为68.42%、77.78%, 对亚胺培南耐药率分别为73.68%、66.67%, 与目前ICU医院感染流行病学数据[17]相似。近年来,由于碳青霉烯类抗生素的广泛使用,耐碳青霉烯类肠杆菌科细菌(CRE)日益常见,全国细菌耐药监测网2014—2019年细菌耐药性监测报告指出,耐碳青霉烯类肺炎克雷伯菌(CRKP)作为医院CRE感染的主要病原菌,在中国的检出率从2014年的6.4%已上升至2019年的10.9%, 2019年全国重症医学科患者CRKP检出率最高(23.0%)。多黏菌素可能代表了近几十年来对革兰氏阴性多重耐药菌抗生素治疗方案的支柱,基于多黏菌素的治疗组合已在体外和体内广泛研究,并已在临床环境中用于治疗多重耐药菌[18]。然而,由于其副作用,特别是肾毒性,多黏菌素的使用受到限制,因此有研究报道了基于非多黏菌素的联合治疗方案,如磷霉素联合舒巴坦、美罗培南联合舒巴坦等可能在治疗CRE中起作用,但需要进一步的临床研究来验证[19]。此外,头孢地尔作为一种新型铁载体头孢菌素,其对不同感染部位的耐碳青霉烯类和多耐药革兰氏阴性杆菌均表现出高度活性。一项体外实验[20]发现,头孢地尔对 94%的多黏菌素耐药分离株具有活性,并且与美罗培南、阿米卡星、替加环素等具有协同活性。本研究共检出3株凝固酶阴性葡萄球菌,占总葡萄球菌数的75%, 这些球菌多为皮肤表面正常菌群,现已逐渐成为血流感染的重要病原菌,这可能与大量侵入性操作及患者免疫抑制状态有关[21]。药敏结果显示,葡萄球菌对青霉素、氯霉素等普遍耐药,对苯唑西林的耐药率为75%,所检出的革兰氏阳性球菌对万古霉素和利奈唑胺均敏感,这为临床经验性抗菌药物选择提供了一定的数据支持。
本研究单因素分析显示,感染组的年龄、导尿管置管时间、ECMO辅助时间、机械通气时间、中心静脉置管时间、抗菌药物使用时间均显著高于或长于非感染组, ECMO支持的患者大多伴有严重的全身炎症反应,需要进行侵入性操作来监测及维持患者生命体征的平稳,而这些操作均是易感的高危因素,并且操作过程中反复穿刺、操作时间过长、无菌操作不规范等都会增加患者感染的可能性。此外, ECMO患者在后续的临床治疗中,监护室医生三级查房、换药,护士跨房间护理以及护工的协助护理等都不可避免会与不同患者接触,增加了患者医院感染的风险,这其中除了应合理树立严格的无菌观念外,手卫生制度也显得尤为重要,有相关研究[22]报道显示在ICU医护人员加强无菌制度及手卫生制度监管、合理使用抗菌用品后,医院感染的发生率显著降低。Logistic回归分析显示,机械通气时间、ECMO辅助时间是ECMO术后医院感染的独立危险因素, ROC曲线分析显示机械通气>64.48 h、ECMO辅助时间>128.04 h与患者感染风险增加相关,进一步表明应及时、准确地评估患者病情,尽早撤除机械通气以及ECMO辅助设备,以减少继发性感染。本研究中感染部位以下呼吸道为主,主要为呼吸机相关性肺炎, ELLOUZE O等[23]研究了57例接受体外生命支持患者早期拔管对预后的影响, 15例患者进行了早期拔管,术后平均拔管时间为(3.3±1.6) d, 呼吸机相关性肺炎发生率为27%, 30 d存活率为73%, 显著高于非拔管组,其他研究[24]也得到了类似的结果,这也进一步验证了本研究中ROC曲线分析的结果。此外,一项接受ECMO治疗患者的大型回顾性队列研究[25]发现, ECMO治疗期间使用预防性抗生素可以降低住院病死率和院内肺炎发生率。近年来,清醒ECMO作为一种不需要插管、镇静并且保留患者自主呼吸的治疗策略,可极大程度地降低患者ECMO术后肺部感染的可能,并在一定程度上可以改善患者预后,但也存在呼吸监测困难及管路扭曲、移位甚至脱落等问题。本研究为单中心回顾性分析研究,样本量小,纳入的影响因素偏少, ECMO置管方式、ECMO置管时间、ECMO置管部位、ICU住院时间、手卫生制度的监管及患者各种侵入性操作次数等因素并未纳入回归分析,需在后续研究中完善。
综上所述, ECMO术后医院感染率较高,下呼吸道为主要感染部位,病原菌多为革兰氏阴性杆菌,多重耐药菌比例高,机械通气时间和ECMO辅助时间是发生医院感染的独立危险因素。
