高温与碳化对铝酸盐水泥水化产物氯离子结合稳定性的影响
2022-09-02陈钰婷王中平朱哲誉徐玲琳
陈钰婷,王中平,2,彭 相,朱哲誉,徐玲琳,2,*
(1.同济大学 材料科学与工程学院,上海 201804;2.同济大学先进土木工程材料教育部重点实验室,上海 201804)
氯盐腐蚀是导致海洋环境中钢筋混凝土结构耐久性降低的重要原因[1-2].氯离子进入水泥基材料后,或与某些水泥相反应形成Friedel′s盐(C3A·CaCl2·10H2O),抑或被吸附于水化产物或者孔壁上,前者称为氯离子化学结合,后者称为氯离子物理吸附[3].研究表明,水泥浆体对氯离子的结合利于改善结构的抗氯离子腐蚀性[3-4].但硬化水泥石中易结合氯离子的主要矿物相具有不稳定性,在高温或碳化作用下,非稳定结合的氯离子或被释放,造成再次腐蚀风险,这在硅酸盐水泥体系中已得到验证.例如,升温使硅酸盐水泥石的氯离子结合量逐渐增加[5-6],而过高温度又致使其降低[7];低氯盐浓度条件下,升温导致氯离子结合量降低,而高氯盐浓度条件下相反[8];碳化不但使水化产物丧失氯离子结合能力,而且导致Friedel′s盐溶解[9-13],对水泥石的氯离子结合起负面作用.
铝酸盐水泥(calcium aluminate cement,CAC)的水化产物具有优异的化学结合氯离子能力[4,14],有望用于海洋工程.然而,CAC水化过程受温度影响显著,其水化产物CAH10和C2AH8在高温下易转变为稳定的C3AH6[15-16],降低了CAC的氯离子结合稳定性.近年来,围绕CAC水化产物的物相稳定性提升开展了系统研究.如Falzone等[17]和姚燕等[18]发现,硝酸钙改性CAC浆体中会生成吉布斯自由能更低的NO3-AFm(C3A·Ca(NO3)2·10H2O),可避免界稳相水化产物转变,有效抑制CAC强度倒缩;但高温及碳化可能导致物相转变.由此可见,关于CAC的氯离子结合稳定性仍缺乏研究.
鉴于此,本文结合CAC的水化特性,利用pH计、X射线衍射仪(XRD)、扫描电镜(SEM)探究了高温和碳化作用对CAH10、C2AH8、C3AH6和NO3-AFm这4种典型CAC水化产物与氯离子结合稳定性的影响,综合评估了CAC的氯离子结合性能,以期为CAC在氯盐腐蚀环境中的安全高效利用提供理论基础和数据支撑.
1 试验
1.1 原材料
水泥采用益瑞石公司产CAC(商品名Ternal White),其化学组成(文中涉及的组成、水胶比等均为质量分数或质量比)和物理性能分别见表1、2;试验用水均为去离子水;化学试剂为国药集团产四水硝酸钙(Ca(NO3)2·4H2O)和氯化钠(Na Cl),分析纯.

表1 铝酸盐水泥的化学组成Table 1 Chemical composition of CAC w/%

表2 铝酸盐水泥的物理性能Table 2 Physical property of CAC
1.2 试验方法
1.2.1 样品制备
按水胶比2∶1称取4份去离子水和CAC.其中3份去离子水与CAC搅拌均匀后分别置于5、20、60℃下养护30 d,依次得到CAH10、C2AH8和C3AH6样品;另1份去离子水中先溶入20%的Ca(NO3)2·4H2O(以CAC质量为基准),再与CAC充分搅拌后在45℃下密封养护30 d,得到NO3-AFm样品.4种样品均放入真空干燥箱干燥48 h,然后研磨成粒径小于48μm的粉末备用,其物相组成见图1.
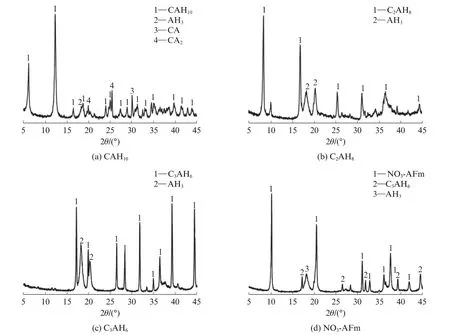
图1 4种样品的XRD图谱Fig.1 XRD patterns of four kinds of sample
高温试验:先取3份上述4种粉末样品各5 g,置于1.0 mol/L Na Cl溶液中浸泡120 d,使粉末样品与氯离子 充 分 结 合 生成Friedel′s盐——Fs(CAH10)、Fs(C2AH8)、Fs(C3AH6)和Fs(NO3-AFm);再将这4种Fs样品分别于(20±1)、(60±1)℃下继续浸泡28 d,洗涤、干燥后备用.
碳化试验:将(20±1)℃下经NaCl溶液浸泡120 d的Fs(CAH10)、Fs(C2AH8)、Fs(C3AH6)和Fs(NO3-AFm)洗涤、干燥后置于碳化试验箱((20±1)℃、相对湿度为(65±5)%及质量分数为3.0%的CO2)内养护至规定龄期.
1.2.2 测试方法
CAC水化产物与氯离子的结合量通过样品浸泡液中的氯离子浓度计算得到,计算表达式[19]为:

式中:Cb为单位质量样品的氯离子结合量,mg/g;V0为样品浸泡液的体积,mL;C0为浸泡液的初始氯离子浓度,mol/L,本文为1.0 mol/L;C1为样品浸泡液的氯离子浓度,mol/L;m为样品的质量,g.
采用雷磁ZDJ-4A型自动电位滴定仪测定样品浸泡液的氯离子浓度C1,每份浸泡液滴定3次,取其平均值作为试验值.采用METTLER TOLEDO数显p H计测量样品浸泡液的p H值,每次测量前,先用p H值为4.00、6.86和9.18的缓冲液进行校准,每个样品重复测试3次,试验值取其算术平均值.采用日本Rigaku D/max 2550 X射线粉末衍射仪(XRD在5°~45°进行连续扫描,扫描速率为2(°)/min.利用美国FEI公司产QUANTA 200FEG-ESEM型场发射环境扫描电子显微镜(SEM)进行微观形貌分析,加速电压为20 k V,采用低真空模式.
2 结果与讨论
2.1 高温对CAC氯离子结合稳定性的影响
2.1.1 浸泡液的氯离子浓度
图2显示了相比20℃浸泡,不同Fs样品在60℃下浸泡于NaCl溶液中28 d后氯离子浓度的增加量.由图2可以看出,60℃下所有样品浸泡液中的氯离子浓度均显著高于20℃时,其中Fs(CAH10)样品尤为明显,增长了5.34%,而Fs(C3AH6)样品增长最少.这表明高温导致CAC水化产物中已结合的氯离子再次释放,成为自由氯离子,使得浸泡液中的氯离子浓度增加,从而对CAC水化产物的氯离子结合稳定性产生负面影响.

图2 不同Fs样品在60℃下浸泡28 d后氯离子浓度较20℃时的增加量Fig.2 Increment of free chloride concentration in soaking solution of chloride-bound samples at 60℃for 28 d comparing to 20℃
2.1.2 浸泡液的pH值
图3为20、60℃下不同Fs样品在Na Cl溶液中浸泡28 d时的pH值.由图3可见:(1)与初始溶液相比,20℃下4种Fs样品浸泡液的p H值均有不同程度增加,增幅 由 大到小依 次为Fs(C3AH6)>Fs(C2AH8)>Fs(CAH10)>Fs(NO3-AFm),其中增幅最小的Fs(NO3-AFm)样品的pH值基本没有变化.(2)当温度升至60℃时,除Fs(CAH10)样品浸泡液的pH值继续略微增加外,Fs(C2AH8)和Fs(C3AH6)样品浸泡液的p H值均略微降低,Fs(NO3-AFm)样品浸泡液的p H值仍无明显变化.上述结果与图2所示不同Fs样品浸泡液中氯离子浓度的变化规律基本一致,浸泡液的pH值增幅随着自由氯离子浓度的提升而增大.这是由于自由氯离子置换出水化铝酸钙内层的OH-,致使孔溶液p H值增加[20-21],但可能由于高温影响氯离子的物理吸附,温度过高时浸泡液的p H值变化幅度仍然较小;高温下Fs(CAH10)样品的pH值略有升高,可能是由于物理脱附出的自由氯离子数量有所增加,进一步促进其置换出OH-;此外,Fs(NO3-AFm)样品浸泡液的p H值始终保持稳定,源自其对氯离子的化学结合是其结构中的NO-3直接置换了氯离子,并未涉及游离OH-的释放[22].
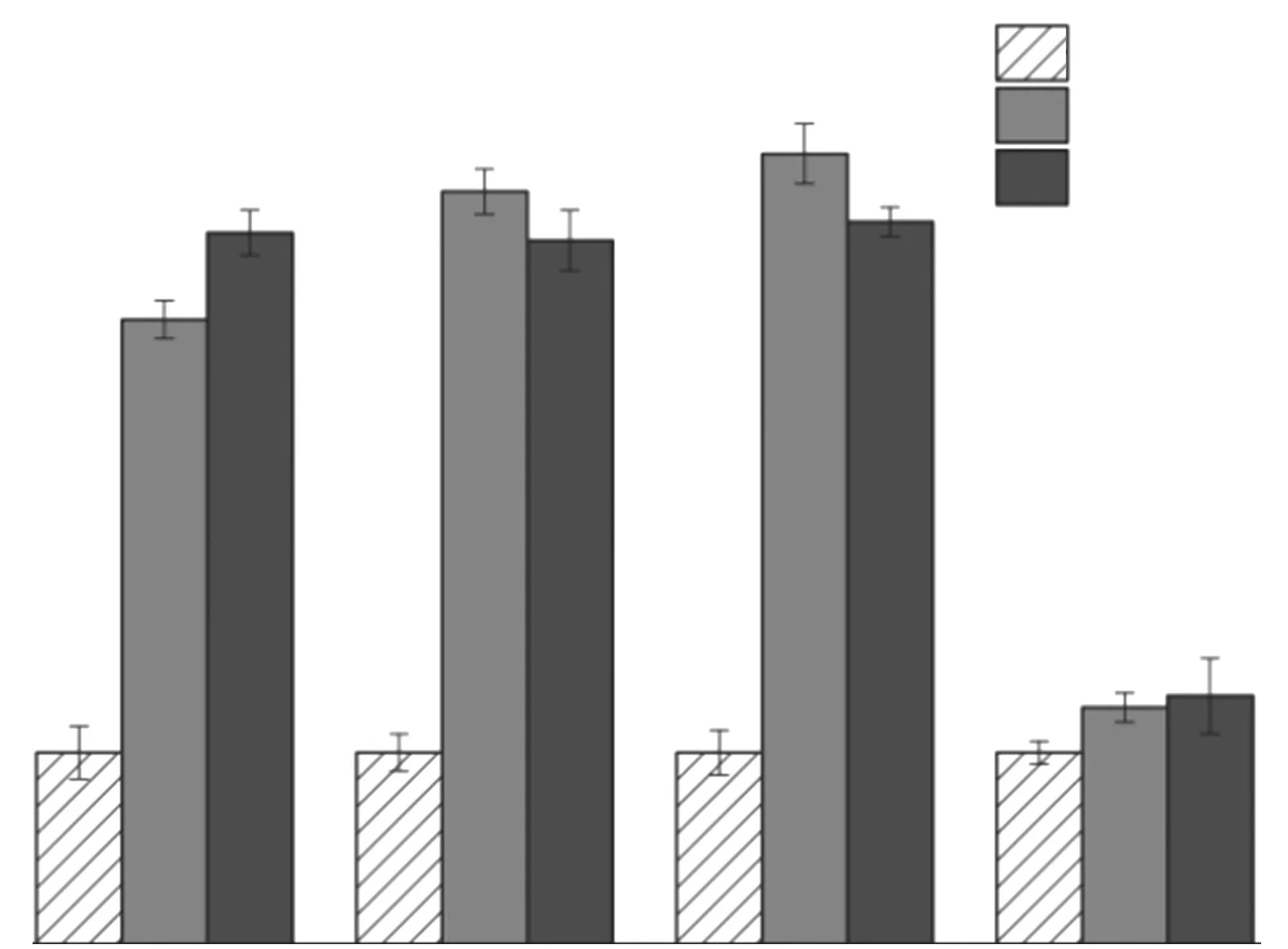
图3 不同Fs样品在20、60℃下浸泡28 d时溶液的p H值Fig.3 pH values of soaking solution of chloride-bound samples immersed at 20,60℃for 28 d
2.1.3 水化产物组成
图4为20、60℃下不同Fs样品在Na Cl溶液中浸泡28 d时的XRD图谱.由图4可知:4种Fs样品在2种温度下的水化产物组成基本没有差异,均以Friedel′s盐为主;与20℃时相比,60℃下Fs样品中Friedel′s盐的衍射峰强度并未减弱,说明高温下浸泡液中氯离子浓度的增加并非源自Friedel′s盐溶解,而是物理结合的氯离子解吸附所致,也进一步证实了Fs样品浸泡液中自由氯离子与p H值变化的结果.
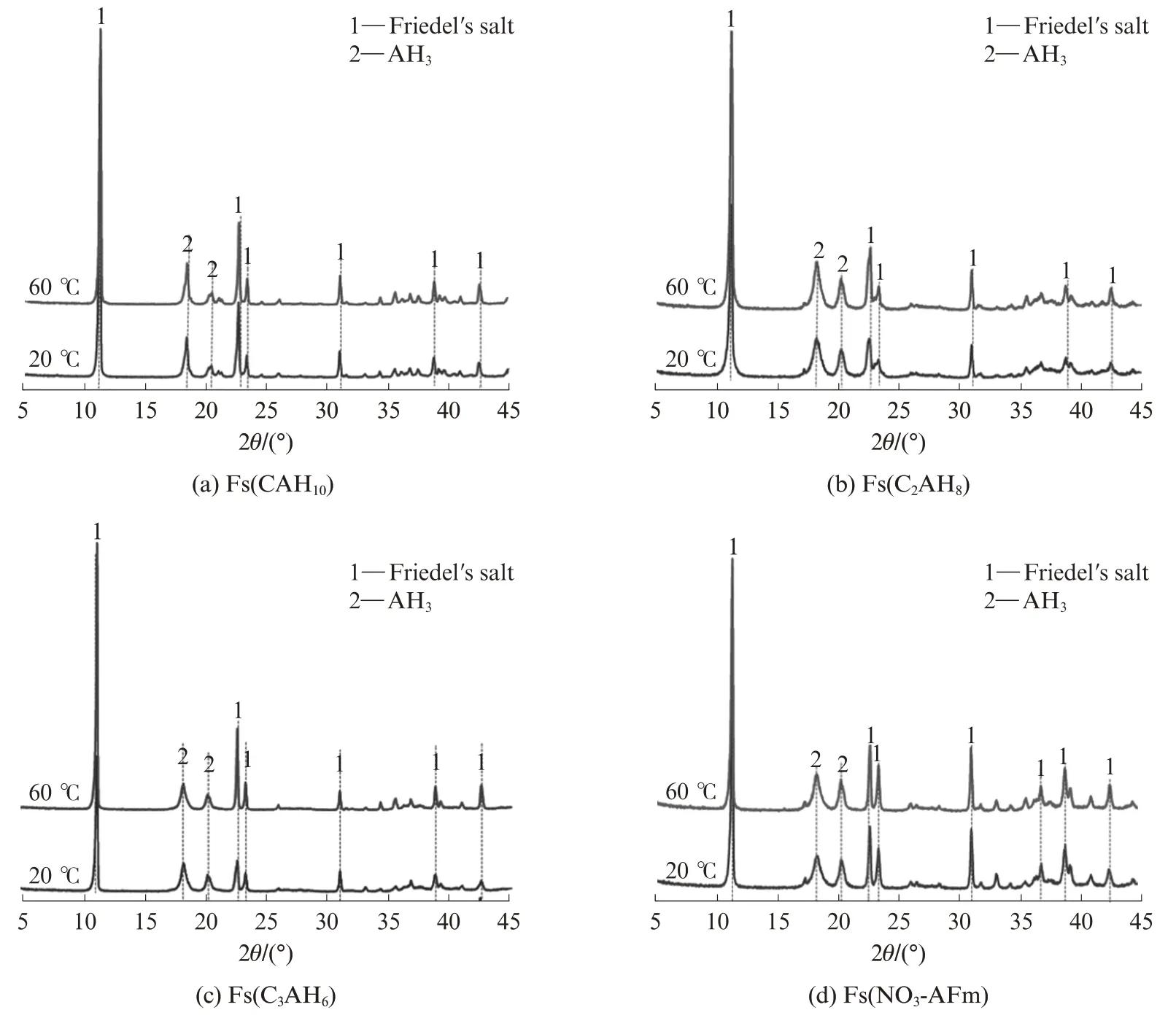
图4 不同Fs样品在20、60℃下Na Cl溶液中浸泡28 d时的XRD图谱Fig.4 XRD patterns of chloride-bound samples soaked in NaCl solutions for 28 d at 20,60℃
2.2 碳化对CAC氯离子结合稳定性的影响
2.2.1 氯离子结合量
图5为碳化1、3、7 d时不同Fs样品中自由氯离子浓度的变化.由图5可见:碳化1 d后,Fs(CAH10)和Fs(C2AH8)样品中的自由氯离子浓度均较低,而Fs(C3AH6)和Fs(NO3-AFm)样品中的自由氯离子浓度较高,最高可达68.50×10-3mol/L;碳化3 d后,Fs(CAH10)、Fs(C2AH8)和Fs(C3AH6)样品中的自由氯离子浓度均大幅增加,而Fs(NO3-AFm)样品仅略有增加;继续碳化至7 d时,Fs(CAH10)和Fs(C2AH8)的自由氯离子含量增加仍较为明显,但增幅较3 d时有所放缓,而Fs(C3AH6)和Fs(NO3-AFm)样品中的自由氯离子浓度较3 d时基本无变化.由此可见,碳化导致CAC水化产物结合氯离子所形成的Friedel′s盐溶解生成Ca CO3和铝胶等物质,造成已结合的氯离子再次被释放出来,进入Fs样品孔溶液中,增加了自由氯离子的浓度[23],且碳化时间越长,结合态氯离子转变为自由氯离子的程度越明显,与文献[21,24]结果相符.
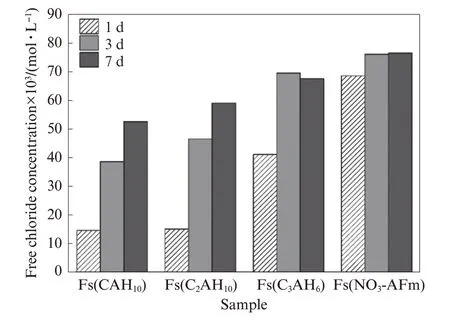
图5 不同Fs样品碳化1、3、7 d时的自由氯离子浓度变化Fig.5 Free chloride concentration of chloride-bound samples carbonized for 1,3,7 d
2.2.2 水化产物组成
图6为不同Fs样品碳化1、3、7 d时的XRD图谱.由图6(a)、(b)可见,碳化1 d时,在Fs(CAH10)和Fs(C2AH8)样品中只检测到极弱的CaCO3(方解石、文石和球霰石)衍射信号,可以认为样品几乎未被碳化,因而自由氯离子浓度较低;碳化3 d时,CaCO3的衍射强度明显增强,尤其是方解石,表明样品已被碳化;碳化7 d后,CaCO3的衍射峰强度继续增强,且Friedel′s盐衍射峰强度减弱,说明部分Friedel′s盐因碳化而被溶解,结合态氯离子被再次释放,因此样品中的自由氯离子浓度大幅增加,与图4结果相符.相比之下,Fs(C3AH6)和Fs(NO3-AFm)样品(图6(c))水化产物组成的变化规律基本一致,碳化1 d时即生成了大量以方解石为主的Ca CO3,可见样品碳化程度较大,这也解释了图5中碳化1 d时Fs(C3AH6)样品和Fs(NO3-AFm)样品中自由氯离子含量较Fs(CAH10)和Fs(C2AH8)样品更高的原因.继续碳化至3 d时,样品中Friedel′s盐完全消失,相应方解石的衍射峰强度继续增强.而碳化7 d时样品中的水化产物组成与3 d时基本相同,可见样品早在3 d时就已被完全碳化,这也与图5中Fs(CAH10)和Fs(C2AH8)样品碳化3、7 d时的自由氯离子浓度几乎没有变化的结果相符.
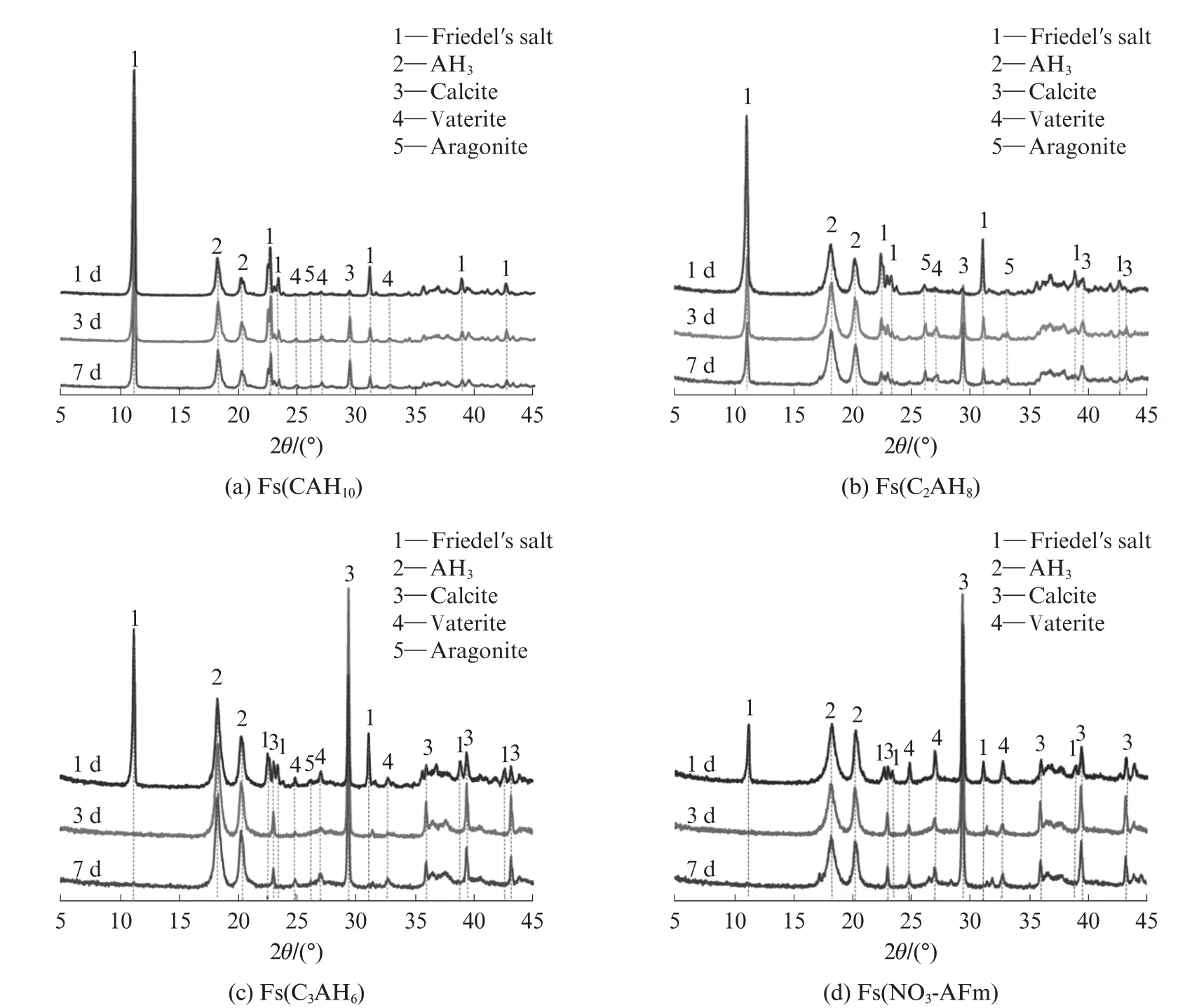
图6 不同Fs样品碳化1、3、7 d时的XRD图谱Fig.6 XRD patterns of chloride-bound samples carbonized for 1,3,7 d
碳化对CAC水化产物的氯离子结合稳定性尤其是化学结合具有负面影响,主要有两方面原因[24]:一是使样品孔溶液的p H值降低,引发Friedel′s盐溶解(3CaO·Al2O3·CaCl2·10H2O+3CO2→3Ca CO3+2Al(OH)3+Ca Cl2+10H2O),使得被结合的氯离子再次释放,导致孔溶液中的自由氯离子浓度升高;二是C-S-H和C-A-H等水化产物碳化后多形成CaCO3和AH3等水化产物,降低了氯离子结合位点,进而导致水泥基材料的氯离子结合能力大幅降低.结合图5、6可以看出,Fs(CAH10)和Fs(C2AH8)样品具有较好的抗碳化性能,而Fs(C3AH6)和Fs(NO3-AFm)样品的抗碳化性能较差.
2.2.3 微观形貌
图7为各Fs样品碳化7 d时的SEM照片.由图7可 见:(1)碳化后Fs(CAH10)中呈六方板状的Friedel′s盐表面光滑,结构仍较为完整,而在2块板状Friedel′s盐之间可见边长为2~3μm的方块状方解石.(2)碳化后Fs(C2AH8)中六方板状Friedel′s盐的轮廓较为模糊,表面因碳化而附着大量方解石和部分球霰石.(3)碳化后Fs(C3AH6)样品中除了絮凝状AH3外,其产物基本只有方块状的方解石,Friedel′s盐不复存在,可见其碳化严重.(4)碳化后Fs(NO3-AFm)的产物形貌与Fs(C3AH6)基本相同,也是大量方块状的方解石被AH3包裹,未发现板状的Friedel′s盐,这与图6中XRD结果一致.由此可见:碳化首先导致Friedel′s盐的表面溶解,然后在其表面形成大量方解石;随着碳化程度的加重,Friedel′s盐被逐渐溶解,结合的氯离子则被释放出来,导致孔溶液中自由氯离子浓度升高.

图7 不同Fs样品碳化7 d时的SEM照片Fig.7 SEM images of chloride-bound samples carbonized for 7 d
3 结论
(1)高温对CAC浆体的氯离子结合稳定性产生不利影响,导致已结合的氯离子释放,溶液中的自由氯离子浓度增加;但温度升高仅影响物理吸附氯离子的结合稳定性,对化学结合稳定性则基本无影响.高温对以氯离子化学结合为主的Fs(NO3-AFm)样品无明显影响,但会导致Fs(CAH10)、Fs(C2AH8)和Fs(C3AH6)样品中物理吸附的氯离子大幅解吸附.
(2)碳化对CAC浆体的氯离子结合稳定性产生不利影响,导致Friedel′s盐溶解,并生成以方解石为主的Ca CO3,进而增加浆体中自由氯离子的浓度;且碳化越严重,相应的自由氯离子浓度越高.Fs(CAH10)与Fs(C2AH8)的 抗 碳 化 能 力 较 好,而Fs(C3AH6)与Fs(NO3-AFm)的抗碳化能力较差.
