基于高通量测序的雪茄烟叶细菌多样性与功能预测
2022-09-02闫铁军郑霖霖李秀妮刘利平潘勇王剑龙飞周平时向东
闫铁军,郑霖霖,李秀妮,刘利平,潘勇,王剑,龙飞,周平,时向东*
基于高通量测序的雪茄烟叶细菌多样性与功能预测
闫铁军1,郑霖霖2,李秀妮3,刘利平1,潘勇1,王剑1,龙飞1,周平1,时向东2*
1湖北中烟工业有限责任公司,湖北 武汉 430048;2河南农业大学烟草行业烟草栽培重点实验室,河南 郑州 450000;3四川农业大学,四川 成都 610000
【背景和目的】环境条件与烟叶理化性质的改变直接影响烟叶的细菌群落结构和功能。为探究海南不同产区茄衣、茄套和茄芯细菌群落组成,研究雪茄烟叶细菌群落结构及代谢功能。【方法】以海南光村、昌江、白沙和五指山4个产区茄衣、茄套和茄芯为试验材料,基于16S rRNA测序技术分析细菌群落结构,PICRUSt预测分析细菌群落的代谢功能。【结果】12个样本中共聚类2317个OTU,属于10个科。五指山产区茄套的细菌群落丰富度及多样性最高,其Chao1指数、ACE指数和Shannon指数分别为344.00、344.00和6.54。光村和五指山产区细菌群落丰富度及多样性均表现为茄衣<茄套、茄芯。昌江产区则表现为茄衣>茄芯、茄套。茄衣的主要优势菌科为葡萄球菌科,相对丰度明显高于茄套、茄芯,不同产区之间无明显差异。茄套和茄芯的主要优势菌科为肠杆菌科,明显高于茄衣,且昌江、五指山>光村、白沙。KEGG代谢通路分析结果表明,不同产区茄衣、茄套和茄芯细菌预测功能种类差异较小,丰度差异较大。【结论】在科分类水平上,不同产区不同用途雪茄烟叶细菌群落多样性丰富,细菌群落结构组成相似,相对丰度有所差异,葡萄球菌科、肠杆菌科是造成烟叶细菌群落结构差异的关键菌科。细菌群落代谢途径丰富,主要富集在碳水化合物代谢、氨基酸代谢和能量代谢通路中,除此之外,也较多的富集在辅助因子以及维生素代谢等通路。
雪茄烟叶;高通量测序;细菌群落组成;功能预测
传统雪茄主要由茄衣、茄套和茄芯3部分烟叶组成,其中茄衣是判断雪茄外观品质和风味特征的主要依据[1];茄套具有固定茄芯、协调茄衣与茄芯品质的作用;茄芯作为雪茄的主体部分,决定吸食的主流风味特征[2]。海南烟区与古巴烟区相比,有相近的纬度、类似的气候条件和肥沃深厚的红色砂壤土,是国内最适宜种植生产雪茄烟原料的地区之一[3]。
烟叶表面微生物数量繁多,每克烟叶约含有5~8万个微生物[4],大致可分为细菌、霉菌、放线菌和酵母菌4大类,其中细菌数量要远高于霉菌、放线菌和酵母菌[5]。Reid等[6]研究发现雪茄烟叶表面存在大量以巨大芽孢杆菌()为主的细菌和以青霉、曲霉为主的霉菌。细菌可以将烟叶中的有机成分如淀粉、蛋白质等大分子物质,通过某些代谢途径转化为小分子物质[7-10]。张鸽等[11]研究结果表明,国内外不同地区茄衣表面细菌群落结构存在差异,以芽孢杆菌属()为优势细菌,其次是葡萄球菌属()。张晓娟等[12]研究发现,对人工发酵的茄衣烟叶叶面进行分离,可以得到蜡状芽孢杆菌、巨大芽孢杆菌等8种菌株,其中巨大芽孢杆菌为烟叶表面优势菌群。16S rRNA高通量测序作为微生物多样性研究的新型技术手段,如今已经广泛应用于烟叶生产技术研究中,张磊等[13]基于Illumina Hiseq对雪茄烟叶不同发酵阶段细菌的16S rRNA V3和V4可变区和真菌ITS1区域进行扩增测序,发现不同发酵阶段烟叶微生物菌群呈动态变化。周家喜等[14]利用高通量测序平台对陈化过程中烟叶表面细菌的16S rRNA V4区进行研究,分析烟叶陈化过程中细菌群落演替规律以及与烟叶化学成分间的作用关系。
研究表明,雪茄烟叶细菌种类组成与雪茄烟叶用途、发酵工艺、生产环境等因素有关,不同地区生产的雪茄烟叶细菌群落组成可能存在较大差异[15]。目前研究主要集中在烟叶发酵、陈化过程中细菌群落结构变化等方面,而对不同产区茄衣、茄套和茄芯烟叶细菌群落区系及功能差异的研究较少。本研究以海南昌江、白沙、光村、五指山4个产区茄衣、茄套和茄芯烟叶为试验材料,利用16S rRNA高通量测序技术比较分析自然状态下烟叶的细菌多样性及群落结构特征,并对菌群功能进行预测。为探究海南不同产区茄衣、茄套和茄芯烟叶的细菌群落结构组成差异及功能,提升雪茄烟叶品质,筛选优势功能细菌提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为海南建恒哈瓦那雪茄有限公司和五指山勇毅雪茄庄园有限公司提供的海南光村、昌江、白沙和五指山4个产区2018年产中部叶一级茄衣、茄套和茄芯,统一于海南光村雪茄烟生产基地进行初次发酵,茄衣采用装箱发酵,茄套、茄芯采用堆积发酵。发酵完成后统一在烟叶醇化仓库(常年平均温度18℃,湿度63%)醇化3年后取样,每个产区每类烟叶取样1份,每个烟叶样品采集1 kg,总共12份烟叶样品。
1.2 试验方法
1.2.1 叶际微生物DNA提取
使用无菌剪刀分别取100 g雪茄烟叶放入锥形瓶中,加入PBS缓冲液并使缓冲液完全浸泡烟叶,置于摇床中37℃,200 r/min,振荡1 h。振荡完成后,将含有微生物的PBS缓冲液置于离心机中,8000 r/min离心5 min,收集沉淀。样品基因组DNA的提取采用E.Z.N.A.®soil试剂盒(美国OMEGA公司,货号:D5625-01),每个样品重复4次。
1.2.2 PCR扩增及高通量测序
对12个样本的16S rRNA的V4-V5区进行PCR扩增,扩增引物为515F(5’-GTGCCAGCMGCCGCGG- TAA-3’)和907R(5’-CCGTCAATTCMTTTRAGTTT- 3’)。PCR的反应参数:98℃预变性5 min,98℃变性30 s,52℃退火30 s,72℃延伸1 min,25个循环,最终72℃延伸5 min。
扩增完成后使用Axygen凝胶回收试剂盒进行扩增片段回收,回收的DNA片段使用Tru Seq Nano DNA LT Library Prep Kit试剂盒进行文库构建,并使用Illumina MiSeq测序仪进行基因测序(上海派森诺生物科技有限公司)。
1.3 数据处理与统计分析
将有效数据在97%水平上聚类成操作分类单元(Operational Taxonomic Unit,OTU),基于OTUs聚类结果,通过Alpha多样性指数、在科分类水平上细菌群落相对丰度以及细菌功能预测等分析对样品中物种进行注释与评估。
所用数据采用Origin2021和Excel2013进行处理分析。PICRUS(http://huttenhower.sph.harvard.edu/ galaxy/tool_runner?tool_id=PICRUSt_normalizn)对细菌功能进行预测分析。
2 结果与分析
2.1 不同产区、用途雪茄烟叶细菌群落测序数据分析
不同产区不同用途烟叶中细菌的有效序列及OTU数见表1。由表1可知,不同产区不同用途烟叶中细菌共获得1096008条reads,平均每个样品含有91334条序列。去除宿主DNA,按照97%的相似性进行OTU聚类后,共得到2317个OTU,各样品OTU数在41~342之间,样本间OTU数存在差异。对不同产区烟叶进行比较,OTU数呈现为五指山>昌江>白沙>光村,其中,昌江、白沙产区不同用途烟叶间OTU数之间无明显差异,光村、五指山产区烟叶OTU数呈现出一致的规律,表现为茄套>茄芯>茄衣,且三者之间存在明显差异,表明不同用途烟叶对光村、白沙产区OTU数有一定的影响。
表1 不同雪茄烟叶样品中细菌的有效序列及OTUs数目
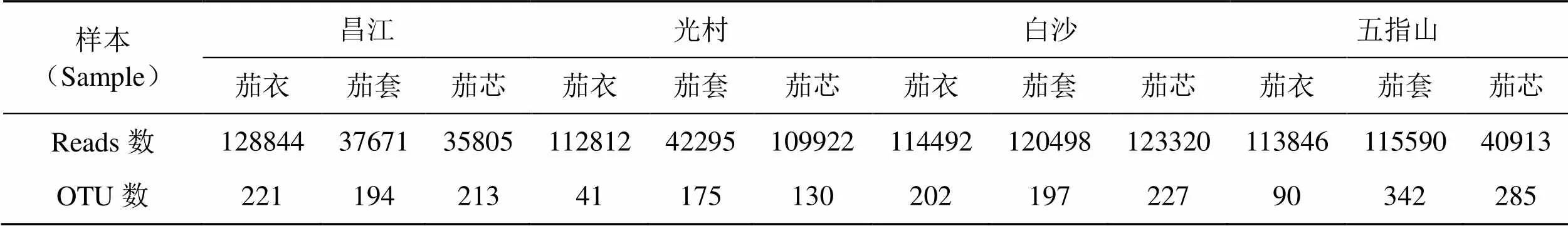
Tab.1 Effective sequences and OTUs numbers of bacteria in different cigar tobacco leaves
2.2 不同产区、用途雪茄烟叶样品细菌群落Alpha多样性分析
Chao1指数和ACE指数用于衡量样品中细菌群落的丰富度,Shannon指数用于衡量细菌群落的多样性。不同产区不同用途雪茄烟叶中细菌Alpha多样性分析结果如图1所示。
由图1可知,同一产区不同用途烟叶中Chao1、ACE和Shannon指数值有所差异(白沙产区除外),五指山、光村产区茄套、茄芯烟叶Chao1、ACE和Shannon指数值均显著高于茄衣烟叶。昌江产区则与之相反,各项指数值以茄衣烟叶最高,其中Chao1和ACE指数值显著高于茄套、茄芯烟叶。同一用途不同产区烟叶中的Chao1、ACE和Shannon指数值有所差异。由图1(a、b)可知,茄衣烟叶中,昌江产区的Chao1、ACE数值显著高于其他产区,分别为252.61、273.15,图c中可知Shannon指数以白沙产区最高,与其他产区有显著差异,为4.79。茄套烟叶中,各项指数均以五指山产区最高,且高于其余十一个样本,分别为344.00、344.00和6.54,与其他3个产区差异显著,表明五指山茄套烟叶具有较高的细菌群落丰富度和多样性。茄芯烟叶中Chao1和ACE指数值与茄套烟叶趋势一致,均以五指山产区最高,光村产区最低,且差异显著,Shannon数值则表现为白沙产区最高,昌江产区最低,分别为5.27、3.64,存在显著差异。表明五指山茄芯烟叶细菌群落丰富度较高而多样性较低,光村产区则与之相反,细菌丰富度较低,多样性较高。

注:图中a,b,c分别代表Chao1指数、ACE指数和Shannon指数。大写字母表示同一产区不同用途之间的显著性差异,小写字母表示同一用途不同产区烟叶之间的显著性差异(P<0.05);箱线图上下横线分别表示95%和5%置信区间,其中箱体中横线代表中位数。
2.3 不同产区、用途雪茄烟叶样品细菌群落科水平差异物种分析
不同产区及用途雪茄烟叶样品细菌群落在科水平上分析结果如图2所示,在科分类水平上,烟叶中细菌主要包括葡萄球菌科(Staphylococcaceae)、假单胞菌科(Pseudomonadaceae)、肠杆菌科(Enterobacteria- ceae)、伯克氏菌科(Burkholderiaceae)和甲基杆菌科(Methylobacteriaceae)等。其中肠杆菌科和伯克氏菌科为所有样品共有菌科,平均相对丰度分别为43.5%,1.2%。从样品产区来源看,不同产区烟叶样品在科水平上的细菌群落结构组成均以葡萄球菌科和肠杆菌科为主要优势菌科,相对丰度无明显差异。
从烟叶用途来看,不同用途烟叶中的主要优势菌科不一致。茄衣烟叶中的主要优势菌科为葡萄球菌科,相对丰度在90.0%以上,明显高于茄套、茄芯,但产区之间无明显差异。光村产区茄衣烟叶中肠杆菌科的相对丰度为2.5%,是其他产区茄衣烟叶的2倍以上。除此之外,茄衣烟叶中含有鞘脂单胞菌科(Sphingomo- nadaceae)、橙单胞菌科(Aurantimonadacea)和布鲁氏菌科(Brucellaceae),且仅存在于白沙和五指山产区中,在两个产区之间的相对丰度无明显差异。
肠杆菌科和假单胞菌科在茄套烟叶细菌科中占主导地位。其中,肠杆菌科的相对丰度在42.7%~50.5%之间,无明显差异;假单胞菌科在不同用途烟叶之间的相对丰度表现为茄套>茄衣、茄芯,在产区之间表现为光村最高,白沙最低,分别为44.1%,25.0%。此外,在科分类水平上,茄套烟叶的细菌群落结构在不同产区之间有明显差异,如甲基杆菌科、莫拉氏菌科(Moraxellaceae)、丛毛单菌科(Comaminadaceae)分别仅存在于白沙、昌江、五指山产区中,相对丰度分别为22.8%,3.3%、2.3%,且明显高于其他样本。
茄芯烟叶中相对丰度最高的为肠杆菌科,且明显高于茄衣、茄套烟叶,分别为96.8%(昌江)、84.4%(五指山)、77.0%(光村)和73.1%(白沙)。假单胞菌科为茄芯烟叶的第二主要菌科,主要分布在光村、白沙产区,相对丰度分别为20.0%、19.5%。
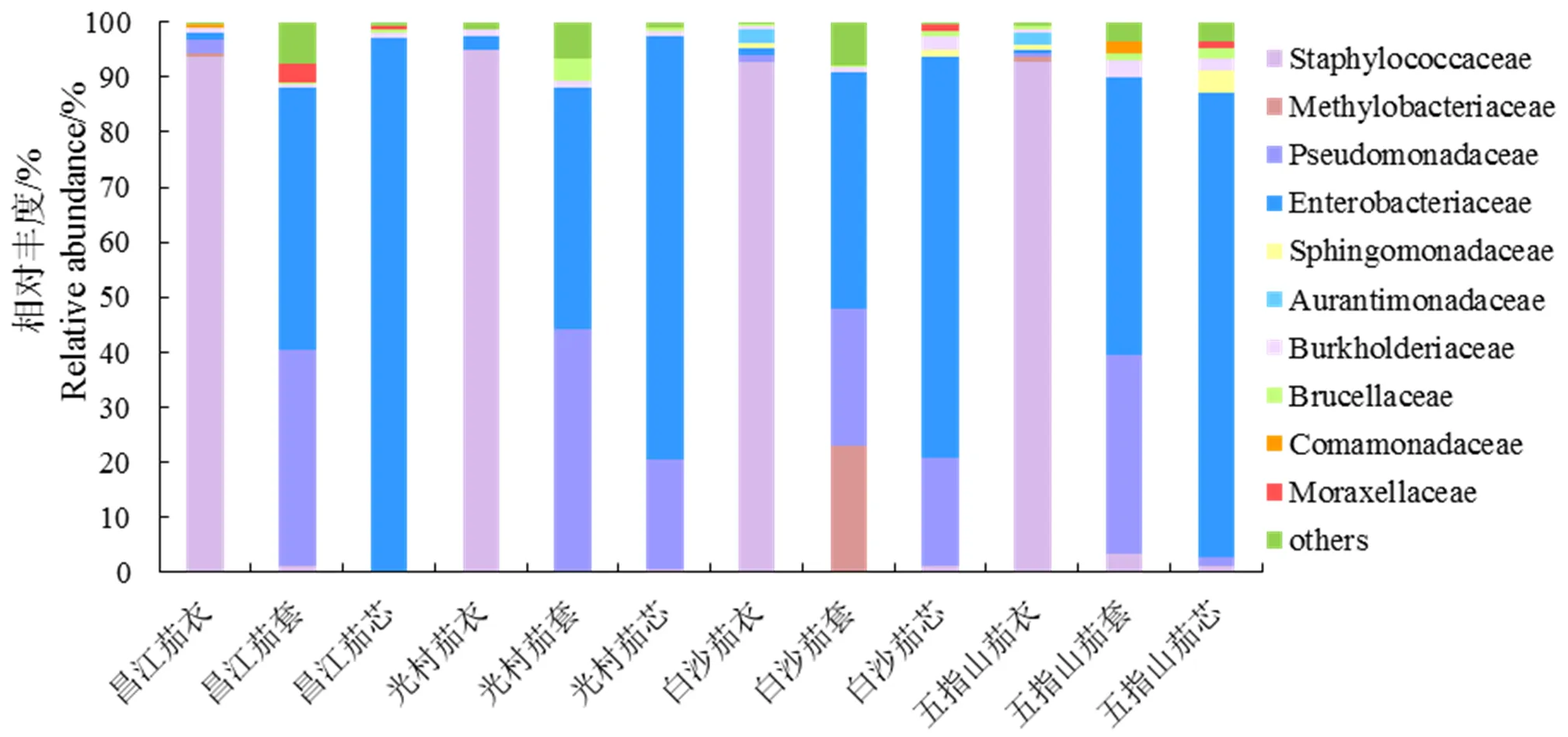
图2 基于科水平的不同雪茄烟叶细菌群落结构
2.4 不同产区、用途雪茄烟叶样品细菌群落功能预测
KEGG是分析生物代谢通路的数据库,主要是将基因、基因组信息以及更高层次的功能信息结合起来,对基因的功能进行系统化分析[16]。KEGG代谢通路分析结果表明,二级通路丰度分析共有41种代谢通路,图3展示12个样品代谢通路丰度值前12的结果。主要代谢通路有异生物素的生物降解和代谢(Xenobiotics biodegration and metabolism)、核酸代谢(Nucleotide metabolism)、辅助因子和维生素的代谢(Metabolism of cofactors and vitamins)、脂质代谢(Lipid metabolism)、糖的生物合成与代谢(Glycan biosynthesis and metabolisim)等通路。由图3可知,不同产区茄衣、茄套和茄芯烟叶样本主要富集在碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、能量代谢(Energy metabolism)这3个通路上,同时富集到维生素和辅助因子代谢通路也较多。碳水化合物代谢和氨基酸代谢通路主要富集昌江、光村和五指山产区茄衣烟叶,在茄套和茄芯烟叶中功能丰度较低。能量代谢通路主要富集在昌江和白沙产区茄芯烟叶。光村与五指山产区则以茄套烟叶中能量代谢功能丰度更高。

3 讨论
本研究对海南昌江、光村、白沙和五指山4个雪茄烟叶产区的茄衣、茄套和茄芯烟叶表面细菌进行16S rRNA高通量测序,通过Alpha多样性分析、PICRUSt功能预测等揭示了海南不同产区不同用途烟叶表面菌群结构及功能的变化。
菌群结构分析表明,在科分类水平上,不同产区烟叶的主要优势菌科一致,均为肠杆菌科和葡萄球菌科,相对丰度无明显差异。同一产区不同用途烟叶中优势菌科不同,茄衣烟叶以葡萄球菌科为主,这与张鸽等[11]对不同国家雪茄外包皮烟叶表面细菌差异的研究结果一致,且光村茄衣的相对丰度最高。茄套和茄芯烟叶的主要优势菌科为肠杆菌科和假单胞菌科,这与伍雪莹等[17]对不同陈化期烟叶表面细菌种类的研究结果基本相同。本研究发现,肠杆菌科和假单胞菌科的相对丰度在产区之间无明显差异,而肠杆菌科在茄芯中显著高于茄套和茄衣,假单胞菌科在茄套中的相对丰度最高,甲基杆菌科大量存在于白沙茄套烟叶中,这说明烟叶中的细菌在不同来源、不同用途烟叶上有所差异,与包可翔[18]、苏加坤[19]等对不同地区及不同部位的烟叶表面细菌群落结构研究结果一致。分析差异存在的原因可能有两方面,一方面是烟叶的发酵方式以及自身素质不同所致[20-21]。研究发现,茄衣主要采用装箱发酵,茄芯为堆垛发酵[2],且茄衣中积累的有机物质、含氮化合物等较茄芯较少,使得烟叶中细菌生长所需要的温湿度以及营养物质有所差异[22-23]。另一方面可能是当地生态环境不同,环境中的细菌区系不同,烟叶可能选择性地富集一些土壤细菌,进而造成烟叶中的细菌群落结构有所差异。研究发现,肠杆菌可以作为生物农药、固氮微生物等,对有害生物防害、植物生长、植物代谢等有着积极作用[24-25]。葡萄球菌可以参与脂肪代谢,产生大量的脂肪酸,产生的脂肪酸可以进一步降解形成醛类、甲基酮等芳香类物质,是烟叶香气物质的重要来源[26]。假单胞菌可以降解烟碱,影响雪茄烟叶吸食劲头[27]。甲基杆菌可以利用单碳化合物产生各种氨基酸以及酶类[28]。
利用PICRUSt对不同产区及用途烟叶表面细菌进行功能预测,基于KEGG第2层级的功能基因分析,显示不同产区及用途烟叶细菌功能以碳水化合物代谢、氨基酸代谢和能量代谢三种功能丰度最高,表明烟叶表面的细菌群落积极参与了基本的代谢过程。这与张鸽[27]等研究结果类似,在发酵过程中,雪茄烟叶中细菌功能以氨基酸代谢和碳水化合物代谢两种功能丰度最高。一方面,碳水化合物代谢途径的中间产物可以为许多物质的合成提供原料,如芳香族氨基酸的合成等[29-30]。另一方面,氨基酸可以与还原糖发生美拉德反应,是烟草中一类重要的致香反应,与烟叶感官品质密切相关[31]。本研究发现,能量代谢在茄芯和茄套烟叶中相对丰度较高,茄芯、茄套烟叶中的细菌群落能够为下一步烟叶发酵提供能量。同一产区茄衣、茄套和茄芯烟叶品质有所差异,可能是因为不同用途烟叶中的细菌组成与丰度有所差异,形成的功能基因有所差异,进而影响着烟叶碳水化合物以及氨基酸等物质的代谢途径。由于PICRUSt功能预测存在局限性,因此后续需要结合宏基因组测序等技术进一步分析。
本文对不同产区及用途烟叶的细菌群落结构进行了详细的描述,并且预测了烟叶细菌群落代谢功能的变化,为下一步探究烟叶细菌群落结构差异与烟叶理化性质之间的关系,筛选功能菌株用于雪茄烟叶发酵过程中以提高雪茄烟叶品质提供理论依据。本文对细菌的分类仅限于科的水平,在烟叶中同一科的不同细菌属可能会行使不同的功能,而不同科的细菌也可能会行使同样的功能[32],因此研究结果存在偏差,今后仍需要进行深入研究。
4 结论
本研究采用高通量测序技术对海南不同产区及用途烟叶中细菌群落进行分析,通过分析比较不同产区、不同用途烟叶的优势菌科、相对丰度以及功能基因代谢途径,为提升烟叶品质及后续发酵提供相关细菌信息。结果显示,不同产区的主要优势菌科为葡萄球菌科和肠杆菌科,相对丰度没有明显差异。葡萄球菌科、肠杆菌科和假单胞菌科是造成不同用途烟叶细菌群落结构差异的关键菌科。在功能预测分析中,同一产区不同用途烟叶表面细菌主要功能预测为碳水化合物的代谢、氨基酸代谢、能量代谢,除此之外,也较多的富集在维生素代谢等通路。该结论为筛选功能菌,改善烟叶品质提供理论依据。
[1] 王洁. 海南茄衣采收成熟度及调制发酵技术研究[D]. 郑州:河南农业大学,2015.
WANG Jie. Study on harvest maturity and modulation and fermentation technology of Hainan eggplant[D]. ZhengZhou: Henan Agricultural University, 2015.
[2] 陈栋,李猛,王荣浩,等. 国产雪茄茄芯烟叶研究进展[J]. 扬州大学学报(农业与生命科学版),2019, 40(01): 83-90.
CHEN Dong, LI Meng, WANG Ronghao, et al. Progress of the domestic cigar filler tobacco[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2019, 40(01): 83-90.
[3] 邓弋戈,时向东. 雪茄茄衣品种生态适应性及栽培技术研究进展[J]. 江西农业学报,2021, 33(01): 60-66.
DENG Yige, SHI Xiangdong. Research progress in ecological adaptability and cultivation techniques when of cigar wrappers[J]. Acta Agriculturae Jiangxi, 2021, 33 (01): 60-66.
[4] 韩锦峰,朱大恒,刘卫群,等. 陈化发酵期间烤烟叶面微生物活性及其应用研究[J]. 中国烟草科学,1997(4): 15-16.
HAN Jinfeng, ZHU Daheng, LIU Weiqun, et al. Study on microbial activity and application of roasted tobacco leaves during aging fermentation[J]. China Tobacco Science, 1997 (4): 15-16.
[5] 舒明,樊虎,杨洋,等. 废烟叶提取液源尼古丁降解菌分离鉴定和特性[J]. 微生物学通报,2017, 44(05): 1028-1037.
SHU Ming, FAN Hu, YANG Yang, et al. Isolation, identification and characteristics of nicotine degrading strain from tobacco waste extract[J]. Microbiology China, 2017, 44 (05): 1028-1037.
[6] Reid J J, Mckinstry D W, Haley E E. Studies on the ferment of tobacco Ⅰ. the microflora of cured and fermenting cigar-leaf tobacco[J]. Pennsylvania Agricultural Experiment Station Bulletin, 1937, 356: 1–17.
[7] 唐丽,周冰,华一崑,等. 醇化技术在改善烟叶品质中的研究进展[J]. 江西农业学报,2013, 25(7): 53-56.
TANG Li, ZHOU Bing, HUA Yikun, et al. Research advances in alcoholization technology for improving quality of tobacco leaf[J]. Acta Agriculturae Jiangxi, 2013, 25 (7): 53-56.
[8] 赵铭钦,李晓强. 烟叶微生物发酵机理及生物制剂应用研究进展[J]. 甘肃农业大学学报,2007, 42(6): 84-91.
ZHAO Mingqin, LI Xiaoqiang. Review of the action mechanism of microbe in tobacco fermentation and application of biologic preparation[J]. Journal of Gansu Agricultural University, 2007, 42 (6): 84-91.
[9] 金晓艳. 复合生物添加剂对烟草陈化过程中有机酸和游离氨基酸含量影响分析研究[D]. 合肥: 中国科学技术大学,2006.
JIN Xiaoyan. Analysis of the effects of composite biological additives on organic acids and free amino acid content in tobacco aging process[D]. HeFei: University of Science and Technology of China, 2006.
[10] 赵铭钦,李芳芳. 微生物和酶学技术在烟草发酵中的应用及展望[J]. 中国农学通报,2007(1): 314-318.
ZHAO Mingqin, LI Fangfang. The application and prospect of the technology of microbe and enzyme during tobacco leaf fermentation[J]. Chinese Agricultural Science Bulletin, 2007(1): 314-318.
[11] 张鸽,梁开朝,辛玉华,等. 四个国家雪茄外包皮烟叶表面细菌分离与活性测定[J]. 中国烟草科学,2018, 39(2):82-88.
ZHANG Ge, LIANG Kaichao, XIN Yuhua, et al. Isolation and activity determination of surface bacteria in cigar wrapper leaves from four different countries[J]. Chinese Tobacco Science, 2018, 39 (2): 82-88.
[12] 张晓娟. 雪茄外包皮烟人工发酵工艺及叶表微生物区系研究[D].郑州: 河南农业大学, 2006.
ZHANG Xiaojuan. Studies on artificial fermentation and microflora on leaf surface of cigar-wrapper tobacco[D]. ZhengZhou: Henan Agricultural University, 2006.
[13] 张磊,罗泽华,杨明川,等. 雪茄烟叶原料发酵微生物多样性及酶活变化研究[J]. 中国农业科技导报, 2021, 23(10): 171-180.
ZHANG Lei, LUO Zehua, YANG Mingchuan, et al. Diversity of fermentation microbes and changes of hydrolytic enzyme activities of cigar leaf raw materials[J]. Journal of Agricultural Science and Technology, 2021, 23(10): 171-180.
[14] 周家喜,喻理飞,张健,等. 烟叶陈化过程细菌群落演替特征[J]. 生态学报,2018, 38(21): 7739-7748.
ZHOU Jiaxi, YU Lifei, ZHANG Jian, et al. Study on the characteristics of bacterial community succession in tobacco aging[J]. Acta Ecologica Sinica, 2018, 38(21): 7739-7748.
[15] 叶长文,李璐,贺琛,等. 基于高通量测序的雪茄烟微生物群落结构和多样性分析[J]. 烟草科技, 2021, 54(08): 1-9.
YE Changwen, LI Lu, HE Chen, et al. Structure and diversity analysis of microbial communities in cigar products by high-throughput sequencing technology[J]. Tobacco Science & Technology, 2021, 54 (08): 1-9.
[16] 李向真,刘子朋,李娟,等. KEGG数据库的进展及其在生物信息学中的应用[J]. 药物生物技术, 2012, 19(06): 535-539.
LI Xiangzhen, LIU Zipeng, LI Juan, et al. Recent progress and application of KEGG database in the research of bioinformatics[J]. Pharmaceutical Biotechnology, 2012, 19 (06): 535-539.
[17] 伍雪莹,梁书利,韩双艳,等. 不同陈化期烤烟叶表细菌的多样性及发育分析[J]. 广东农业科学, 2014, 41(18): 28-33+38.
WU Xueying, LIANG Shuli, HAN Shuangyan, et al. Diversity and phylogenetic analysis of bacterial communities on flue-cured tobacco leaves at different aged phase[J]. Guangdong Agricultural Sciences, 2014, 41 (18): 28-33+38.
[18] 包可翔,林俭,何伟,等. 不同产地和部位对片烟自然醇化过程中细菌群落结构的影响[J]. 烟草科技, 2017, 50(04): 10-17.
BAO Kexiang, LIN Jian, HE Wei, et al. Effects of growing area and stalk position on bacterial community structure in tobacco strips during aging[J]. Tobacco Science & Technology, 2017, 50 (04): 10-17.
[19] 苏加坤,徐达,郭磊,等. 基于宏基因组测序的烟叶表面微生物多样性分析[J]. 基因组学与应用生物学, 2017, 36(04): 1538- 1545.
SU Jiakun, XU Da, GUO Lei, et al. Diversity analysis of microorganism on flue-cured tobacco leaf surface based on metagenome sequencing[J]. Genomics and Applied Biology, 2017, 36 (04): 1538-1545.
[20] 周家喜. 不同仓储环境微生物群落对烟叶陈化品质的影响[D]. 贵阳:贵州大学,2017.
ZHOU Jiaxi. Effects of microbial communities on quality of tobacco leaves in different storage environments[D]. GuiYang: Guizhou University, 2017.
[21] 浦绍占. 不同仓储条件对醇化烟叶品质的影响[D]. 昆明:昆明理工大学,2017.
PU Shaozhan. The effect of different warehouse conditions on quality of aged tobacco[D]. Kun Ming: Kunming University of Science and Technology, 2017.
[22] 万德建,吴创,杜佳,等. 雪茄烟叶发酵方法研究进展[J]. 山西农业科学,2017, 45(07): 1211-1214.
WAN Dejian, WU Chuang, DU Jia, et al. Research advances in fermentation methods of cigar tobacco leaves[J]. Journal of Shanxi Agricultural Sciences, 2017, 45 (07): 1211-1214.
[23] 李军华,唐杰,梁坤,等. 印尼与国内雪茄烟叶主要化学成分差异分析[J]. 浙江农业科学, 2015, 56(07): 1080-1083.
LI Junhua, TANG Jie, LIANG Kun, et al. Analysis of the differences between the main chemical composition of cigar tobacco leaves in Indonesia and China[J]. Journal of Zhejiang Agricultural Sciences, 2015, 56 (07): 1080-1083.
[24] Lin L, Shah S, Rashid A, et al. Phytoremediation of arsenate contaminated soil by transgenic canola and the plant growth-promoting bacteriumcloacae CAL2[J]. Plant Physiology & Biochemistry, 2002, 40 (4): 355-361.
[25] Jha C K, Aeron A, Patel B V, et al.: Role in Plant Growth Promotion [M]. 2011.
[26] 吴海燕,杨磊,李思东,等. 生物催化风味在水产品加工中的应用[J]. 广东化工, 2010, 37(07): 66-67.
WU Haiyan, YANG Lei, LI Sidong, et al. The application of biocatalysis-flavor-technology in aquatic processing[J]. Guangdong Chemical, 2010, 37 (07): 66-67.
[27] 张鸽,李志豪,邓帅军,等. 海南H382雪茄烟叶不同发酵周期细菌群落多样性表征及演替分析[J]. 中国烟草学报, 2021, 27(02): 117-126.
ZHANG Ge, LI Zhihao, DENG Shuaijun, et al. Characterization and succession analysis of bacterial community diversity in different fermentation cycles of Hainan H382 cigar leaf[J]. Acta Tabacaria Sinica, 2021, 27 (02): 117-126.
[28] 申佩弘,晁红军,宋修鹏,等. 利用双标记mTn5构建甲基杆菌MB200突变体库的研究[J]. 山西农业科学, 2008(11): 26-30.
SHEN Peihong, CHAO Hongjun, SONG Xiupeng, et al. Use of dual marker transposon to constructsp. MB200 mutants[J]. Journal of Shanxi Agricultural Sciences, 2008 (11): 26-30.
[29] 徐伟,葛阳阳,陈翠婷,等. 基于宏基因组技术分析传统红茶菌中菌群组成及其主要代谢通路[J]. 食品工业科技, 2018, 23(5): 119-123, 129.
XU Wei, GE Yangyang, CHEN Cuiting, et al. Microorganism composition and main metabolic pathways analysis of traditional kombucha by metagenomics technology[J]. Science and Technology of Food Industry, 2018, 23 (5): 119-123, 129.
[30] 雷亚芳. 不同酶制剂与香料处理对烟叶品质及微生物多样性的影响[D]. 杨凌:西北农林科技大学, 2021.
LEI Yafang. Effects of different enzyme preparations and spice treatments on the quality and microbial diversity of tobacco leaves[D]. YangLing: Northwest A&F University, 2021.
[31] 过伟民,郭建华,董洪旭,等. 烤烟游离氨基酸与感官品质的关联及烘烤过程的变化规律研究[J]. 中国烟草学报, 2018, 24(06): 16-25.
GUO Weimin, GUO Jianhua, DONG Hongxu, et al. Correlation between free amino acids and smoking quality of flue-cured tobacco and variations during flue-curing process[J]. Acta Tabacaria Sinica, 2018, 24 (06): 16-25.
[32] 高嵩,孙文松,温健,等. 连作龙胆草根际土壤细菌多样性及功能预测分析[J]. 沈阳农业大学学报, 2021, 52(01): 102-108.
GAO Song, SUN Wensong, WEN Jian, et al. Diversity of rhizosphere bacterial and function predicted analysis in gentiana scabra replanting soil[J]. Journal of Shenyang Agricultural University, 2021, 52 (01): 102-108.
Diversity analysis and function prediction of bacterial communities in cigar leaves based on high-throughput sequencing technology
YAN Tiejun1, ZHENG Linlin2, LI Xiuni3, LIU Liping1, PAN Yong1, WANG Jian1, LONG Fei1, ZHOU Ping1, SHI Xiangdong2*
1 China Tobacco Hubei Industrial Co., Ltd., Wuhan 430048, China;2 Tobacco College of Henan Agricultural University, Zhengzhou 45000, China;3 Sichuan Agricultural University, Chengdu 610000, China
The change of environmental conditions and the physical and chemical properties of tobacco leaves directly affects the structure and function of tobacco leaf bacterial communities. The purpose of this study was to explore the composition of bacterial communities in cigar wrapper leaves, case leaves and core leaves in different producing areas of Hainan, and to study the bacterial community structure and metabolic function of cigar tobacco.16S rRNA sequencing technology was adopted to analyze the bacterial community structure, and PICRUSt was employed to predict the metabolic profiles of the bacterial community.(1) Alpha diversity analysis results show that 12 samples clustered a total of 2317 OTUs, belonging to 10 sections. The diversity and richness of bacterial communities in the aubergine tobacco leaves in the five-fingered mountain production area were the highest, with the values of Chao1, ACE and Shannon indexing 344.00, 344.00 and 6.54, respectively. (2) The analysis of the structure of the flora shows that the main dominant bacteria on the surface of the cigar wrapper leaves are Staphylococcaceae, the main dominant bacteria on the surface of the cigar case and cigar core leaves are Enterobacteriaceaeand Pseudomonadaceae, respectively; (3) The results of KEGG metabolic pathway analysis show that the main enrichment pathways of microorganisms on the surface of tobacco leaves in different producing regions are consistent, mainly in carbohydrate metabolism, amino acid metabolism, energy metabolism and metabolism of cofactors and vitamins.At the level of family classification, the bacterial community diversity is abundant in different cigar tobacco leaves from different producing areas with different uses, and the bacterial community structure composition is similar, but the relative abundance is different., wherestaphylococcaceae and enterobacteriaceae are the key bacteria causing differences in the structure of tobacco leaf bacterial community. Bacterial community is rich in metabolic pathways, mainly enriched in carbohydrate metabolism, amino acid metabolism and energy metabolism pathways, in addition, also enriched in cofactor and vitamin metabolism pathways.
cigar leave; high-throughput sequencing; bacterial community structure; function prediction
Corresponding author. Email:yancaoshixd@163.com
黄鹤楼叶束式手卷雪茄原料生产技术研究(No.2019420000340640)
闫铁军(1980—),硕士,高级农艺师,主要研究方向:卷烟产品研发与原料应用技术研究,Email:114461411@qq.com
时向东(1966—),Email:yancaoshixd@163.com
2021-11-02;
2022-02-22
闫铁军,郑霖霖,李秀妮,等. 基于高通量测序的雪茄烟叶细菌多样性与功能预测[J]. 中国烟草学报,2022,28(4).YAN Tiejun,ZHENG Linlin,LI Xiuni, et al. Diversity analysis and function prediction of bacterial communities in cigar leaves based on high-throughput sequencing technology[J]. Acta Tabacaria Sinica, 2022, 28(4). doi:10.16472/j.chinatobacco. 2021.T0197
