烤烟不同成熟度上部叶中抗性淀粉与淀粉组分的变化及其与基因表达的关系
2022-09-02徐梦晓杨永锋段史江谭志能贾世伟李小勇张子颖彭玉富王佩陈小龙
徐梦晓,杨永锋,段史江,谭志能,贾世伟,李小勇,张子颖,彭玉富,王佩,陈小龙*
烤烟不同成熟度上部叶中抗性淀粉与淀粉组分的变化及其与基因表达的关系
徐梦晓1,杨永锋2,段史江3,谭志能3,贾世伟2,李小勇3,张子颖2,彭玉富2,王佩1,陈小龙2*
1 河南农业大学烟草学院,河南郑州 45000 2;2 河南中烟工业有限责任公司技术中心,河南郑州 450016;3 江西省烟草公司吉安市公司,江西吉安 343009
【目的】为研究烤烟上部叶在成熟后期及烘烤过程中淀粉组分和抗性淀粉含量的变化。【方法】以烤烟品种云烟87上部叶为试验材料,分析不同成熟度鲜烟叶及其在烘烤过程中淀粉组分和抗性淀粉含量的变化,阐明抗性淀粉和淀粉组分的相关性,通过实时定量PCR探究不同成熟度烟叶中淀粉合成相关基因的表达模式。【结果】(1)随烟叶不断成熟,淀粉粒数量迅速变多、体积增大,烟叶变黄时,叶绿体开始解体,淀粉粒逐渐降解。(2)不同成熟度鲜烟叶中直链淀粉含量与支链淀粉含量:欠熟>适熟>过熟,而抗性淀粉含量差异不大;在烟叶衰老过程中,支链淀粉迅速降解,而直链淀粉和抗性淀粉缓慢降解。(3)在烘烤过程中,淀粉降解主要集中在变黄期。烘烤结束后,烤烟中未降解的淀粉约50%为抗性淀粉。(4)淀粉合成基因葡萄糖-1-磷酸腺苷酰转移酶小亚基3()、葡萄糖-1-磷酸腺苷酰转移酶大亚基()、颗粒结合型淀粉合酶()可溶性淀粉合酶2()1,4-a-葡聚糖分支酶()2,3淀粉分支酶2()和异淀粉酶2()在欠熟烟叶中的基因表达水平较高,随烟叶衰老表达水平下调,而异淀粉酶3()的基因表达水平在烟叶衰老过程中持续上调。【结论】烤烟不同成熟度上部叶中存在抗性淀粉,烘烤过程的变黄期是烟叶内淀粉降解的主要时期,但大田期形成的抗性淀粉很难在烘烤过程中充分降解。因此,可以通过适当推迟烟叶采收,降低烤烟淀粉含量,从而提高上部叶可用性。
烤烟;抗性淀粉;直链淀粉;支链淀粉;基因表达
淀粉是烟叶中碳水化合物贮藏的主要形式,在成熟鲜烟叶中含量高达40%[1-3],经调制和发酵可产生多种致香前体物[4]。较高的淀粉含量对烟叶的色香味都极为不利,影响卷烟香气质及吸味口感[5],国外优质烤烟淀粉含量约为1%~2%,而我国烤烟调制后的淀粉含量普遍为4%~6%[6]。烘烤过程中外加淀粉类酶能有效将烟叶中淀粉转化为水溶性糖[7-9]。研究发现,淀粉的降解主要取决于直链淀粉与支链淀粉的比例,直链淀粉含量高的淀粉可能具备抗酶解性[10]。Englyst等提出部分不能被淀粉酶水解的淀粉即为抗性淀粉[11]。天然抗性淀粉颗粒是植物体内自然合成的,回生抗性淀粉由直链淀粉老化结晶形成[12],区别在于抗性淀粉的来源和酶解机制不同。影响抗性淀粉含量的因素包括植物来源、产地及种植环境、基因类型、直链淀粉/支链淀粉比例、直链淀粉链长、淀粉分子聚合度、淀粉颗粒的大小以及处理方式等[13]。其他作物中关于抗性淀粉的研究表明,直链淀粉经湿热处理后会回生老化形成抗性淀粉[14-16],且随着老化时间的延长,抗性淀粉回生速率加快[17]。潘飞龙等研究发现,ADPG焦磷酸化酶(AGPase)和GBSS是影响直链淀粉积累的关键酶,而可溶性淀粉合成酶(SSS)和淀粉分支酶(SBE)是影响支链淀粉积累的关键酶[18]。Parween等研究表明,,和异淀粉酶()基因与抗性淀粉的形成有关[19]。目前研究大多集中于制备谷物抗性淀粉,但烟叶中抗性淀粉的研究尚未报道。
本研究主要围绕烟叶中是否存在抗性淀粉,以及淀粉组分与抗性淀粉的关系两个问题,比较分析不同成熟度上部叶鲜烟叶及其在烘烤过程中淀粉组分和抗性淀粉含量的变化,分析淀粉合成相关基因表达量,为降低上部烟叶中的淀粉含量、提高上部叶可用性提供参考。
1 材料与方法
1.1 供试品种及试验设计
试验于2021年在江西省吉安市永丰县沿陂村进行,供试烤烟品种为云烟87,按当地优质烟叶生产技术规范进行田间管理。烟株统一摘除3片脚叶,留叶数20片。5月7日烟叶打顶后每隔10 d取一次样,共6次,分别用于超微结构观察和淀粉含量测定。设置3个成熟度处理,根据烟叶成熟度标准[20]对上部烟叶进行不同成熟度的采收:欠熟(打顶后20 d)为叶色7~8成黄、主脉1/2变白;适熟(打顶后30 d)为叶色黄色鲜亮、叶面8~9成变黄、主脉2/3变白、叶尖叶缘枯、叶耳微黄、茸毛部分脱落;过熟(打顶后40 d)为叶色9~10成黄、主脉和支脉全白、叶耳淡黄、茸毛大部分脱落。烟叶采收后按三段式烘烤工艺进行烘烤。烘烤过程中每24 h取一次样(包括烘烤0 h),共7次。烟叶杀青烘干后去除主脉充分研磨,过100目筛,进行淀粉组分和抗性淀粉的测定。
1.2 测定方法
1.2.1 超微结构观察
选取上部叶第17叶位,在叶片右侧的第7和第8支脉之间,距离主脉3~5 cm处切取1 cm×0.5 cm叶肉组织,采用2.5%戊二醛溶液进行固定,室温放置30 min后于4℃冰箱内保存。采用HT7700透射电镜观察叶绿体超微结构[21]。
1.2.2 淀粉含量测定
在欠熟、适熟、过熟三个时期各选取长势一致的3棵烟株,每株选取上部叶第16~18叶位各1片。烟叶杀青烘干后去除主脉充分研磨,过100目筛,进行淀粉组分和抗性淀粉的测定。
称取1.0 g样品放于滤纸包,将滤纸包移入索氏抽提器提取管中,提取器中加入石油醚,于45℃水浴中回流萃取6 h(回流速度100~150滴/min),将滤纸包取出60℃烘干。将石油醚换作丙酮,于60℃水浴中继续加热回流约5 h,结束后取出滤纸包烘干。将滤纸包放入80%乙醇-氯化钠饱和溶液,超声萃取20 min,重复超声步骤至上清无色,烘干样品用于淀粉组分(直链淀粉和支链淀粉)和抗性淀粉的测定。
采用双波比色法测定直链淀粉和支链淀粉的含量[22]。称取0.1 g淀粉样品,溶解于10 mL 0.5 mol/L KOH溶液中,定容至50 mL。取上述溶液5 mL,加入蒸馏水30 mL,调节pH至3.0,加0.5 mL碘试剂,定容至50 mL,静置反应15 min后比色。测定512 nm 和596 nm处的吸光值计算直链淀粉的含量。测定560 nm 和695 nm处的吸光值计算支链淀粉的含量。
采用酶消化法(抗性淀粉检测试剂盒,Megazyme)测定抗性淀粉的含量[23]。取1.0 g烘干样品加入15 mL离心管中,加入胰腺a-淀粉酶和淀粉葡萄糖苷酶(AMG),非抗性淀粉被水解为D-葡萄糖,沉淀即为抗性淀粉。加入等体积的乙醇终止反应,收集抗性淀粉,用2 mol/L KOH溶解抗性淀粉,磁力搅拌溶解后调至溶液pH至7.0,加入AMG水解抗性淀粉为D-葡萄糖(G),最后用葡萄糖氧化酶/过氧化物酶试剂(GOPOD)测定抗性淀粉含量。抗性淀粉含量=G×(10.3/0.1)×0.9×100%。
1.2.3 实时定量PCR分析
在欠熟、适熟、过熟3个时期各选择3株烟的第17叶位,撕取第7和第8支脉之间的叶片组织,用于淀粉合成基因的表达量分析。采用Trizol法提取烟叶总RNA,用M-MLV Reverse Transcriptase试剂盒进行cDNA合成。使用Primer Premier 5.0软件,根据在Genbank发布(NCBI; http://www.ncbi.nlm.nih.gov)的普通烟草淀粉合成相关基因、、、、、、、、、、、和的序列,在基因的保守区域设计实时定量PCR引物(表1)。按照LightCycler®480 SYBR Green I Master试剂盒(罗氏)的操作说明配制反应体系,在荧光定量 PCR 仪上进行PCR反应。PCR反应程序为:95℃2 min;95℃10 s,60℃30 s,72℃,30 s,40个循环。以作为内参基因,利用2-ΔΔCt公式计算每个基因的相对表达量[24],基因表达量最低的处理(过熟烟叶,)设定为对照,其他处理条件下的基因表达量为对照的N倍。实验设置3次重复。
表1 实时定量PCR扩增引物

Tab.1 Primer sequence in qRT-PCR
1.2.4 数据处理
使用Excel 2010对数据进行整理,利用SPSS 17.0进行方差分析及显著性检验。
2 结果与分析
2.1 成熟期上部烟叶中叶绿体形态变化
利用透射电镜观察打顶后上部烟叶中叶绿体的形态变化发现(图1),随叶片不断成熟,淀粉粒数目迅速增加、体积增大,烟叶成熟后期淀粉粒开始降解。成熟前期(打顶当天及打顶10 d),烟叶快速生长,叶绿体紧贴细胞壁,类囊体结构清晰、片层较多,整齐有序排列在叶绿体内,叶绿体被膜上分布着一些质体小球,淀粉粒被紧密包裹在叶绿体内,数量少且体积小,还有新的淀粉粒正在形成;成熟中期(打顶20~30 d),烟叶基本定长,叶绿体类囊体片层结构清晰程度下降;类囊体开始肿胀,淀粉粒数目和体积增至最大,淀粉粒多数发育充盈,基本包裹在叶绿体内;成熟后期(打顶40~50 d),叶绿体膜破裂,淀粉粒开始降解,大量淀粉粒游离到细胞中部。

图1 成熟期上部烟叶的叶绿体超微结构比较(×2500)
2.2 成熟度对上部烟叶中淀粉组分和抗性淀粉含量的影响
不同成熟度上部叶淀粉组分和抗性淀粉的含量测定结果表明(图2),直链淀粉、支链淀粉和抗性淀粉在欠熟期烟叶的含量分别为12.60%、25.40%和7.20%,在适熟烟叶中分别为11.80%、19.70%和6.60%,在过熟烟叶中分别为10.20%、14.30%和6.10%。可见随着烟叶衰老,烟叶中的淀粉逐步降解;欠熟烟叶的支链淀粉含量较高,适熟烟叶次之,过熟烟叶最低;欠熟和适熟烟叶中的直链淀粉和抗性淀粉含量无显著差异,过熟烟叶中的直链淀粉和抗性淀粉含量显著低于欠熟烟叶,而与适熟烟叶无显著差异。比较不同成熟度上部叶的淀粉组分和抗性淀粉含量发现,烟叶中支链淀粉的含量较高,直链淀粉含量较低,欠熟烟叶直支比为0.50,适熟烟叶直支比为0.60,过熟烟叶直支比为0.71。以上结果表明,随着烟叶衰老,支链淀粉迅速降解,而直链淀粉降解缓慢;成熟期烟叶中存在大量抗性淀粉;与支链淀粉相比,直链淀粉和抗性淀粉随着烟叶衰老均呈现缓慢降解趋势;3种成熟度上部鲜烟叶中的直链淀粉、支链淀粉和抗性淀粉含量大小排序为:过熟<适熟<欠熟。

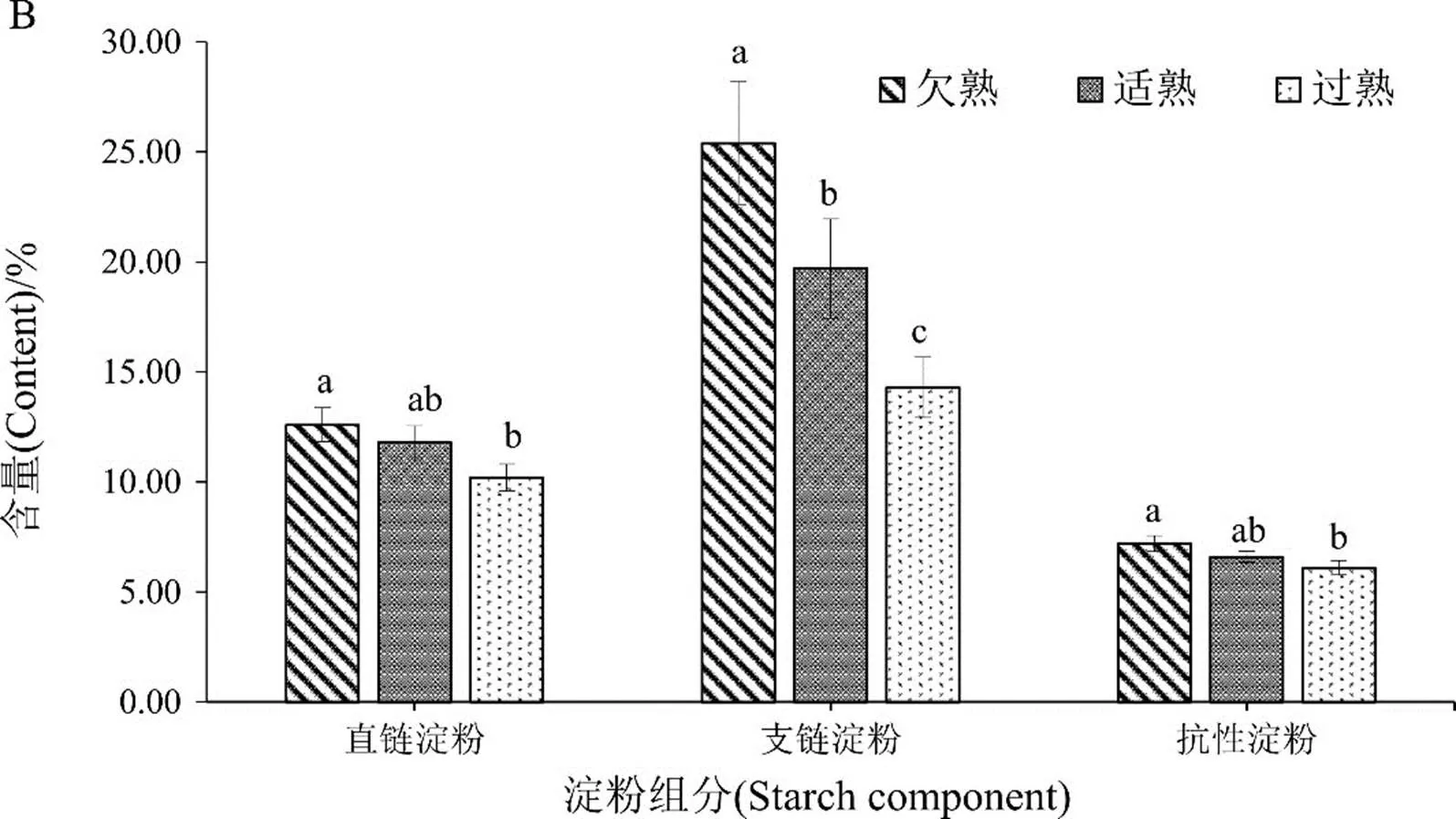
注:图中不同小写字母代表处理间差异达0.05 显著水平(<0.05),后同。
Note: Different lowercase letters in the figure mean significant difference among treatments at 0.05 level (<0.05), the same as below.
图2 不同成熟度上部烟叶淀粉含量的变化
Fig.2 Change of starch content in upper leaves at different mature stages
2.3 烘烤过程中不同成熟度上部烟叶的淀粉降解
烘烤过程中不同成熟度上部烟叶中的淀粉组分和抗性淀粉含量变化结果表明(表2),在烘烤过程中,欠熟、适熟和过熟烟叶中的直链淀粉、支链淀粉和抗性淀粉含量均呈下降趋势。变黄期,尤其是变黄前期和中期是淀粉降解的重要时期,其中变黄中期,适熟烟叶的直链淀粉、支链淀粉和抗性淀粉的降解量就达到了56.44%、43.35%和42.27%,欠熟烟叶的直链淀粉、支链淀粉和抗性淀粉的降解量达到53.78%、43.57%和23.61%,过熟烟叶的直链淀粉、支链淀粉和抗性淀粉的降解量为47.88%、34.90%和16.07%。变黄期结束时,适熟烟叶的降解量最多,直链淀粉、支链淀粉和抗性淀粉的降解量分别为76.78%、69.80%和55.84%。在定色期,支链淀粉有少量降解,而直链淀粉和抗性淀粉的含量基本无变化。在干筋期,各淀粉组分和抗性淀粉含量均无变化。烘烤结束后,适熟烟叶中的直链淀粉、支链淀粉和抗性淀粉含量分别为1.88%、3.75%和2.43%,欠熟烟叶中的直链淀粉、支链淀粉和抗性淀粉含量分别为2.38%、5.54%和3.48%,过熟烟叶中的直链淀粉、支链淀粉和抗性淀粉含量分别为2.22%、5.14%和3.15%。可见,3种成熟度上部烤后烟叶的直链淀粉、支链淀粉和抗性淀粉含量大小排序为:适熟<过熟<欠熟。
表2 上部烟叶烘烤过程中淀粉组分和抗性淀粉的含量变化
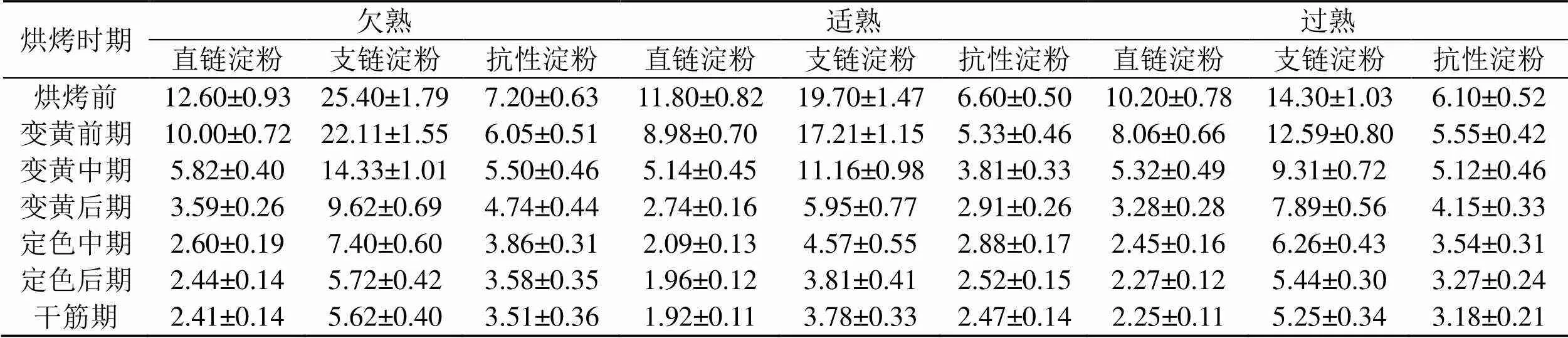
Tab.2 Changes of starch component and resistant starch contents in upper leaves during flue-curing process
2.4 不同成熟度上部烟叶中淀粉合成基因的表达
不同成熟度上部烟叶中淀粉合成基因的表达检测结果表明(图3),大部分淀粉合成相关基因的表达水平在烟叶衰老过程中整体呈现下调趋势,而的表达趋势相反,呈现上调的趋势。这些淀粉合成基因的表达可分为5种模式:(1)和的表达水平整体较低,在不同成熟度烟叶中的表达水平无显著差异,在适熟烟叶中的表达水平显著高于过熟烟叶,而与欠熟烟叶无显著差异;(2)、、、、和的表达水平在烟叶衰老过程逐步下调,且在不同成熟度烟叶中的表达水平均呈现显著差异,表现为欠熟>适熟>过熟;(3)和的表达水平整体较高,在不同成熟度烟叶中的表达水平呈现显著差异,在适熟烟叶中的表达水平显著高于过熟烟叶,而与欠熟烟叶无显著差异;(4)和在适熟烟叶中的表达量下调,在适熟烟叶中的表达水平显著低于欠熟烟叶,而与过熟烟叶无显著差异;(5)的基因表达水平在烟叶衰老过程呈现持续上调趋势,且在不同成熟度烟叶中的表达水平均呈现显著差异。整体来看,、、和在欠熟烟叶中的基因表达水平较高,随着烟叶衰老表达量下调。
异淀粉酶属于淀粉去分支酶,可以在淀粉合成过程中进行支链淀粉分支的修饰,也可以在淀粉降解过程催化支链淀粉分支的酶解。异淀粉酶编码基因的基因表达模式结果显示,该基因可能在支链淀粉降解过程中起重要作用。

图3 不同成熟度上部烟叶中淀粉合成基因的表达模式
3 讨论
准确把握烟叶的成熟度是提高烟叶质量的关键因素之一,而淀粉含量和烟叶成熟度密切相关,淀粉含量下降标志着烟叶开始成熟[25-27]。大量研究表明,随着烟叶发育,淀粉含量逐渐增加,烟叶生理成熟时淀粉含量最高,随后淀粉含量逐渐降低[28-30]。本研究发现云烟87上部烟叶在打顶后淀粉粒数目增多,体积增大,淀粉开始迅速累积,工艺欠熟时期,总淀粉含量高达38.00%,随着烟叶成熟期的推进,淀粉粒逐渐降解,总淀粉含量逐渐降低至适熟时31.50%,过熟时24.50%。可见,推迟烟叶成熟采收时期可以降低烟叶的淀粉含量。杨胜男等研究表明,施用复合有机肥有利于淀粉粒的累积,直链淀粉含量减少,淀粉组分相应改变[2]。通过一些栽培技术手段或许可以降低直链淀粉的含量,从而降低淀粉含量,但仍需要进一步研究。
烘烤过程中外加一定量的糖化酶和a-淀粉酶等淀粉类酶能有效地将烟叶中的淀粉转化为水溶性糖[7-9]。黑豆[31]、荞麦[13]、稻米[14]、香蕉[16]以及蚕豆[17]等作物中关于抗性淀粉形成原因的研究表明,直链淀粉经过湿热、化学改性等处理后会回生老化,形成难以被淀粉酶水解的抗性淀粉。本研究结果发现,烘烤过程中直链淀粉和支链淀粉大量降解,抗性淀粉降解缓慢,变化不明显;烘烤结束后,适熟烟叶的淀粉组分和抗性淀粉降解量均较多,说明适熟采收极为重要。此外在烘烤过程中防止出现高低温度反复,减少直链淀粉老化,可能也会影响抗性淀粉的含量。
在植物淀粉合成途径中,AGPase的作用是把来自光合作用的葡萄糖-1-磷酸(G-1-P)和ATP转变成ADP葡萄糖和ADP,ADP葡萄糖在淀粉合成酶的作用下合成直链淀粉或支链淀粉。在移栽85~95 d表达量较高,之后逐渐下调。打顶至适熟,GBSSΙ调控烟叶直链淀粉合成,SS、SBE调控烟叶支链淀粉合成,SBE调控烟叶直链淀粉/支链淀粉;进入过熟阶段,淀粉酶对烟叶淀粉代谢起主要调控作用[18]。与前人研究结果相同,本研究也发现淀粉合成酶AGPase、GBSS、SS和SBE的基因表达水平在烟叶衰老过程中基本呈现下调趋势。GBSS作为直链淀粉合成的关键酶,可以敲除烟草中的基因或降低基因的表达水平,进而降低烟叶中的直链淀粉和抗性淀粉含量,最终实现淀粉在成熟和烘烤过程中充分降解的目的。支链淀粉的合成非常复杂,需要在SBE和ISA等的协同作用对支链分支进行修饰[32-33]。值得注意的是,异淀粉酶ISA可以催化α-l, 6葡萄糖苷键的水解,因此其同时也参与支链淀粉的合成和降解过程。在拟南芥和马铃薯中编码ISA有3个编码基因,功能研究表明和主要催化支链淀粉的合成,而的主要功能是催化淀粉分解[34-36]。与此研究结果相似,在烟叶衰老过程中和的基因表达水平逐渐降低,而的基因表达水平呈现持续增加趋势。通过基因表达分析结果可知,可以利用衰老启动子,通过生物技术手段降低高表达水平淀粉合成基因、、、、和在成熟烟叶中的表达,或提高的基因表达水平,实现降低成熟烟叶中淀粉含量的目的。本研究仅分析了淀粉合成酶相关基因,还需进一步研究淀粉酶(ɑ-淀粉酶和ß-淀粉酶)在不同成熟度上部烟叶中的基因表达水平以及淀粉代谢关键酶与淀粉组分和抗性淀粉含量的关系。
4 结论
成熟鲜烟叶中存在抗性淀粉。在烟叶衰老过程中,支链淀粉迅速降解,而直链淀粉和抗性淀粉缓慢降解。烘烤过程中,不同成熟度烟叶的直链淀粉和支链淀粉均被大量降解,抗性淀粉缓慢降解。烘烤结束后,适熟烟叶的淀粉组分和抗性淀粉含量较低。适熟采收是降低上部叶淀粉组分和抗性淀粉含量、提高上部叶可用性的有效措施。
[1] 邓云龙,孔光辉,武锦坤,等. 氮素营养对烤烟叶片淀粉积累及SPS、淀粉酶活性的影响[J]. 烟草科技,2001(11): 34-37.
DENG Yunlong, KONG Guanghui, WU Jinkun, et al. Effects of nitrogen on starch accumulation, SPS and Amylase activity in flue-cured tobacco leaves [J]. Tobacco Science and Technology, 2001(11): 34-37.
[2] 杨胜男,张洪映,连文力,等. 复合有机肥对烤烟淀粉生物合成的影响[J]. 中国烟草学报,2016, 22(1): 64-70.
YANG Shengnan, ZHANG Hongying, LIAN Wenli, et al. Effects of compound organic fertilizer on starch biosynthesis of flue-cured tobacco[J]. Acta Tobacco Sinica, 2016, 22(1): 64-70.
[3] 刘辉,祖庆学,王松峰,等. 不同成熟度对鲜烟素质和烤后烟叶质量的影响[J]. 中国烟草科学,2020, 41(02): 66-71.
LIU Hui, ZU Qingxue, WANG Songfeng, et al. Effects of different maturity on quality of fresh and cured tobacco leaves [J]. Chinese Tobacco Science, 2020, 41(2): 66-71.
[4] 朱尊权. 论当前我国优质烤烟生产技术导向[J]. 烟草科技,1994(1): 2-5.
ZHU Zunquan. On the technical guidance of high quality flue-cured tobacco production in China [J]. Tobacco Science and Technology, 1994(1): 2-5.
[5] 张槐苓,葛翠英,穆怀静,等. 烟草分析与检测[M]. 郑州:河南科学技术出版社,1994.
ZHANG Huailing, GE Cuiying, MU Huaijing, et al. Tobacco analysis and testing [M]. Zhengzhou: Henan Science and Technology Press, 1994.
[6] 韦克苏,蒋石香,颜杭,等. 采收成熟度对提高上部烟叶可用性的影响——基于细支卷烟原料需求[J]. 江苏农业科学,2020, 48(23): 204-209.
WEI Kesu, JIANG Shixiang, YAN Hang, et al. Effect of harvesting maturity on improving the availability of upper tobacco leaf based on the demand of fine tobacco raw material [J]. Jiangsu Agricultural Sciences, 2020, 48(23): 204-209.
[7] 王怀珠,杨焕文,郭红英,等. 淀粉类酶降解鲜烟叶中淀粉的研究[J]. 中国烟草科学,2005(2): 37-39.
WANG Huaizhu, YANG Huanwen, GUO Hongying, et al. Starch enzyme degradation starch in the fresh leaf tobacco research [J]. Chinese Tobacco Science, 2005(2): 37-39.
[8] 李晓,刘凤珠,姜凌,等. 淀粉类酶在烟叶中降解条件的研究[J]. 生物技术,2001(2): 44-46.
LI Xiao, LIU Fengzhu, JIANG Ling, et al. Starch enzyme degradation conditions in the tobacco study [J]. Journal of Biotechnology, 2001(2): 44-46.
[9] 罗丹,吴俊,全学军,等. 淀粉类酶降解烤烟中淀粉的研究[J]. 重庆理工大学学报(自然科学),2016, 30(7): 64-68.
LUO Dan, WU Jun, QUAN Xuejun, et al. Degradation of starch in flue-cured tobacco by starch enzyme [J]. Journal of Chongqing University of Technology (Natural Science), 2016, 30(7): 64-68.
[10] Cummings JH, Stephen AM. Carbohydrate terminology and classification[J]. European Journal of Clinical Nutrition, 2007, 61(S1):
[11] HN Englyst, J Veenstra, GJ Hudson. Measurement of rapidly available glucose (RAG) in plant foods: a potential in vitro predictor of the glycaemic response[J]. British Journal of Nutrition, 1996, 75(3):
[12] 郑绍达,周笑犁,罗庆丰,等. 青稞回生抗性淀粉单因素制备工艺研究[J]. 农业机械,2011(2): 108-111.
ZHENG Shaoda, ZHOU Xiaoli, LUO Qingfeng, et al. Single factor preparation of resistant starch from Highland Barley [J] . Agricultural Machinery, 2011(2): 108-111.
[13] 陈盛军. 荞麦抗性淀粉制备及其影响因素分析[D]. 西北农林科技大学,2008.
CHEN Shengjun. Preparation and influence factors of buckwheat resistant starch [D]. Northwest A&F University, 2008.
[14] 张春龙,Channarong PHONGSAI,张江丽,等. 稻米抗性淀粉含量及其环境稳定性分析[J]. 中国农业科学,2019, 52(17): 2921-2928.
ZHANG Chunlong, PHONGSAI C, ZHANG Jiangli, et al. Analysis of rice resistant starch content and its environmental stability [J]. Scientia Agricultura Sinica, 2019, 52(17): 2921-2928.
[15] 朱哲,刘良忠,黄婷,等. 直链淀粉含量及淀粉平均聚合度对抗性淀粉含量影响的研究[J]. 湖北农业科学,2017, 56(2): 320-324.
ZHU Zhe, LIU Liangzhong, HUANG Ting, et al. Effects of amylose content and average polymerization degree of starch on resistant starch content [J]. Hubei Agricultural Sciences, 2017, 56(2): 320-324.
[16] 苗红霞,金志强,刘伟鑫,等. 香蕉果实抗性淀粉含量变化及其与其他类型淀粉相关性分析[J]. 中国农业科学,2013, 46(24): 5180-5187.
MIAO Hongxia, JIN Zhiqiang, LIU Weixin, et al. Changes of resistant starch content in banana fruit and its Correlation with other types of starch [J]. Scientia Agricultura Sinica, 2013, 46(24): 5180-5187.
[17] 潘元风,唐书泽,戴远威,等. 微波辐射制备蚕豆抗性淀粉研究[J]. 食品研究与开发,2008(5): 15-18.
PAN Yuanfeng, TANG Shuze, DAI Yuanwei, et al. Preparation of resistant starch from Broad bean by microwave irradiation [J]. Food Research and Development, 2008(5): 15-18. (in Chinese)
[18] 潘飞龙,田维强,宋朝鹏,等. 烤烟成熟期淀粉代谢关键酶活性与基因表达研究[J]. 西北农林科技大学学报(自然科学版),2019, 47(9): 33-43.
PAN Feilong, TIAN Weiqiang, SONG Chaopeng, et al. Study on the enzyme activity and gene expression of starch metabolism in flue-cured tobacco [J]. Journal of Northwest A&F University (Natural Science Edition), 2019, 47(9): 33-43.
[19] Parween S, Anonuevo JJ, Butardo V, et al.Balancing the double-edged sword effect of increased resistant starch content and its impact on rice texture: Its genetics and molecular physiological mechanisms. Plant Biotechnol [J]. 2020, 18(8): 1763-1777.
[20] 韩锦峰. 烟草栽培生理[M]. 北京:中国农业出版社,2003: 226-228.
HAN Jinfeng. Tobacco cultivation physiology [M]. Beijing: China Agriculture Press, 2003: 226-228.
[21] 徐柏森,张耀丽,何开跃,等. 植物透射电镜样品制备技术探讨[J]. 中国野生植物资源,2006(3): 41-43.
XU Baisen, ZHANG Yaoli, HE Kaiyue, et al. Preparation of plant samples by transmission electron microscopy [J]. Chinese Wild Plant Resources, 2006(3): 41-43.
[22] 王文超,贺帆,宋朝鹏,等. 双波长分光光度法测定烟草中的直链淀粉和支链淀粉[J]. 烟草科技,2013(6): 50-52.
WANG Wenchao, HE Fan, SONG Chaopeng, et al. Determination of amylose and amylopectin in tobacco by dual wavelength spectrophotometry [J]. Tobacco Science and Technology, 2013(6): 50-52.
[23] 王倩,陈小红,马瑞凯,等. 北方春糜子区黍稷资源抗性淀粉含量差异分析[J]. 山西农业科学,2021, 49(2): 126-133.
WANG Qian, CHEN Xiaohong, MA Ruikai, et al. Resistant starch content of spring corn millet in the north area of millet resources gap analysis [J]. Journal of Shanxi Agricultural Science, 2021, 49(2): 126-133.
[24] Gregor W, Schmidt, Sven K, et al. Stable internal reference genes for normalization of real-time RT-PCR in tobacco () during development and abiotic stress[J]. Molecular Genetics and Genomics,2010,283(3):
[25] 朱尊权. 烟叶分级和烟叶生产技术的改革[J]. 烟草科技,1990(3): 2-7.
ZHU Zunquan. Tobacco classification and reform of tobacco production technology [J]. Tobacco Science and Technology, 1990(3): 2-7.
[26] 贾琪光,宫长荣. 烟叶生长发育过程中主要化学成分含量与成熟度关系的研究[J]. 烟草科技,1988(6): 40-44.
JIA Qiguang, GONG Changrong. Study on the relationship between the content of main chemical components and maturity of tobacco leaf during growth and development [J]. Tobacco Science and Technology, 1988(6): 40-44.
[27] 朱忠,冼可法,尚希勇. 中上部不同成熟度烤烟烟叶与主要化学成分和香味物质组成关系的研究[J]. 中国烟草学报,2008(1): 6-12.
ZHU Zhong, XIAN Kefa, SHANG Xiyong. Study on the relationship between main chemical constituents and aroma components of flue-cured tobacco leaves with different maturity in middle and upper part [J]. Acta Tabacaria Sinica, 2008(1): 6-12.
[28] Moseley JM. The relationship of maturity of the leaf at harvest and certain properties of the cured leaf of flued-cured tobacco[J]. Tobacco Science‚1963. 7: 67-75.
[29] Terrill TR. Influence of harvesting variables[C]. Recent Advances in Tobacco Science‚1974. 50-62.
[30] Hwang KJ.‚Kim CW.‚Kim CH. Studies on the change of chemical components of flue-cured tobacco with maturity [C]. Coresta‚1981.
[31] 王成祥,饶欢,张美娜,等. 压热-酶解法制备黑豆抗性淀粉及其理化性质[J]. 食品工业,2021, 42(8): 69-72.
WANG Chengxiang, RAO Huan, ZHANG Meina, et al. Preparation and physicochemical properties of black bean resistant starch by pressure heating-enzymolysis method. Food Industry, 2021, 42(8): 69-72.
[32] Ohdan T, Francisco PB, Sawada T, et al. Expression profiling of genes involved in starch synthesis in sink and source organs of rice[J]. J Exp Bot, 2005, 56: 3229-3244.
[33] Yu GQ, Olsen KM, Schaal BA. Molecular evolution of the endosperm starch synthesis pathway genes in rice (L.) and its wild ancestor,L[J]. Mol Biol Evol, 2011, 28, 659-671.
[34] Hussain H, Mant A, Seai R. Three isoforms of isoamylase contribute different catalytic properties for the debranching of potato glueans [J]. Plant Cell, 2003, 15: 133-149.
[35] Zeeman SC, Umenoto T, Luew L, et a1. Amutant oflacking a chloroplastic isoamyiase accumulates both starch and phytoglycogen [J]. Plant Cell, 1998, 10: 1699-1711.
[36] Delatte T, Umhang M, Trevisan M, et a1. Evidence for distinct mechanism of starch breakdown in plants [J]. Journal of Biological Chemistry, 2006, 281: 12050-12059.
Changes of resistant starch contents and starch components in upper leaves of flue-cured tobacco at different maturity stages and their relationship with gene expression
XU Mengxiao1, YANG Yongfeng2, DUAN Shijiang3, TAN Zhineng3, JIA Shiwei2,LI Xiaoyong3, ZHANG Ziying2, PENG Yufu2, WANG Pei1, CHEN Xiaolong2*
1 College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, China;2 China Tobacco Henan Industrial Co., Ltd., Zhengzhou 450016, China;3 Jiangxi Province Ji’an Branch Company, China National Tobacco Corporation, Ji’an 343009, China
This paper aims to study the changes of starch components and resistant starch content in upper leaves of flue-cured tobacco at different maturity, in order to provide reference for improving the maturity, reducing the starch content and improving the availability of upper leaves in flue-cured tobacco.By taking the upper leaves of Yunyan 87 as research material, the changes of starch components and resistant starch contents in tobacco leaves at different maturity as well as the correlation between resistant starch and starch components were analyzed. The expression patterns of starch biosynthesis related genes were analyzed by real-time quantitative PCR.(1) Microscopic analysis revealed that the number and volume of starch granules increased gradually and reached maximum values at the mature stage. When tobacco leaves turned yellow, chloroplasts began to disintegrateand starch grains gradually degraded. (2) Starch content analysis showed that the resistant starch existed in mature tobacco leaves. The contents of resistant starch, amylose and amylopectin in leaves at different maturity stages were significantly different, which were the highest in un-riping leaves, followed by well-ripening leaves, and least in over-ripening leaves. During the aging process of tobacco leaves, amylopectin was rapidly degraded, while amylose and resistant starch were slowly degraded. (3) During the curing process, starch degradation mainly occurred in the yellowing stage. After flue-curing, about 50% of un-degraded starch in tobacco was resistant starch. (4) The gene expression levels of glucose-1-phosphate adenylyltransferase small subunit (), glucose-1-phosphate adenylyltransferase large subunit (), granule-bound starch synthase (S), probable starch synthase (), 1,4-alpha-glucan-branching enzyme-like (), 2-3 starch branching enzyme 2 ()and isoamylase 2 () were higher in immature tobacco leaves, and decreased gradually with the aging of tobacco leaves, while the gene expression level ofisoamylase 3 () increased continuously during the aging process.Resistant starch exists in the upper leaves of flue-cured tobacco. Starch in leaves can be degradated mainly at the yellowing stage, whereas resistant starch formed during leaf development is difficult to be degraded fully during roasting. It may be an effective way to reduce the starch content of flue-cured tobacco and improve the availability of upper leaves through preventing the amylase synthesis in tobacco leaves.
flue-cured tobacco; resistant starch; amylose; amylopectin; gene expression
Corresponding author. Email:cxlong119@163.com
江西省烟草公司吉安市公司资助项目“吉安烟区优质上部烟叶原料开发与应用”(JA2021-001)
徐梦晓(1998—),硕士研究生,研究方向为烟草生物技术,Tel:18838210127,Email:1755959873@qq.com
陈小龙(1982—),主要从事烟叶生产和质量检测研究,Tel:13803833842,Email:cxlong119@163.com
2021-11-03;
2022-05-24
徐梦晓,杨永锋,段史江,等.烤烟不同成熟度上部叶中抗性淀粉与淀粉组分的变化及其与基因表达的关系[J]. 中国烟草学报,2022,28(4).XU Mengxiao, YANG Yongfeng, DUAN Shijiang, et al. Changes of resistant starch contents and starch components in upper leaves of flue-cured tobacco at different maturity stages and their relationship with gene expression[J]. Acta Tabacaria Sinica, 2022,28(4). doi:10.16472/j.chinatobacco.2021.T0201
