3株拮抗烟草尖孢镰刀菌的木霉菌筛选鉴定及促生防病效果评价
2022-09-02姚晨虓李小杰刘畅邱睿白静科徐敏陈玉国康业斌李淑君
姚晨虓,李小杰,刘畅,邱睿,白静科,徐敏,陈玉国,康业斌,李淑君*
植物保护
3株拮抗烟草尖孢镰刀菌的木霉菌筛选鉴定及促生防病效果评价
姚晨虓1,2,李小杰2,刘畅2,邱睿2,白静科2,徐敏3,陈玉国2,康业斌1,李淑君2*
1 河南科技大学园艺与植物保护学院,洛阳 471023;2 烟草行业黄淮烟区烟草病虫害绿色防控重点实验室/河南省农业科学院烟草研究所,许昌 461000;3 中国烟草总公司河南省公司,郑州 450018
【目的】为筛选对烟草镰刀菌根腐病菌具有较好拮抗效果的菌株。【方法】从河南省主要烟叶产区健康烟株根际土壤中,分离纯化对尖孢镰刀菌()具有一定拮抗作用的真菌菌株,对筛选出的拮抗菌株进行形态学和分子生物学鉴定,并测定促生作用和防治效果。【结果】分离纯化得到的3株木霉菌分别为棘孢木霉()Ta-0101、哈茨木霉()Th-0201和毛簇木霉()Tv-0207,具有较强的抑菌能力,对尖孢镰刀菌的抑菌率分别为91.24%、84.71%和82.48%。3株木霉菌对烟草种子根长和总长均有显著的促生效果,根长增长率分别为28.89%、25.92%和22.22%,根系活力也显著提高;对烟株最大叶面积和鲜重的促生作用明显,其中棘孢木霉Ta-0101促生效果最显著。3株木霉菌对尖孢镰刀菌的相对盆栽防效分别为78.95%、69.73%和69.73%,均高于70%甲基硫菌灵1000倍液处理的防效。【结论】3株拮抗木霉菌具有较好的抑菌效能和促生防病效果,应用前景良好。
烟草尖孢镰刀菌;木霉菌;抑制效果;促生作用;防效
随着区域性环境变化和耕作制度的变迁,威胁烟草安全生产的土传病害日益严重[1-2]。尖孢镰刀菌()和茄病镰刀菌()等引起的烟草镰刀菌根腐病是我国烟草最严重的根茎类病害之一[3],河南省尖孢镰刀菌发生危害较为严重,重病田块发病率达30%以上,给烟叶生产带来严重的经济损失[4-6]。病原镰刀菌可在土壤和病残体中存活多年,难以根除,防治难度极大[7]。
目前,烟草病害的主要防控技术仍依靠抗病品种和化学药剂,但高抗品种少,化学药剂效果不稳定[8-10]。微生物菌剂以安全绿色、抗病抗逆、改善土壤微生态、提高品质和产量的优势成为主要的防治手段[11-12]。小麦、玉米、香蕉等作物均已开展了镰刀菌病害的流行规律、致病菌种类、致病特点、寄主的互作等研究[13]。但关于烟草镰刀菌根腐病生物防治的报道相对较少,尚未登记相关的专用生防制剂。
本研究筛选鉴定了对烟草镰刀菌具有较好抑菌效果的拮抗菌株,评价其促生防病效果,为烟草镰刀菌的绿色防控提供理论依据,为微生物农药的开发提供微生物资源。
1 材料与方法
1.1 供试材料
1.1.1 供试土样
供试土样于2020年采自河南省许昌市、平顶山市、洛阳市、漯河市、三门峡市、南阳市、驻马店市烟区团棵至旺长期发病田中健康烟株的根际土壤,共26份。
1.1.2 供试菌株和烟草品种
供试烟草尖孢镰刀菌()、烟草茄病镰刀菌()、烟草疫霉菌()、根串珠霉菌()、链格孢菌()、拟茎点霉()、烟草炭疽菌()、立枯丝核菌()、葡萄座腔菌()、灰葡萄孢菌(),以及烟草品种(中烟100)均由河南省农业科学院烟草研究所菌源库和种质资源库提供。
1.1.3 供试培养基
PDA培养基用于菌株的培养和保存;PDB培养基同PDA培养基(不含琼脂),用于菌株发酵液的制备。有机磷培养基:葡萄糖10.0 g/L,(NH4)2SO40.5 g/L,NaCl 0.3 g/L,MgSO40.3 g/L,MnSO40.03 g/L,K2SO40.3 g/L,FeSO40.03 g/L,Ca3(PO4)25.0 g/L,卵磷脂0.2 g/L,琼脂15.0 g/L,pH 7.0~7.5,用于解有机磷活性测定;无机磷培养基同有机磷培养基(不含卵磷脂),用于解无机磷活性测定。固氮培养基:KH2PO40.2 g/L,MgSO40.2 g/L,NaCl 0.2 g/L,CaCO35.0 g/L,CaSO40.1 g/L,甘露醇10.0 g/L,琼脂15.0 g/L,pH 6.9~7.1,用于固氮活性测定。嗜铁素培养基:铬天青S(CAS)60.5 mg/L,十六烷基三甲基溴化铵(HDTMA)72.9 mg/L,FeCl3•6H2O 2.645 mg/L,NaH2PO4•2H2O 295.25 mg/L,Na2HPO4•12H2O 1213.5 mg/L,NH4Cl 125.0 mg/L,KH2PO437.5 mg/L,NaCl 62.5 mg/L,琼脂9.0 g/L,pH 6.7~6.9,用于产嗜铁素活性测定。解钾硅酸盐培养基:蔗糖5.0 g/L,MgSO40.5 g/L,CaCO30.1 g/L,Na2HPO42.0 g/L,FeCl30.005 g/L,玻璃粉1.0 g/L,琼脂15.0 g/L,pH 6.9~7.1,用于解钾硅酸盐活性测定。蛋白酶培养基、纤维素水解培养基、几丁质酶培养基和淀粉水解培养基用于水解酶活性测定[14]。
1.1.4 其它材料
供试烟草育苗基质为普通市售,购自于许昌科宏工贸有限公司,灭菌后用于育苗和盆栽试验。70%甲基硫菌灵(Thiophanate-Methyl)可湿性粉剂(WP)购自于山东省青岛奥迪斯生物科技有限公司。
1.2 试验方法
1.2.1 拮抗菌株的分离筛选
采用稀释涂布平板法在PDA培养基上分离拮抗真菌[15],纯化后保存于4℃冰箱。并以尖孢镰刀菌为靶标,采用平板对峙培养法[16]进行初筛,在距离平板中心2.5 cm的对称位置上分别接种5 mm已纯化的拮抗真菌和病原菌菌饼,以只接种病原菌菌饼为对照,重复3次,25℃恒温倒置培养6~8 d,测量病原菌落半径并计算抑菌率。拮抗菌的复筛及木霉菌拮抗系数分级标准参考文献[17]。

1.2.2 拮抗菌株的鉴定
参照《真菌鉴定手册》[18],光学显微镜下观察菌丝形态、产孢方式,子实体形态、大小、颜色等特征,初步确定菌株的分类地位。
参照文献[17]提取基因组DNA(生工生物工程(上海)股份有限公司,试剂盒编号:SK8259),以通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增真菌rDNA-ITS片段,扩增产物经纯化回收(生工生物工程(上海)股份有限公司,试剂盒编号:SK8131)后测序。测序结果在Gene Bank数据库进行BLAST比对,选取同源性较高的rDNA-ITS基因序列作为参比对象,运用MEGA 7.0构建系统发育树。
1.2.3 拮抗木霉菌的抑菌谱测定
采用平板对峙培养法测定拮抗木霉菌对9种烟草病原菌的抑菌谱。其中立枯丝核菌和灰葡萄孢菌需培养3 d,烟草疫霉菌、拟茎点霉和葡萄座腔菌需培养4 d,烟草炭疽菌培养5 d,烟草茄病镰刀菌培养8 d,链格孢菌培养11 d,根串珠霉菌培养14 d,并计算抑菌率。
1.2.4 拮抗木霉菌对种子促生及根系活力的测定
采用培养皿滤纸保湿法[17]测定对烟草种子萌发及生长的影响,方法略有改动,种子经孢子悬浮液(1×107孢子/mL)浸种16 h后,整齐摆放在铺有灭菌沙子和滤纸保湿的培养皿中,以无菌水浸种为空白对照,每皿25粒(5×5),重复3次,第14 d统计种子萌发率、烟苗根长、茎长和总长(以种子生长节点区分根长和茎长,总长为根长与茎长之和),并计算相较于空白对照组的增长率。

灭菌基质与拮抗菌发酵液(5×107孢子/mL)按质量体积比10:1均匀混合,采用漂浮育苗法播种育苗(7×10孔),以等体积PDB培养基混拌基质为空白对照,重复3次,期间温度与水肥管理一致,第43 d采用氯化三苯基四氮唑(TTC)法[19]测定根系活力。
1.2.5 拮抗木霉菌对烟草促生作用测定
采用温室盆栽法,参照文献[20],温度(26±0.5)℃、相对湿度50%~60%、光暗周期12L/12D,选择40 d苗龄长势一致的烟苗进行移栽,缓苗后每株灌根20 mL拮抗菌发酵液(5×107孢子/mL),每处理10株,重复3次,共灌根2次,间隔10 d,以等体积PDB培养基灌根为空白对照,期间温度与水肥管理一致,30 d后根据烟草行业标准:烟草农艺性状调查测量方法(YC/T142—2010)测量烟株农艺性状,并计算最大叶的叶面积。
叶面积(cm2)=0.6345×叶长(cm)×叶宽(cm)
1.2.6 拮抗木霉菌的促生能力及水解酶活性测定
参照文献方法定性检测菌株的促生能力和部分水解酶活性,包括产IAA能力[21]、解磷能力[14]、固氮能力[14]、解钾能力[22]、产NH3能力[22]、产嗜铁素活性[14]、产蛋白酶活性[14]、产纤维素酶活性[14]、产几丁质酶活性[14]、产淀粉酶活性[23]。
秸秆制取生物柴油由于其成本和技术的因素,不能完全取代石油燃料,因此对于该技术的反应机理、反应设备及生物油的应用技术应当投入更大的精力进行深入研究[51-52]。在制取过程中,秸秆前期改性水解是一个重要环节,如何提高其转化率以及降低成本是主要的考虑因素,必须经过预处理和水解过程破坏木质素的缠绕作用与纤维素的结晶结构,使其在溶剂、催化剂或酶的作用下进行水解。通过大量的研究工作,目前采用新型工艺超(亚)临界预处理与水解技术,将会为利用秸秆转化制取乙醇技术提供重要的理论依据和应用前景[53]。
1.2.7 拮抗木霉菌的防效测定
采用盆栽试验法,参照文献[24-25],选择60 d苗龄长势一致的烟苗进行移栽,缓苗后每株灌根20 mL拮抗菌发酵液(5×107孢子/mL),3 d后每盆接种20 g烟草尖孢镰刀菌麦粒培养物(打取新鲜的菌丝块,接种于高温灭菌过的麦粒培养基,28℃培养7 d,制成带菌麦粒培养物),施足水后,(28±0.5)℃保湿培养、光暗周期12L/12D,10 d后再次灌根,每处理10株,重复3次,以不接病菌为阴性对照(CK1),以只接种病菌为阳性对照(CK2),以阳性对照组盆栽均出现典型的矮小萎蔫、根部坏死症状为标准,在接种病原20 d时以株为单位,按照烟草国家标准:烟草病虫害分级及调查方法(GB/T23222—2008)调查病害发生情况,并计算发病率、病情指数和相对防效。

1.3 数据统计与分析
采用MEGA 7.0软件的Neighbor-Joining法构建系统发育树;采用Excel 2010软件对数据进行统计处理;采用DPS 7.05软件进行差异显著性检验,采用Duncan新复极差法进行多重比较。
2 结果
2.1 拮抗真菌的分离筛选
26份土样中,共分离纯化真菌371株,其中有明显抑菌效果的拮抗菌株38株,抑菌率均在70%以上,菌株PDSLS0101(分离自平顶山市鲁山县烟田)、NYZP0201(分离自南阳市镇平县烟田)和LYRY0207(分离自洛阳市汝阳县烟田)的抑菌效果最好,抑菌率分别为91.24%、84.71%和82.48%(表1)。复筛结果表明,增加拮抗菌的接种量可以明显提高菌株PDSLS0101和NYZP0201的抑菌效果,说明增加使用量可以更好地发挥空间竞争作用;菌株PDSLS0101能够覆盖上病原菌的菌落,说明其能够重寄生该病原菌(图1)。
表1 拮抗菌株对烟草尖孢镰刀菌的平板抑制效果

Tab.1 Plate inhibitory effect of antagonistic strains on F. oxysporum in tobacco
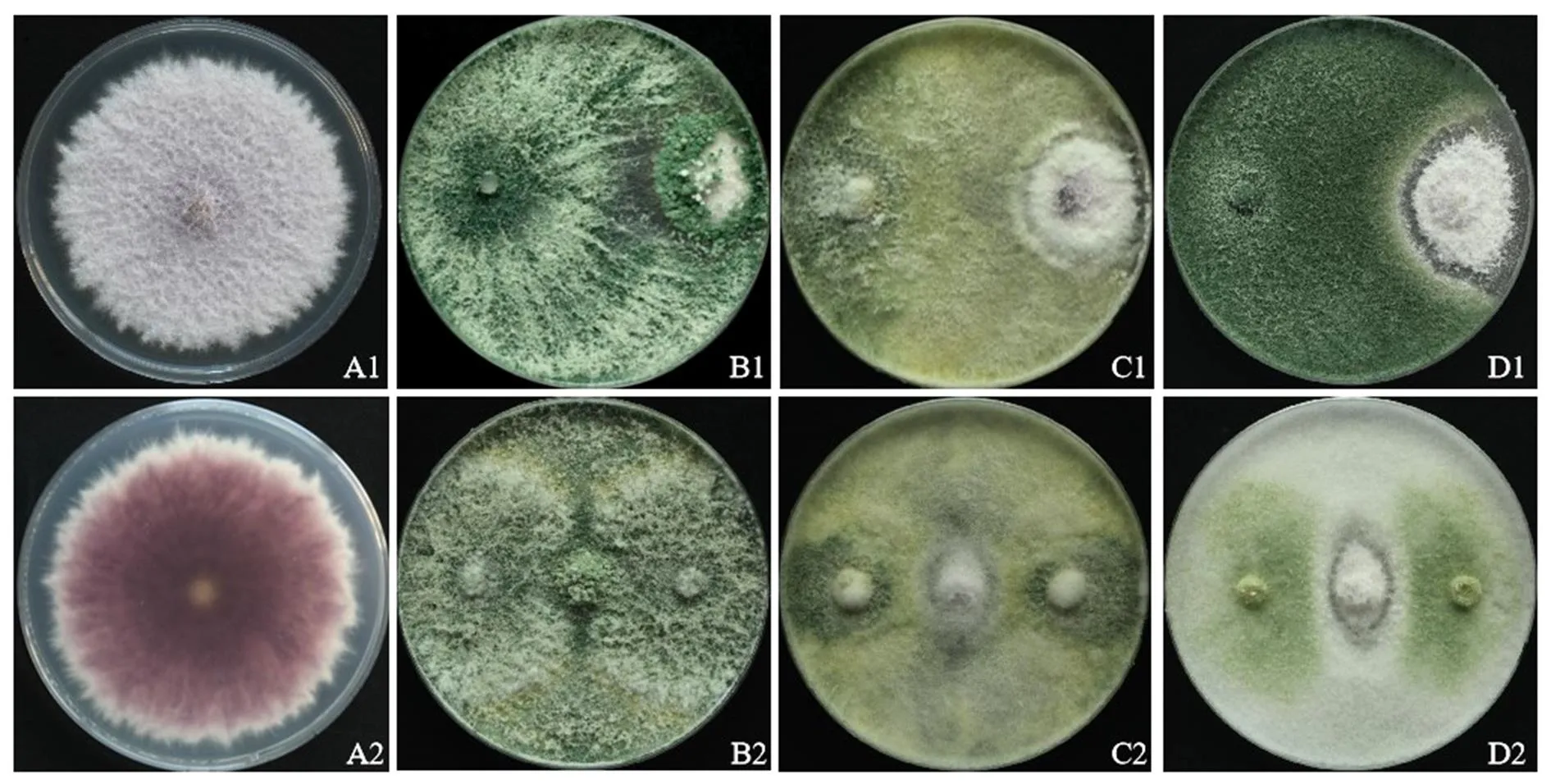
注:A1、A2为病原菌正反面; B1、C1和D1为菌株PDSLS0101、NYZP0201和LYRY0207的初筛抑制效果;B2、C2和D2为复筛抑制效果。
2.2 拮抗真菌的鉴定
2.2.1 形态学鉴定
如图2所示,3株拮抗真菌培养3 d时菌丝已布满整个平板,6 d时均有明显的产孢,具有较好的生长繁殖和空间竞争能力。菌株PDSLS0101气生菌丝茂盛棉絮状,菌落背面浅绿色至绿色;分生孢子梗细长弯曲安瓿状,次级分枝对生,分生孢子球形、近球形,浅绿色。菌株NYZP0201菌丝纤细无色,具分隔,多分枝,菌落初为白絮状、灰绿色,菌落背面后期黄绿色;分生孢子梗对生或互生,分生孢子的小梗瓶形或锥形,分生孢子多为球形、近球形,蓝绿色。菌株LYRY0207气生菌丝卷毛状,产孢簇同心轮纹状分布,菌落后期形成明显的同心环,背面浅绿色;分生孢子梗对生或轮状互生,分枝较短,瓶梗粗大安瓿型,分生孢子椭圆形,浅绿色。初步将3株拮抗真菌鉴定为木霉属(spp.)。

注:A、B和C为PDSLS0101、NYZP0201和LYRY0207菌株;1、2:3d和6d的菌落形态;3:子实体;4:分生孢子。
2.2.2 分子生物学鉴定
通过扩增3株木霉菌PDSLS0101、NYZP0201和LYRY0207的基因组ITS区段序列,得到大小为600 bp左右的特异性条带,测序结果显示序列有效长度为608 bp、598 bp和626 bp。Blast比对分析并构建系统发育树,发现菌株PDSLS0101与upm13(MK027316)同源相似性为99.67%,且位于同一进化分支,并命名为Ta-0101;菌株NYZP0201与CRC32(MK738148)同源相似性为100.00%,且位于同一进化分支,命名为Th-0201;菌株LYRY0207与TVEPSk68(MH651384)同源相似性为99.18%,且位于同一进化分支,命名为Tv-0207(图3)。结合形态学鉴定结果将菌株Ta-0101鉴定为棘孢木霉,菌株Th-0201鉴定为哈茨木霉,菌株Tv-0207鉴定为毛簇木霉。

图3 基于rDNA-ITS基因序列构建的系统发育树
2.3 拮抗木霉菌抑菌谱的测定
平板对峙培养法结果表明,3株木霉菌对9种烟草病原菌均有不同程度的抑制作用(图4),抑菌率介于35.42%~92.00%(表2),表明3株木霉菌具有非常好的抑菌广谱性。其中对根串珠霉菌的抑菌效果最显著,抑菌率介于88.23%~92.00%,拮抗系数均为Ⅰ级。
表2 3株拮抗木霉菌对常见烟草病原菌的抑制作用

Tab.2 Inhibition effects of 3 antagonistic Trichoderma spp. strains on common tobacco pathogens

图4 3株拮抗木霉菌对常见烟草病原菌的平板抑制效果
2.4 拮抗木霉菌对烟草种子促生及根系活力的影响
培养皿滤纸保湿法结果显示(表3),3株木霉菌浸种处理的萌发率和茎长均高于空白对照组,以Ta-0101处理结果最显著;3株木霉菌浸种处理的根长和总长明显长于空白对照组,且都达到极显著差异水平。图5所示,漂浮育苗中3株木霉菌处理的根系活力均显著高于空白对照组,棘孢木霉Ta-0101、哈茨木霉Th-0201和毛簇木霉Tv-0207处理的根系活力分别高出对照组99.53%、74.72%和84.03%,具有较好的根系促生作用。
表3 拮抗木霉菌孢子悬浮液浸种对种子萌发及生长的影响

Tab.3 Effects of seed soaking in spore suspension of antagonistic Trichoderma spp. strains on seed germination and growth
注:每列每个处理中不同小写字母之间表示处理间差异有统计学意义(<0.05),大写字母(<0.01)。下同。
Note: Different lowercase letters in each column and each treatment indicate statistically significant differences between treatments (<0.05), and uppercase letters (<0.01). The same as below.

图5 拮抗木霉菌发酵液对烟苗根系活力的影响
2.5 拮抗木霉菌对烟株生长发育的影响
由表4可知,木霉菌处理与空白对照组相比,在各农艺性状指标上均有较好的促进作用,处理组的烟株长势均衡,叶片结构紧密,根系发达。棘孢木霉Ta-0101处理的烟株各农艺性状指标均显著高于空白对照组,其中最大叶面积增加56.55%,地上部鲜重提高136.69%,根系鲜重提高140.28%。
表4 拮抗木霉菌发酵液对盆栽烟草的促生效果
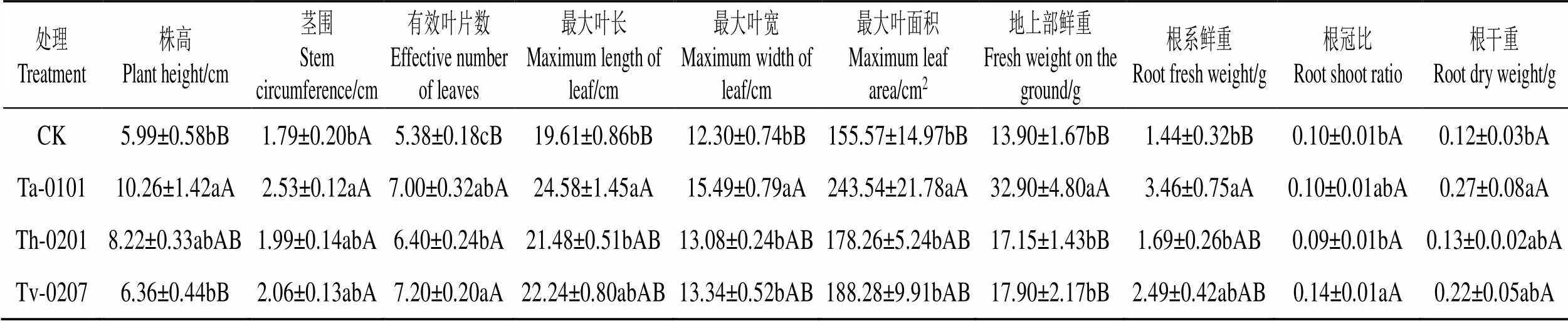
Tab.4 Growth-promoting effect of antagonistic Trichoderma spp. strains fermentation broth on potted tobacco
2.6 拮抗木霉菌的促生能力及产酶活性测定
促生能力及产酶活性测定结果表明,3株木霉菌均可以产生NH3,不产生IAA,能在有机磷和无机磷培养基上很好地生长,在固氮培养基和解钾硅酸盐培养基上菌丝稀疏,产孢量较少呈点状分布,具有产嗜铁素、产蛋白酶和解淀粉酶活性,无解纤维素酶和几丁质酶活性(表5)。以上结果初步表明,3株木霉菌均有一定的促生能力和水解酶活性,与种子及促生试验结果相印证,且促生能力不是通过产IAA引起的。
表5 拮抗木霉菌的促生潜力及产酶活性
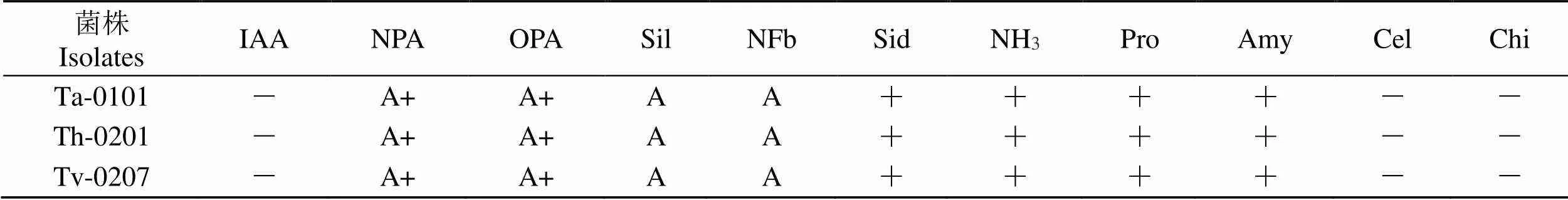
Tab.5 The growth-promoting potential and enzyme-producing activity of antagonizing Trichoderma spp. strains
注:IAA:产IAA;NPA:解无机磷;OPA:解有机磷;NFb:固氮;Sil:解钾硅酸盐;NH3:产氨;Sid:产噬铁素;Pro:产蛋白酶;Amy:产淀粉酶;Cel:产纤维素酶;Chi:产几丁质酶;+:阳性;-:阴性;A:可以生长;A+:生长良好。
Note: IAA: auxin production; NPA: inorganic phosphorus solution; OPA: organic phosphorus solution; NFb: nitrogen fixation solution; Sil: potassium silicate solution; NH3: ammonia production; Sid: iron phagocytosis; Pro: protease production; Amy: amylase production; Cel: cellulases production;Chi: chitinases production; +: positive; -: negative; A: growth; A+: good growth.
2.7 拮抗木霉菌对烟草尖孢镰刀菌的防治效果
由表6可知,3株木霉菌发酵液和70%甲基硫菌灵处理的较阳性对照组(CK2)发病轻,病情指数显著低于阳性对照组。不同木霉菌处理组根系被侵染程度明显较轻,比阴性对照组(CK1)矮小黄化,根系不同程度受损(图6)。表明3株木霉菌对烟草尖孢镰刀菌具有较好的防治效果。
表6 拮抗木霉菌发酵液对烟草尖孢镰刀菌的盆栽防治效果

Tab.6 Disease control effect of antagonistic Trichoderma spp. strains fermentation broth on F. oxysporum in potted tobacco plants

图6 拮抗木霉菌发酵液对盆栽防效根系的影响
3 讨论
木霉菌用于防治植物病害的研究报道较多,但用于防治烟草镰刀菌的研究较少。田艳艳等[26]筛选的棘孢木霉、哈茨木霉和毛簇木霉对烟草尖孢镰刀菌有较好的抑制效果,平板抑菌率在70.31%~80.95%,与本研究所报道的木霉菌对尖孢镰刀菌的抑菌效果相当。本课题组之前的研究发现棘孢木霉Tr-0111对烟草镰刀菌具有较好的抑菌效果和一定的促生作用[17]。相比而言,本研究发现的棘孢木霉Ta-0101、哈茨木霉Th-0201和毛簇木霉Tv-0207抑菌能力不同,促生效果更好。同时,本研究系统研究了3株木霉菌对烟草尖孢镰刀菌的抑菌能力、促生潜力、菌株的功能性以及盆栽防效,揭示了它们的抑菌效能和促生防病效果。
有些木霉菌株可以稳定地定殖在植株根部,改善植物新陈代谢、促进植物生长、提高作物产量[27-28]。但关于生防菌的促生机制尚未完全明确,主要包括产吲哚乙酸、赤霉素、嗜铁素、抗生素等植物生长调节物质,以及溶解磷矿物和其它养分的能力,抑制或降解根际有害物质等[22,27]。宋玉娟等[24]报道棘孢木霉T-6能够促进烟株生长,提高对烟草黑胫病和根黑腐的抗性。李艳娟等[29]发现哈茨木霉能显著促进杉木种子萌发和幼苗生长,提高幼苗抗逆性和抗氧化酶活性。潘宣圳等[30]报道毛簇木霉Lj具有拮抗杨树烂皮病菌并促进小白菜生长的功能。本研究的3株木霉菌均能促进烟草种子萌发和根系生长,烟草的各项指标均有明显地提高,但影响试验的因素较多,需要对施用量和施用次数等进一步优化。虽然定性测定了3株木霉菌的部分促生能力和水解酶活性,但关于木霉菌细胞学、分子生物学、基因组学及病原-微生物-寄主植物间互作机理的研究,尚需深入完善,这也是木霉菌促生作用机制研究的重点和难点。
4 结论
本研究筛选、鉴定的棘孢木霉Ta-0101、哈茨木霉Th-0201和毛簇木霉Tv-0207抑菌谱广,对烟草镰刀菌具有较强的抑菌效果;具有一定的水解酶活性,显著提高了根系活力;室内盆栽促生、防病效果明显,具有较好的应用潜力。
[1] XIA Zhenyuan, MO Xiaohan. Occurrence of blackleg disease of tobacco caused bysubsp.in China[J]. Plant Pathology, 2007, 56(2): 348.
[2] 袁维,谭海文,卢燕回,等. 烟草侵染性病害种类变迁及其发生概况[J]. 安徽农业科学,2016, 44(4): 165-167.
YUAN Wei, TAN Haiwen, LU Yanhui, et al. Specie changes and occurrence overviews of infectious diseases on tobacco[J]. Journal of Anhui Agricultural Sciences, 2016, 44(4): 165-167.
[3] 桑维钧,祝明亮,吴兴禄,等. 烟草镰刀菌根腐病研究初报[J]. 山地农业生物学报,1998, 17(3): 140-141, 145.
SANG Weijun, ZHU Mingliang, WU Xinglu, et al. A preliminary report of tobacco root rot caused bysp.[J]. Journal of Mountain Agriculture and Biology, 1998, 17(3): 140-141, 145.
[4] 刘利佳,李芳芳,何雷,等. 烟草镰刀菌根腐病病原菌的鉴定及其对5种杀菌剂的敏感性分析[J]. 河南农业科学,2021, 50(7): 101-109.
LIU Lijia, LI Fangfang, HE Lei, et al. Pathogen identification of tobaccoroot rot and its sensitivity to five fungicides[J]. Journal of Henan Agricultural Sciences, 2021, 50(7): 101-109.
[5] 田艳艳,王伟杰,苗圃,等. 河南烟草镰刀菌的初步分子鉴定[J]. 烟草科技,2014(11): 89-92.
TIAN Yanyan, WANG Weijie, MIAO Pu, et al. Preliminary molecular identification ofinfecting tobacco in Henan[J]. Tobacco Science and Technology, 2014(11): 89-92.
[6] 李博. 烟草镰刀菌根腐病发生相关根际微生物分析及生防菌筛选[D]. 郑州:河南农业大学,2020.
LI Bo. Analysis of rhizosphere microorganisms associated with tobaccoroot rot and screening of biocontrol microorganism[D]. Zhengzhou: Henan Agricultural University, 2020.
[7] 张嘉城,方香玲,南志标. 植物病原镰刀菌产生的毒素种类及其危害[J]. 草业科学,2021, 38(8): 1513-1524.
ZHANG Jiacheng, FANG Xiangling, NAN Zhibiao. Types and effects of toxins produced by plant pathogenic fungi[J]. Pratacultural Science, 2021, 38(8): 1513-1524.
[8] 李明,周本国. 不同药剂防治烟蚜及烟草黑胫病田间试验[J]. 安徽农业科学,2002, 30(4): 572-573.
LI Ming, ZHOU Benguo. Field trials of different chemicals for controllingand[J]. Journal of Anhui Agricultural Sciences, 2002, 30(4): 572-573.
[9] BORTOLUZZI E C, RHEINHEIMER D S, GONCALVES C S, et al. Investigation of the occurrence of pesticide residues in rural wells and surface water following application to tobacco[J]. Química Nova, 2007, 30(8): 1872-1876.
[10] CARSEL R F, NIXON W B, BALLANTLNE L G. Comparison of pesticide root zone model predictions with observed concentrations for the tobacco pesticide metalaxyl in unsaturated zone soils[J]. Environmental Toxicology and Chemistry, 2010, 5(4): 345-353.
[11] 于文清,丁洪胜,闫凤超,等. 植物根际促生菌促生及御病研究进展[J]. 现代化农业,2020(8): 53-56.
YU Wenqing, DING Hongsheng, YAN Fengchao, et al. Research progress in promoting growth and controlling diseases of rhizosphere probiotics[J]. Modern Agriculture, 2020(8): 53-56.
[12] 胡江春,薛德林,马成新,等. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报,2004, 15(10): 1963-1966.
HU Jiangchun, XUE Delin, MA Chengxin, et al. Research advances in plant growth-promoting rhizobacteria and its application prospects[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1963-1966.
[13] 屈佳欣,方香玲. 植物病原真菌镰刀菌孢子形成与萌发机理研究进展[J]. 中国草地学报,2021, 43(8): 106-113.
QU Jiaxin, FANG Xiangling. Research progress on the spore formation and germination mechanism of plant pathogenic fungus[J]. Chinese Journal of Grassland, 2021, 43(8): 106-113.
[14] 杨敬辉,文平兰,庄义庆. 颉颃细菌的筛选及生防潜能评估[J]. 西南农业学报,2013, 26(2): 565-571.
YANG Jinghui, WEN Pinglan, ZHUANG Yiqing. Screening of antagonistic bacteria and potential biocontrol evaluation[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(2): 565-571.
[15] NIEMANN H, LÖSEKANN T, BEER D D, et al. Novel microbial communities of the Haakon Mosby mud volcano and their role as a methane sink[J]. Nature, 2006, 443 (7113) :854.
[16] 方中达. 植病研究方法[M]. 3版. 北京:中国农业出版社,1998: 46-47.
FANG Zhongda. Methods of plant disease research[M]. Third Edition. Beijing: China Agricultural Press, 1998: 46-47.
[17] 姚晨虓,李小杰,李琦,等. 烟草尖孢镰刀菌拮抗真菌的筛选鉴定及促生作用研究[J]. 中国生物防治学报,2021, 37(5): 1066-1072.
YAO Chenxiao, LI Xiaojie, LI Qi, et al. Screening and identification of antagonistic fungal against tobaccoand growth promotion effect[J]. Chinese Journal of Biological Control, 2021, 37(5): 1066-1072.
[18] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
WEI Jingchao. Handbook of fungi identification[M]. Shanghai: Shanghai Science and Technology Press, 1979.
[19] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000: 207-211.
LI Hesheng. Principles and techniques of plant physiology and biochemistry experiments[M]. Beijing: Higher Education Press, 2000: 207-211.
[20] 罗云艳,安航,何佶弦,等. 烟草根黑腐病根际拮抗菌的筛选、鉴定及其促生防病效果[J]. 中国烟草科学,2021, 42(3): 57-64.
LUO Yunyan, AN Hang, HE Jixian, et al. Screening and identification of antagonistic bacteria againstand their effects on growth and disease prevention[J]. Chinese Tobacco Science, 2021, 42(3): 57-64.
[21] Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796.
[22] 康贻军,程洁,梅丽娟,等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报,2010, 50(7): 853-861.
KANG Yijun, CHENG Jie, MEI Lijuan, et al. Screening and identification of plant growth-promoting rhizobacteria[J]. Acta Microbiologica Sinica, 2010, 50(7): 853-861.
[23] 张林吉,张海涛,李云龙,等. 厨余中产淀粉酶芽孢杆菌的筛选、鉴定及酶学性质研究[J]. 饲料研究,2021, 44(10): 69-73.
ZHANG Linjie, ZHANG Haitao, LI Yunlong, et al. Isolation and identification of amylase producingfrom kitchen waste and its enzymatic properties[J]. Feed Research, 2021, 44(10): 69-73.
[24] 宋玉娟,韩雪莲,张安盛,等. 棘孢木霉T-6对烟草促生及对黑胫病和根黑腐病的抗病作用[J]. 中国烟草科学,2020, 41(1): 50-55.
SONG Yujuan, HAN Xuelian, ZHANG Ansheng, et al. Effects ofT-6 on growth promotion, control of black shank and black root rot in tobacco[J]. Chinese Tobacco Science, 2020, 41(1): 50-55.
[25] 邱睿,李芳芳,徐敏,等. 烟草品种对镰刀菌根腐病的抗性鉴定[J]. 中国烟草学报,2019, 25(4): 59-63.
QIU Rui, LI Fangfang, XU Min, et al. Evaluation of resistance toroot rot of selected tobacco varieties[J]. Acta Tabacaria Sinica, 2019, 25(04): 59-63.
[26] 田艳艳,赵世民,李彰,等. 洛阳地区烟田土壤木霉菌的分离鉴定及其拮抗作用测定[J]. 河南农业科学,2015, 44(11): 79-84.
TIAN Yanyan, ZHAO Shimin, LI Zhang, et al. Isolation and identification offrom tobacco growing soil of Luoyang and determination of their inhibition effects[J]. Journal of Henan Agricultural Sciences, 2015, 44(11): 79-84.
[27] 滕安娜. 木霉菌对植物的促生效果及其机理的研究[D]. 济南:山东师范大学,2010.
TENG Anna. Study on the effects and mechanisms ofspp. promoting plant growth[D]. Jinan: Shandong Normal University, 2010.
[28] 张子颖,许家来,李现道,等. 绿色木霉配施高碳基肥料对烤烟生长及经济效益的影响[J]. 中国烟草学报,2016, 22(5): 79-86.
ZHANG Ziying, XU Jialai, LI Xiandao, et al. Effects of applyingalong with high-carbon-based fertilizer on growth and economic benefit of flue-cured tobacco[J]. Acta Tabacaria Sinica, 2016, 22(5): 79-86.
[29] 李艳娟,刘博,庄正,等. 哈茨木霉与绿色木霉对杉木种子萌发和幼苗生长的影响[J]. 应用生态学报,2017, 28(9): 2961-2966.
LI Yanjuan, LIU Bo, ZHUANG Zheng, et al. Effects ofandon seed germination and seeding growth of Chinese fir[J]. Chinese Journal of Applied Ecology, 2017, 28(9): 2961-2966.
[30] 潘宣圳,曾晓春,刘伟璐,等. 1株木霉的分离鉴定及抑菌和植物促生作用[J]. 东北林业大学学报,2018, 46(7): 73-78.
PAN Xuanzhen, ZENG Xiaochun, LIU Weilu, et al. Isolation, identification, antifungal effect and plant growth promotion of astrain[J]. Journal of Northeast Forestry University, 2018, 46(7): 73-78.
Screening and identification of three strains ofspp. antagonizingand evaluation of their effects on promoting growth and disease control
YAO Chenxiao1,2, LI Xiaojie2, LIU Chang2, QIU Rui2, BAI Jingke2, XU Min3, CHEN Yuguo2, KANG Yebin1, LI Shujun2*
1 Horticulture and Plant Protection College, Henan University of Science and Technology, Luoyang 471023, China;2 Key Laboratory for Green Preservation & Control of Tobacco Diseases and Pests in Huanghuai Growing Area/Tobacco Research Institute of Henan Academy of Agricultural Sciences, Xuchang 461000, China;3 Henan Provincial Tobacco Company, Zhengzhou 450018, China
This study aims to screen out the strains with good antagonistic effects on tobaccoroot rot.The fungal strains with antagonistic effect onwere isolated and purified from the rhizosphere soil of healthy tobacco plants in the main tobacco leaf producing areas of Henan Province. The selected antagonistic strains were identified by morphological and molecular biological, and their growth-promoting and disease-control effects were determined.The three strains ofspp. with strong antibacterial ability were identified asTa-0101,Th-0201 andTv-0207. Their plate inhibition rates againstreached 91.24%, 84.71% and 82.48%, respectively. The three strains ofspp. had significant growth-promoting effects on the underground root length and total length of tobacco seeds, and the growth rate of tobacco seedling root length was 28.89%, 25.92% and 22.22%, respectively. The root vitality of tobacco seedlings was also significantly higher than that of the blank control group. Their growth-promoting effects on the maximum leaf area and fresh weight of tobacco plants were obvious, in particular the growth-promoting effect ofTa-0101 was the most significant. The pot experiments showed that the relative disease control rates of threespp. strains againstwere 78.95%, 69.73% and 69.73%, which were all higher than the disease control rateof 70% thiophanate-methyl treated with 1000 times solution.The three antagonisticstrains have good bacteriostatic efficacy, growth-promoting and disease-preventing effects, showing great application prospects.
Tobacco;spp.; inhibitory effect; growth promotion; control effect
Corresponding author. Email:lishujun9396@126.com
河南省烟草公司科技项目“烟草根腐病害发生的微生物群落分析和生态风险预警研究”(2020410000270012);河南省农业科学院烟草绿色植保创新团队“烟草主要病虫害绿色防控关键技术研究与应用”(2022TD26)
姚晨虓(1998—),硕士研究生,主要研究方向为烟草植保,Tel:0374-4518504,E-mail:18438615892@163.com
通信作者:李淑君(1966—),研究员,研究方向为烟草植保,Tel:0374-4511016,E-mail:lishujun9396@126.com
2021-12-02;
2022-04-21
姚晨虓,李小杰,刘畅,等. 3株拮抗烟草尖孢镰刀菌的木霉菌筛选鉴定及促生防病效果评价[J]. 中国烟草学报,2022,28(4). YAO Chenxiao, LI Xiaojie, LIU Chang, et al. Screening and identification of three strains of Trichoderma spp. antagonizing Fusarium oxysporum and evaluation of their effects on promoting growth and disease control[J]. Acta Tabacaria Sinica, 2022, 28(4). doi: 10. 16472/j.chinatobacco.2021.T0224
