烟草根黑腐病抗性位点RBRR1的InDel分子标记开发与分析
2022-09-02冯智宇陈学军盖晓彤姜宁焦芳婵吴兴富童治军刘天彦杨林明许美玲李永平
冯智宇,陈学军,盖晓彤,姜宁,焦芳婵,吴兴富,童治军,刘天彦,杨林明,许美玲,李永平*
生物技术
烟草根黑腐病抗性位点的InDel分子标记开发与分析
冯智宇1,陈学军1,盖晓彤1,姜宁1,焦芳婵1,吴兴富1,童治军1,刘天彦2,杨林明2,许美玲1,李永平1*
1云南省烟草农业科学研究院,云南省昆明市五华区圆通街33号,650021;2云南省烟草公司曲靖市公司,云南省曲靖市麒麟区玄天路51号,655099
【背景和目的】是通过远缘杂交与回交导入栽培烟草的一个单显性广谱型根黑腐病抗病位点,为了开发基于该位点的简单高效稳定且成本低的紧密连锁分子标记。【方法】在已有酶切扩增多态性序列(Cleaved amplified polymorphism sequences, CAPS)标记相关序列基础上,利用云晒1号基因组与抗、感根黑腐病材料重测序信息,基于其序列插入/缺失(Insertion/Deletion, InDel)多态性设计抗病相关分子标记,并开展遗传效应和遗传变异分析。【结果】筛选到4对具有良好多态性的引物,在目标单株的分子标记辅助选择中具备便捷、高效且呈共显性的特点。遗传效应分析表明,通过分子标记辅助选择导入位点能够极显著提高栽培烟草根黑腐病抗性。遗传变异分析结果显示,在烟草核心种质资源中仅有白肋烟TN90和SoTa2携带有抗病基因,并发现4对引物在普通烟草自然群体中呈现2种基因型。【结论】抗病位点在我国尚未进行广泛利用,具有较高的利用价值;而开发的4个InDel标记可用于该抗性位点的分子标记辅助选择育种和后续抗病基因的精细定位与克隆。
烟草;根黑腐;根串珠霉菌;分子标记辅助选择;InDel标记
烟草根黑腐病(Black root rot, BRR)是由土壤真菌根串珠霉菌()引起的一种常见土传病害[1]。该病害在世界主要烟叶产区广泛分 布[2-3],在我国云南、贵州等烟叶主产区均有发生[4-5]。烟草根黑腐病的特征是烟草根和幼茎基部等部位出现黑色病变,进而导致烟草营养缺乏、发育迟缓,严重时出现倒伏、死亡,或导致成株期植株矮化、长势不均匀、叶片皱缩或萎蔫、成熟期推迟,从而严重影响烟草产量和质量[1,6]。尽管轮作及施用化学药剂能有效防控根黑腐病,但增加了烟草种植成本且易造成环境污染[7],故选育并种植抗根黑腐病品种是一种经济有效且可持续的防治策略。
迪勃纳氏烟草(i,2n = 4x = 48)是源于澳大利亚的一种野生烟草,它不仅是研究杂交特性的理想材料,而且携带烟草根黑腐病、霜霉病和白粉病等多种病害抗性基因,已成为烟草抗病性状改良的有效遗传资源[8-9]。通过种间杂交和回交,迪勃纳氏烟草根黑腐病的显性抗病基因已成功被转育到白肋烟与烤烟等栽培烟草中[10-11]。例如,Tennessee 90(TN90)是美国田纳西州立大学用Burley49和PVY202杂交选育而成的优良品种,对烟草普通花叶病毒病(, TMV)、烟草脉斑驳病毒病(, TVMV)、烟草蚀纹病毒病(, TEV)、马铃薯Y病毒(Y, PVY)、烟草野火病()、烟草根黑腐病等多种病害表现明显抗性;其中,TN90的根黑腐抗性(基因)从品种Burley49继承而来,而Burley49的原始抗性供体是迪勃纳氏烟草[11-12]。前人研究发现对烟草根黑腐病具有完全抗性,并在烟草各生育阶段均对根串珠霉菌具有较高的免疫能力[11,13]。通过基因分型测序(genotyping-by-sequencing, GBS)方法,烟草抗性位点已被定位在烟草17号染色体(K326参考基因组)上,SS219555和SS192650是与其共分离的共显性酶切扩增多态性序列(Cleaved amplified polymorphism sequences, CAPS)标记[14]。然而,CAPS标记必须使用限制性内切酶,需要较冗长的分析步骤,增加了CAPS标记的使用成本和实验难度,并受限于酶切效率不能适应高通量自动化检测[15];此外,各种突变会引起酶切位点的增加或消失,极大限制了两个分子标记在分子标记辅助选择育种(Molecular marker assisted selection, MAS)中的应用。因此,开发一种方便检测且能适应高通量要求的根黑腐病抗性分子标记,是开展烟草根黑腐病品种选育的迫切需求。
本文基于与连锁的CAPS标记的引物序列,以云晒1号(G306)基因组为参考,锚定了抗病位点的物理区间;又通过对携带抗病基因材料TN90和感病材料云烟87的重测序数据的遗传差异分析,开发并筛选获得了方便检测的插入/缺失(Insertion/Deletion, InDel)分子标记。随后,利用这些分子标记进行了标记辅助抗病选育,鉴定了抗病位点导入的遗传效应,并分析了位点在烟草核心种质资源中的分布,为下一步开展烤烟抗根黑腐病品种选育及基因的克隆奠定了基础。
1 材料与方法
1.1 材料
所用材料为携带有抗性位点的普通烟草TN90与烤烟主栽品种云烟87。前期研究中,以TN90为供体亲本、以云烟87为受体亲本,通过连续回交获得了74个BC3F1单株产生的74份BC3F2种子,作为74个BC3F1:2家系。从这些家系中发现14个家系含有抗病位点,选取一个含有抗病位点的TN90/云烟87衍生的BC3F2群体用于新开发/转化标记的验证,并结合分子标记辅助选育方法筛选BC3F2群体中纯合抗性位点基因型和纯合感病基因型单株用于抗性表型鉴定。以337份不同烟草类型种质资源为研究材料分析抗性位点的等位基因频率分布。两份亲本材料和337份种质资源来源于云南省烟草农业科学研究院种质库。
病原菌根串珠霉菌()由西南大学植物保护学院窦彦霞老师提供[1,16]。
1.2 引物设计及优化
前人已测序获得了根黑腐病抗病和感病材料中SS219555和SS192650标记所在位点的扩增序列[14],据此研究结果,利用软件DNAMan(Version 9.0.1.116)分别对每个标记所在位点抗、感材料中的等位序列进行序列对比分析,根据序列的插入缺失(InDel)差异设计开发标记,将两个共分离CAPS标记转化成免酶切的InDel类型标记。
前期研究中已获取了云晒1号(G306)的基因组序列和普通烟草TN90和云烟87的重测序序列(尚未发表)。本文以云晒1号为参考序列,通过BLAST方法锚定SS219555和SS192650标记之间的物理区段,并分析TN90和云烟87重测序数据以获取两者之间的序列差异信息。随后,根据两个CAPS标记所在物理区间内的InDel差异位点设计开发标记。
参照吴迷等[17]所述方法进行InDel分子标记开发并稍作改良。具体步骤如下:筛选出插入/缺失大于等于5 bp的InDel位点,提取InDel位点上下游125 bp序列并生成fasta文件,使用BatchPrimer3(v1.0, https:// wheat.pw.usda.gov/demos/BatchPrimer3/)批量设计引物,引物长度范围为18~27 bp,最适长度21 bp,GC含量范围在40%~60%之间,扩增片段150~200 bp,最优扩增片段180 bp。对返回的设计结果进行检查和手动调整。为了提高特异性,本文对BRR_LG2_InD-5标记进行PCR扩增测序和引物设计优化。
为了丰富抗病位点的检测方式以满足不同育种科技工作者的需求,基于本研究所获InDel标记只有2种基因型的特点,结合云烟87和TN90的重测序数据,靶向InDel标记在双亲中扩增序列的序列差异之处,设计TN90序列特异的引物,将部分InDel共显性标记转化为显性标记,并对其做了试验验证,共筛选出3个显性标记。
1.3 DNA提取、PCR扩增和电泳检测
选用植物基因组提取试剂盒(天根生化科技(北京)有限公司)提取供试材料基因组DNA,具体操作步骤按说明书进行。PCR反应体系:2×DreamTaq Green PCR Master Mix(dNTP浓度为0.4 mmol/L, Mg2+(浓度为4 mmol/L)5 μL),正、反引物(2 μmoL/L)各1 μL,DNA模板2 μL(浓度50~100 ng/μL),补充ddH2O到10 μL。PCR程序设置:95℃变性30 s,55℃退火30 s,72℃延伸30 s,设置35个循环,最后72℃延伸5 min。PCR产物用8%的聚丙烯酰胺凝胶或1%的琼脂糖电泳检测。
1.4 烟草根黑腐抗性鉴定
按照Chen等描述的根部扩散法(Root irradiation)进行烟草根黑腐病抗性鉴定[18]。在人工气候室采用灭菌土培养烟草供试材料,设定(30±1)℃/(28±1)℃的日/夜温度、85%~90%的相对湿度以及14 h的光照时间,直至第4片真叶出现。同时,将单孢分离得到的根串珠霉菌()病原菌接种到马铃薯葡萄糖琼脂(Potato dextrose agar, PDA)平板上,在25℃暗箱培养10~15 d,收获分生孢子后,用无菌水配成孢子浓度为107孢子/mL的悬浮液。利用无菌剪刀对四叶期烟苗的茎基两侧根系进行轻微伤害,立即灌根接种20 mL的孢子悬浮液于烟株茎基部,并随后将供试烟苗放置于人工气候室进行培养。在接种后第15 d,第一片枯萎叶片出现时,用清水洗净烟株根系,参照国家标准GB/T 23222—2008进行病害等级鉴定,计算病情指数(disease severity index, DSI)。所有对照处理用灭菌水进行。试验设计采取随机区组设计,共设置3个生物学重复,每个重复每个基因型包含15个单株。每个重复独立计算病情指数。
2 结果与分析
2.1 RBRR1抗性位点共显性分子标记的转化、开发及优化
抗病和感病材料SS219555和SS192650标记所在DNA扩增区段序列对比发现,在SS192650标记位点817 bp的序列区间内共检测到50个单核苷酸多态性(Single-nucleotide polymorphism, SNP)和5个InDel差异位点,其中有2个InDel位点序列差异大于5 bp;在SS219555标记位点629 bp的序列区间内共检测到9个SNP和4个InDel差异位点,其中有2个InDel位点序列差异大于5 bp(图1)。根据SS192650位点和SS219555位点的InDel差异信息分别设计1对和3对引物(图1;表1)。利用含有抗病基因的材料TN90和不含该抗病位点的材料云烟87对引物进行差异分析,其中InD192650和InD219555-3F/3R具有良好的多态性(图2)。
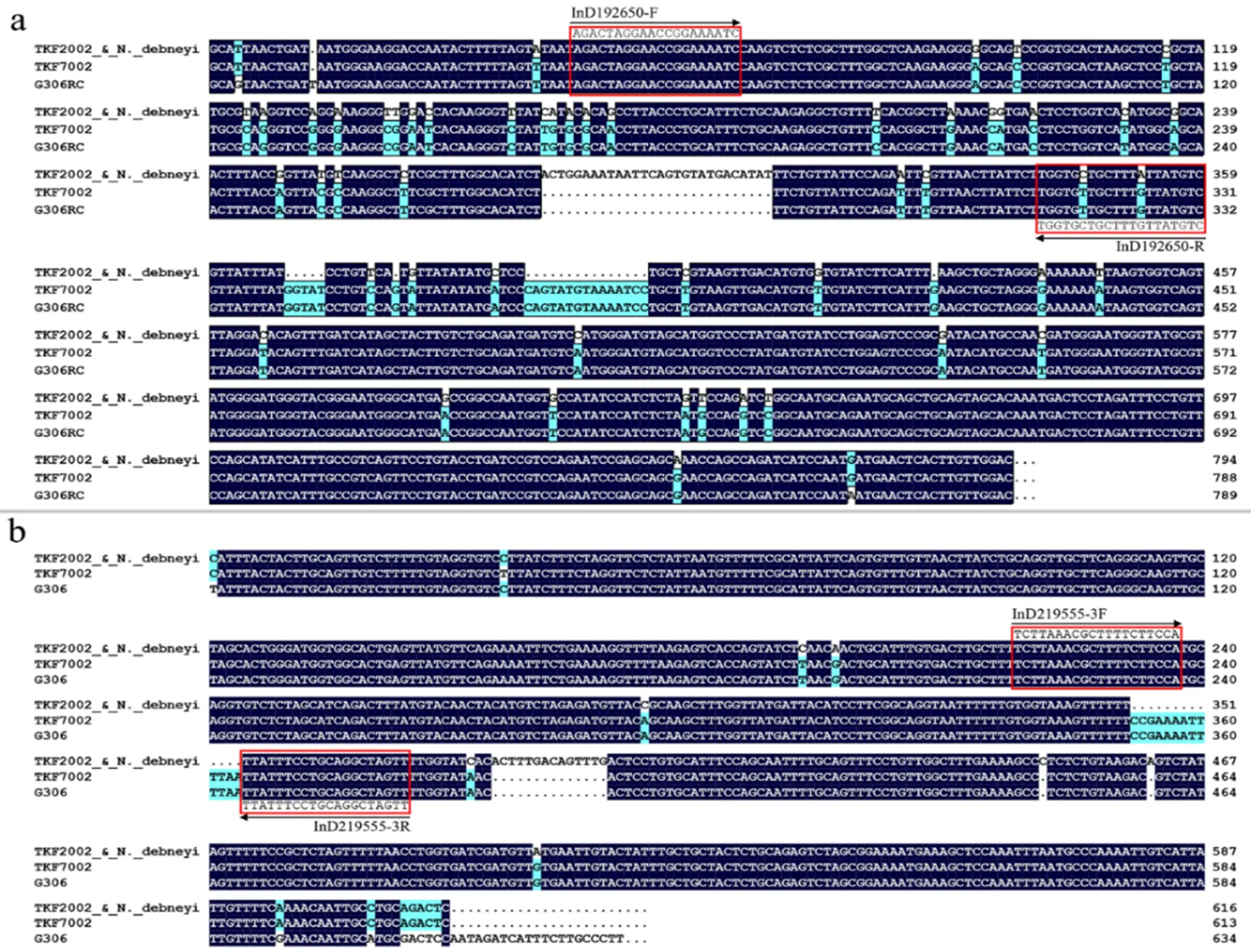
注:(a)SS192650位点的序列对比;(b)SS219555位点的序列对比。红色框和箭头显示转化InDel分子标记所在位置。TKF2002和TKF7002分别是前人报道的抗性和感病材料。

表1 转化与开发的RBRR1抗性位点共显性标记
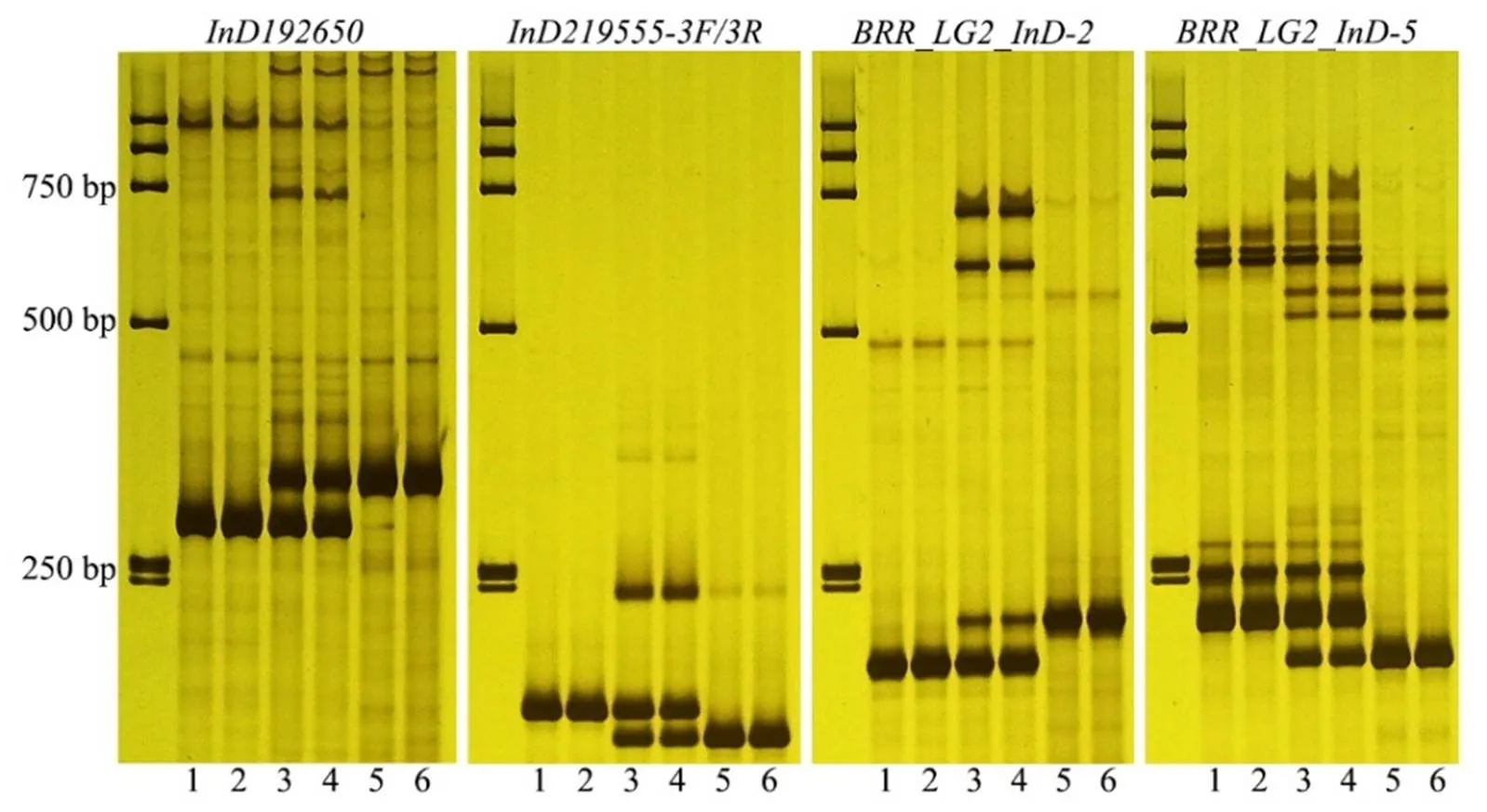
注:泳道1和2为云烟87;泳道5和6为TN90;泳道3和4为F1。
以云晒1号基因组序列为参考,通过BLAST方法将SS219555和SS192650标记锚定到其Chr2染色体上,并将两者之间的物理区段(191,732,059~193,313,373)作为目标区间。利用TN90和云烟87重测序数据以及云晒1号参考基因组序列对目标区间开发InDel分子标记,在目标区间内共获得6个InDel标记,分别命名为BBR-LG2-InDel-1~6(表1)。对这些标记进行筛选,共有2个标记具有较好的多态性,分别是BRR_LG2_InD-2和-5(图2)。
在后续的标记使用过程中,BRR_LG2_InD-5在分离群体中表现出3种以上带型,不利于准确读取基因型。因此,我们进一步对BRR_LG2_InD-5标记进行优化,在多态性位点两侧分别增设1条正引物和4条反引物(表1)。通过BRR_LG2_InD-5标记多条正反引物的组合及筛选,检测结果显示BRR_LG2_InD-5- 2F/2R,-2F/4R和-2F/5R均具有良好的多态性,其中BRR_LG2_InD-5-2F/4R的条带比较清晰(图3)。然而,在TN90/云烟87的分离群体中进行检测时,虽然3个标记能够检测出抗性位点,但是3个标记均表现为显性标记特征,即所有单株基因型均具有云烟87的带型(图3)。综上所述,将InD192650,BRR_LG2_ InD-2,BRR_LG2_InD-5-2F/4R和InD219555-3F/3R作为抗性位点共显性分子标记用于后续分析。
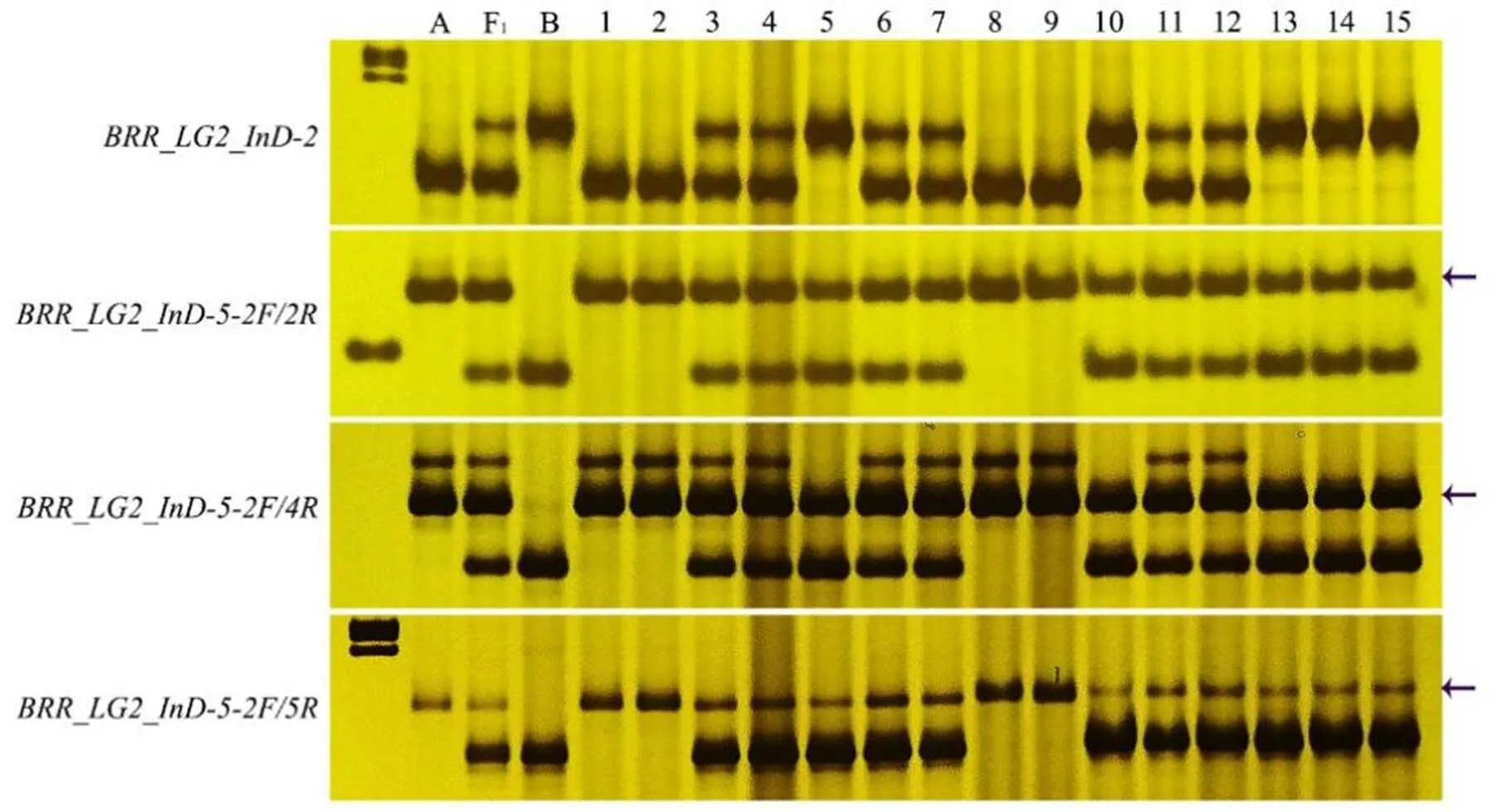
注:泳道A、F1和B分别为云烟87、杂交1代基因型和TN90;泳道1-15为BC3F2单株。箭头指示云烟87扩增条带所在位置。
2.2 分子标记辅助选择
本研究前期已获得以TN90为供体亲本、云烟87为轮回亲本的74个BC3F1:2家系。选取每个家系27个单株混合取样用于基因型检测,并利用上述转化或开发的标记进行分子标记辅助选择,共发现14个含有抗病位点的株系,这些株系可用作后续的抗病育种。
2.3 抗性位点的遗传效应分析
为了分析抗病位点导入云烟87后的遗传效应,选取云烟87和TN90衍生的一个含有抗病位点的BC3F2群体进行研究。选用上述4个分子标记进行基因型分析,在285个BC3F2单株中,目标区间基因型为纯合抗病位点基因型(记作)、纯合感病基因型的材料(记作)及杂合基因型的个体数目分别为60、76和149个,且没有检测到遗传交换单株。选取和基因型单株在温室条件下进行根黑腐抗病性鉴定。同时,在同样条件下考察TN90和云烟87的根黑腐病抗性。结果表明,云烟87平均病情指数为59.26%,TN90所有测试单株均未发病,其病情指数为0。对应的和在根黑腐病的抗性上表现出极显著差异;材料的根黑腐抗病平均病情指数为20.39%,材料的根黑腐抗病平均病情指数为72.35%(图4)。
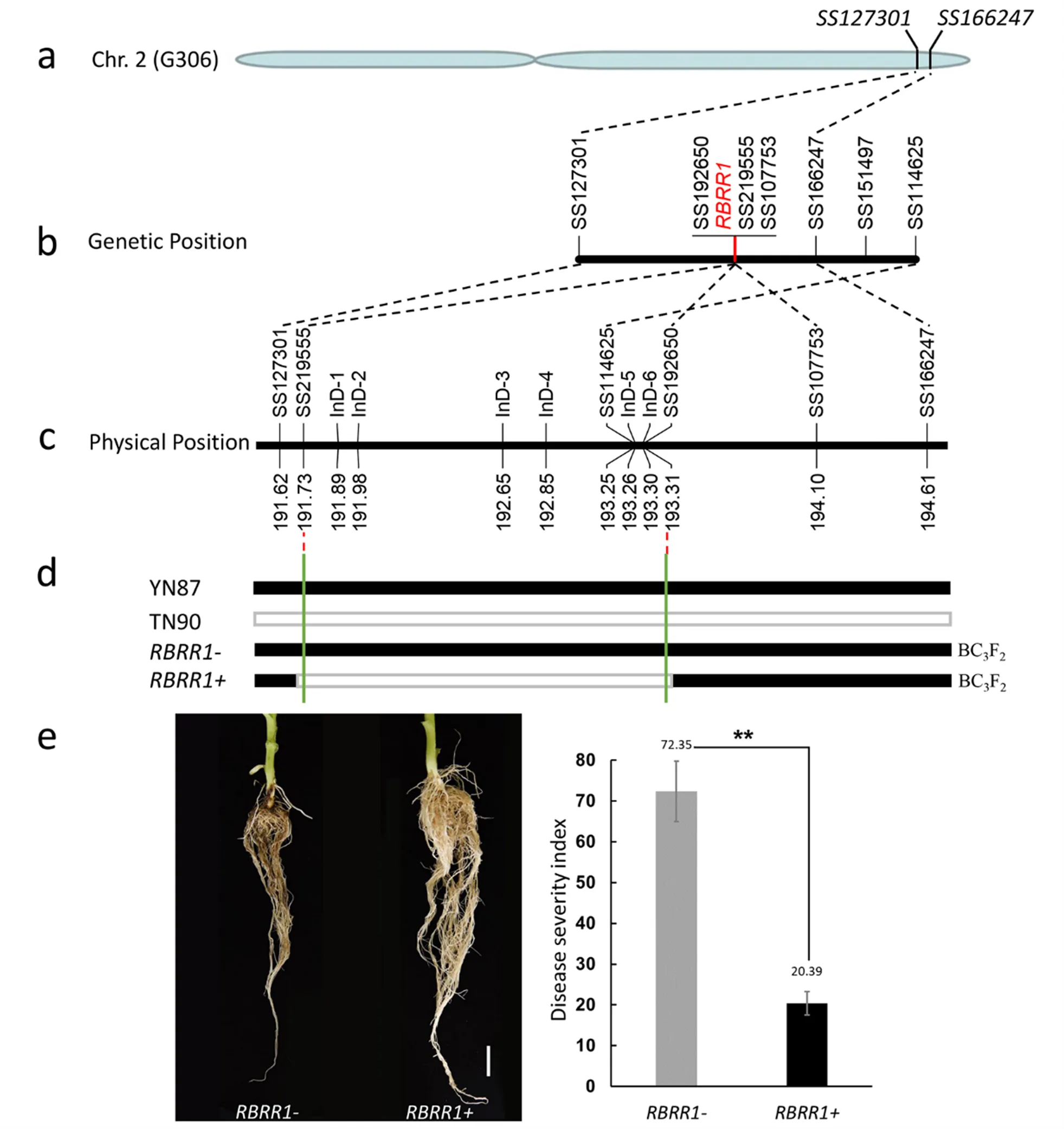
注:(a)RBRR1位点在染色体上的位置(以云晒1号为参考基因组);(b)RBRR1位点的遗传定位,数据参考文献[14];(c)RBRR1位点定位区间各分子标记的物理位置;(d)BC3F2世代RBRR1位点的两种重组类型;(e)BC3F2世代RBRR1+和RBRR1-基因型单株接菌后根系表型(左)和根黑腐病抗性统计(右)。比例尺=2 cm;**P < 0.01,t测验。为了方便绘图,将BRR_LG2_InD-1、-2、-3、-4、-5和-6分别简写为InD-1、-2、-3、-4、-5和-6。
2.4 根黑腐抗性位点的遗传变异分析
为了进一步探究抗病位点在自然群体中的分布,利用4个InDel标记对包含不同调制类型的普通烟草(SSTT)材料进行基因型分析,以检测抗病位点的等位变异频率。结果表明,在337份普通烟草核心种质资源中,共检测到2份烟草材料(Sota2和TN90)含有抗病位点,基因型频率为0.59 %(表2)。表性鉴定结果显示,Sota2与TN90具有相似的根黑腐病抗性表型(表4,图5)。由此推测,该抗病位点尚未在我国烟草生产中普及应用。由于上述4个InDel共显性标记在自然群体中均表现为只有2种基因型,因此,将其中3个InDel标记转化为检测抗病位点的特异显性标记,分别为DM192650- 2F/2R、DM219555-2F/2R和DM5-1F/2R,为KASP转化及高通量应用奠定基础(表3,图5)。

表2 不同材料中RBRR1抗病位点的等位变异频率
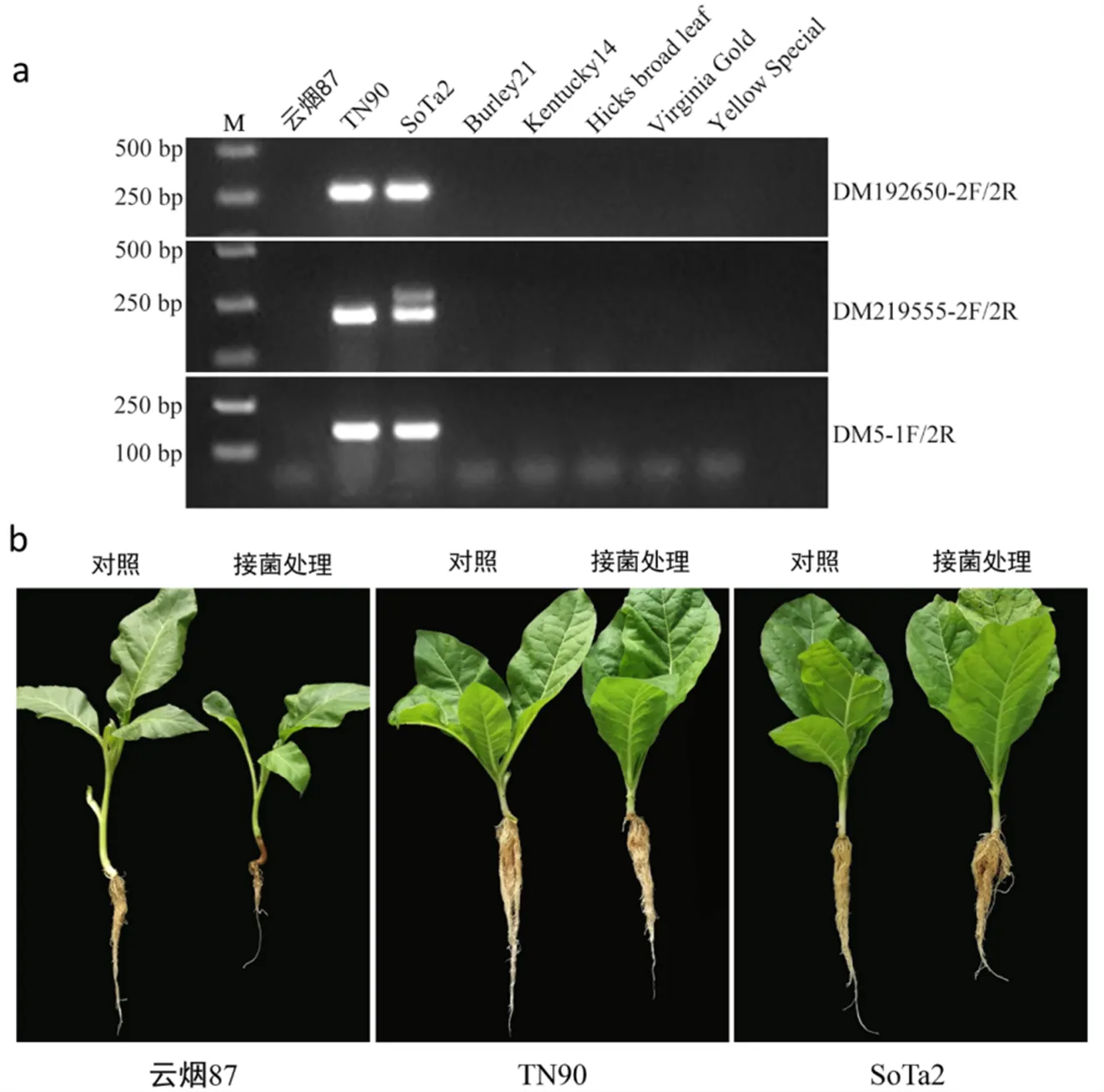
注:SoTa2、Burley21和Kentucky14为白肋烟,Hicks broad leaf、Virginia Gold和Yellow Special为国外烤烟。

表3 RBRR1抗性位点显性分子标记

表4 部分材料根黑腐病抗性鉴定
注:表中数据为不同等级或死亡单株统计数,“.”代表没有对应等级单株。加粗的两个材料TN90和SoTa2携带抗性基因。
3 讨论
3.1 RBRR1位点InDel分子标记可用于标记辅助选择育种
分子标记辅助选择回交育种已经在农作物抗病育种、品质育种中得到广泛应用[19-22]。在分子标记辅助选择过程中,分子标记的可靠性、分子标记的多态性水平、检测所需DNA的质和量、检测流程和检测成本被认为是限制分子标记广泛应用的5个因素[23]。CAPS标记的特点使其适合于相对较小的实验室开展定位克隆基因组目标区段/目标基因或多态性分析研究[15],而在分子标记辅助选择中受限。本研究在前人研究基础上,锚定了抗性位点的2个共分离CAPS标记SS219555和SS192650的基因组所在物理区间,并根据这2个标记的两翼序列以及TN90和云烟87的重测序数据,基于抗、感材料序列的InDel多态性转化、开发获得多个共显性、免酶切的分子标记。进而,利用InD192650,BRR_LG2_InD-2,BRR_LG2_InD-5-2F/4R和InD219555-3F/3R进行分子标记辅助选择,筛选出根黑腐抗性显著提高的BC3F2世代位点纯合单株,这些材料可用于后续的抗根黑腐品种选育。以上结果表明,本研究转化或开发的4个InDel标记可用于根黑腐抗性育种的分子标记辅助选择和后续的抗病基因定位。
小片段易位系是目前将野生资源优异基因导入生产作物最为理想的方式。一般来说,具有较小的外来片段的易位系在遗传上更稳定,产生有害影响的可能性更小。例如,在主粮作物小麦的研究中发现,冰草6P染色体小片段的插入易位系Pubing3035的粒重和穗长显著提高,并根据连锁图谱将易位断点定位在小麦1A染色体短臂的着丝粒附近[24]。与此类似,前人同样通过遗传连锁图谱将基因定位在17号染色体(K326基因组)的SS127301和SS166247标记之间[14];同时,本研究将基因共分离标记SS219555和SS192650锚定到Chr2染色体(G306基因组,Chr2长=201,712,017 bp)长臂末端,表明基因是以片段易位而非整臂易位的形式被导入到普通烟草中。前人测序发现携带基因的抗性材料中SS219555和SS192650标记两翼序列与i一致[14],说明2个标记之间的序列为外源片段。通常情况下,位于一个亲缘关系较远的外源易位插入片段的标记表现为显性标记,即只能在外源片段上扩增出条带;然而,在本研究的标记开发鉴定过程中,所转化和开发的标记均为共显性标记。其次,如果插入亲缘关系较近的外源片段,则标记在扩增携带有外源插入片段的亲本材料时(在本研究中为TN90抗性亲本)应表现为两条扩增条带,分别是烟草自身和外源片段扩增条带。然而,本研究转化和开发的标记扩增TN90时均为单一条带。同时,在对BRR_LG2_InD-5标记的改良过程中,BRR_LG2_InD-5-2F/2R,-2F/4R和-2F/5R在分离群体的所有单株中均能够扩增出云烟87的带型。综上,推测基因是以一个外源片段替换易位而非插入易位的形式导入到普通烟草,对携带基因抗性材料基因组组成的鉴定尚需要进一步研究。
3.2 RBRR1位点在我国烟草育种中的利用价值
由于早期栽培所用普通烟草品种对根黑腐病没有抗病能力,烟草根黑腐病给全世界烟草种植者造成了巨大的损失。随后,抗病位点在白肋烟上的应用使得根黑腐病情得到了有效控制[5]。本研究发现,在我国国内烤烟、国内晒烟和香料烟、国外引进烤烟资源以及国外引进晒烟中均未携带抗病位点,仅在引进的白肋烟中发现2个材料携带有该抗病位点,表明抗病位点在我国尚未进行广泛利用,具有较大的利用价值。
紧密连锁标记将有助于识别重组事件,从而打破潜在的不利连锁。有报道发现来自迪勃纳氏烟草的易位小片段不仅携带有抗病位点,可能还和一些不良农艺性状及化学特质相关[25],限制了在烤烟中的广泛应用。本研究获得的4个共显性InDel标记将有助于抗病位点后续的精细定位,从而打破连锁累赘。同时,遗传变异分析结果表明,InD192650,BRR_LG2_InD-2,BRR_LG2_InD-5-2F/4R和InD219555-3F/3R分子标记在扩增自然群体时仅表现为2种基因型,而并非如SSR标记在扩增普通烟草的不同材料时表现出多种基因型。因此,将其中3个标记转化为检测抗病位点的显性标记,为后续的KASP标记转化及高通量基因型鉴定奠定了基础。
4 结论
本研究在前人的研究基础上,以云晒1号基因组为参考,锚定了烟草根黑腐抗病位点的物理区间。利用云晒1号参考基因组与抗、感根黑腐病材料重测序数据,筛选并获得了4个多态性良好、免酶切的烟草根黑腐病抗病基因的紧密连锁分子标记,克服了现有CAPS标记的缺点。通过标记辅助筛选应用和遗传效应分析,鉴定获得了烟草根黑腐病抗性极显著提高的云烟87改良株系。通过自然群体遗传变异分析,发现4对引物在普通烟草自然群体中呈现2种基因型,并发现仅有白肋烟SoTa2与TN90携带有抗病位点。综上所述,抗病位点在我国尚未进行广泛利用,具有较高的利用价值,而本研究获取的4个分子标记能够简单、高效、稳定地用于该抗病基因的辅助选育。
[1] 窦彦霞,徐林,马冠华,等. 烟草根黑腐病菌ISSR标记的遗传多样性分析[J]. 烟草科技,2017, 50(11): 9-15.
DOU Yanxia, XU Lin, MA Guanhua, et al. Genetic diversity analysis ofby ISSR method[J]. Tobacco Science & Technology, 2017, 50(11): 9-15.
[2] Lucas G.B., Diseases of tobacco, 3rd edn[M]. Raleigh, N. Carol. USA: Biological Consulting Associates. 1975, 621 pp.
[3] Trojak-Goluch A and Berbe A. Resistance to black root rot (Nag. Raj and Kendrick) and some growth characteristics in doubled haploid derivatives of the F1hybrid of tobacco (L.)[J]. Polish Journal of Agronomy, 2009.
[4] 陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997(04): 3-9.
CHEN Ruitai, ZHU Xianchao, WANG Zhifa, et al. A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces (regions) in China[J]. Chinese Tobacco Science, 1997(04): 3-9.
[5] 朱贤朝,王彦亭,王智发. 中国烟草病害[M]. 北京:中国农业出版社,2002.
ZHU Xianchao, WANG Yanting, WANG Zhifa. Tobacco diseases of China[M]. Beijing: China Agriculture Press, 2002.
[6] 查道喜. 烟草病虫害的发生及防治[J]. 现代农业科技,2018(20): 117.
ZHA Daoxi. Occurrence and control of diseases and insect pests in tobacco. Modern Agricultural Science and Technology, 2018(20): 117.
[7] Haji H M, Brammall R A, and VanHooren D L. Effect of theblack root rot resistance gene on the yield and quality characteristics of flue-cured tobacco in Ontario[J]. Canadian Journal of Plant Science, 2003, 83(4): 939-942.
[8] Duan W, Wang L, and Song G-Q.- mediated transformation of wild tobacco species,, and[J]. American Journal of Plant Sciences, 2016, 7.
[9] Zeng Jianmin, Huang Changjun, Liu Yong, et al. The complete chloroplast genome sequence of(Solanaceae)[J]. Mitochondrial DNA. Part B, Resources, 2021, 6(3): 1042-1043.
[10] Trojak-Goluch Anna, Laskowska Dorota, Agacka Monika, et al. Effectiveness of combining resistance toandin haploid tobacco genotypes[J]. Breeding science, 2011, 61(4): 389-393.
[11] Hoffbeck L J. Burley 49, a new disease-resistant burley tobacco[M]. Knoxville: University of Tennessee, Agricultural Experiment Station. 1965, 18.
[12] Miller R D. Registration of ‘TN 90’ burley Tobacco[J]. Crop Science, 1991, 31(3): 852.
[13] Clayton E E. The study of resistance to the black root rot disease of tobacco[J]. Tobacco Science, 1969, 13(12): 30-37.
[14] Qin Qiulin, Li Yuting, Ding Na, et al. Development of user-friendly markers for disease resistance to black root rot of tobacco through genotyping by sequencing[J]. Molecular Breeding, 2018, 38(6): 1-7.
[15] Shavrukov Y N. CAPS markers in plant biology[J]. Russian Journal of Genetics: Applied Research, 2016, 6(3): 279-287.
[16] 窦彦霞,彭雄,余佳敏,等. 中国烟草根黑腐病菌根串珠霉菌群及rDNA-ITS序列分析[J]. 菌物学报,2012, 31(04): 531-539.
DOU Yanxia, PENG Xiong, YU Jiamin, et al. Grouping and rDNA-ITS sequence analysis ofon tobacco in China[J]. Mycosystema, 2012, 31(04): 531-539.
[17] 吴迷,汪念,沈超,等. 基于重测序的陆地棉InDel标记开发与评价[J]. 作物学报,2019, 45(02): 196-203.
WU Mi, WANG Nian, SHEN Chao, et al. Development and evaluation of InDel markers in cotton based on whole-genome re-sequencing data[J].Acta Agronomica Sinica, 2019, 45(02): 196-203.
[18] Chen Juanni, Wu Lintong, Lu Mei, et al. Comparative study on the fungicidal activity of metallic MgO nanoparticles and macroscale MgO against soilborne fungal phytopathogens[J]. Frontiers in Microbiology, 2020, 11(365).
[19] Singh Ashok K, Singh Vikas K, Singh Atul, et al. Introgression of multiple disease resistance into a maintainer of Basmati rice CMS line by marker assisted backcross breeding[J]. Euphytica, 2015, 203(1): 97-107.
[20] Vida Gyula, Gál Mariann, Uhrin Andrea, et al. Molecular markers for the identification of resistance genes and marker-assisted selection in breeding wheat for leaf rust resistance[J]. Euphytica, 2009, 170(1): 67-76.
[21] Zhou P, Tan Y, He Y, et al. Simultaneous improvement for four quality traits of Zhenshan 97, an elite parent of hybrid rice, by molecular marker-assisted selection[J]. Theoretical and Applied Genetics, 2003, 106(2): 326-331.
[22] Zhao Xianrong, Tan Guoqing, Xing Yuexian, et al. Marker-assisted introgression ofto improve maize resistance to head smut[J]. Molecular Breeding, 2012, 30(2): 1077-1088.
[23] Bertrand C Y Collard and David J Mackill. Marker-assisted selection: an approach for precision plant breeding in the twenty-first century[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2008, 363(1491): 557-572.
[24] Zhang Jing, Zhang Jinpeng, Liu Weihua, et al. Introgression of6P chromosome segment into common wheat for enhanced thousand-grain weight and spike length[J]. Theoretical and Applied Genetics, 2015, 128(9): 1827-1837.
[25] Legg P D, Litton C C and Collins G B. Effects of theblack root rot resistance factor on agronomic and chemical traits in burley tobacco[J]. Theoretical and applied genetics, 1981, 60(6): 365-368.
Development and haplotype analysis of insertion–deletion (InDel) molecular markers for resistance locusto black root rot of tobacco ()
FENG Zhiyu1, CHEN Xuejun1, GAI Xiaotong1, JIANG Ning1, JIAO Fangchan1, WU Xingfu1, TONG Zhijun1, LIU Tianyan2, YANG Linming2, XU Meiling1, LI Yongping1*
1 Key Laboratory of Tobacco Biotechnological Breeding, National Tobacco Genetic Engineering Research Center, Yunnan Academy of Tobacco Agricultural Sciences, Kunming 650021, Yunnan, China;2 Qujing Tobacco Company of Yunnan Province, Qujing 655099, Yunnan, China
is a single dominant broad-spectrum locus coffering resistance to black root rot that was introduced into tobacco () by remote hybridization and backcross, and the development of efficient, stable, low-cost and user-friendly tightly linked molecular markers is an effective approach for resistance breeding by marker-assisted selection and for location of functional gene within the locus.In this study, we anchored the region oflocus based on the primer sequences of published CAPS markers, and acquired four polymorphism markers targeting insertion-deletion (InDel) within the region ofusing the genome sequence of Yunshai#1 as reference and the resequencing data of a pair of resistant and susceptible root black rot materials. These markers were convenient, efficient and codominant in molecular marker-assisted selection of target individuals.Genetic effect analysis showed that the introduction ofthrough marker-assisted selection could significantly improve the resistance to black root rot in cultivated tobacco. Haplotype analysis showed that only TN90 and SoTa2 carriedin the tobacco core germplasm resources, and four pairs of primers presented two genotypes in the natural population of common tobacco.Collectively, our data indicated that the four InDel markers have high utilization value in marker-assisted selection and subsequent mapping of the functional gene.
tobacco, black root rot,, molecular marker-assisted selection, InDel marker
Corresponding author. Email:1303046997@qq.com
中国烟草总公司云南省烟草公司科技项目“优质抗病烤烟新品种选育”(2019530000241001);河北省自然科学基金项目“甜瓜根系分泌物中化感物质与镰孢枯萎菌的互作关系研究”(C2019402430)
冯智宇(1990—),博士,助理研究员,主要从事烟草功能基因组与育种研究,Tel:0877-2075074, Email:ffengzhiyu@163.com
李永平(1966—),Tel:0871-65113766,Email:1303046997@qq.com
2021-11-04;
2022-02-22
冯智宇,陈学军,盖晓彤,等. 烟草根黑腐病抗性位点RBRR1的InDel分子标记开发与分析[J]. 中国烟草学报,2022,28(4).FENG Zhiyu, CHEN Xuejun, GAI Xiaotong, et al. Development and haplotype analysis of insertion–deletion (InDel) molecular markers for resistance locus RBRR1 to black root rot of tobacco (Nicotiana tabacum)[J]. Acta Tabacaria Sinica, 2022, 28(4). doi:10.16472/ j.chinatobacco. 2021.T0203
