核因子-κB受体激活剂配体-核因子-κB受体激活剂信号传导通路在骨髓瘤骨病中的研究进展
2022-09-02唐文娇邹忠晴
冯 妍,唐文娇,邹忠晴,2,崔 健,3,张 丽,牛 挺
1四川大学华西医院血液内科血液病研究所,成都 610041
2成都大学附属医院血液内科,成都 610081
3四川大学华西临床医学院,成都 610041
多发性骨髓瘤(multiple myeloma,MM)是一种恶性克隆性浆细胞病,是最常见的中老年浆细胞肿瘤类型,发病率逐年升高,目前仍无法治愈[1]。MM多以骨痛起病,具有非常独特的骨病表现,故名骨髓瘤骨病(myeloma bone disease,MBD)。MBD是指由于骨髓瘤溶骨破坏导致的病理性骨折、脊髓与神经根压迫症、骨质疏松、骨量减少、高钙血症以及骨痛等一系列临床并发症,约90%MM患者在疾病进程中出现MBD[2- 3]。MBD主要影响中轴骨及扁骨,即颅骨、脊柱、胸廓和骨盆[4],严重MBD可影响患者脊柱活动性,从而影响日常生活运动[5],并且可能由于病理性骨折等引起严重疼痛,导致患者生活质量严重下降[6]。其次,MBD患者相比于未发生MBD的MM患者,就诊次数增加,总治疗费用会增加[7- 8],对患者治疗依从性产生一定程度的影响;也可能造成患者的心理困扰[9]。目前即使MM肿瘤负荷得到满意控制,MBD依然很难修复[10- 11]。因此,及时有效进行MBD治疗,对于确保MM患者规范诊治及改善基本生活质量十分重要。
现今由于对MBD发病机制认识不足,治疗MBD的药物也十分有限。目前主要使用静脉双膦酸盐(bisphosphonate,BP)进行预防和治疗,包括非含氮BP(如氯屈膦酸等)和含氮BP(如唑来膦酸、帕米膦酸二钠等)[9],以及用于缓解顽固性骨痛的放射性治疗、固定病理性骨折的手术治疗等[12- 13]。含氮BP通过抑制甲羟戊酸途径关键酶——法尼基焦磷酸合成酶(farnesyl pyrophosphate synthase,FPPS)来改变破骨细胞的细胞骨架,从而抑制破骨细胞活性并诱导其凋亡。非含氮BP通过与ATP结合诱导破骨细胞凋亡,从而通过减少骨表面活性破骨细胞的数量。BP虽然可以抑制破骨细胞,但难以逆转成骨不全[14- 15]。此外,BP通过肾脏以原型排出[16],因此可能损害肾功能,严重者可能发生急性肾功能衰竭。最新版《中国多发性骨髓瘤诊治指南(2022年修订)》针对MBD治疗做出了如下更新:(1)删除了含氮的氯屈膦酸用药;(2)新增了肾功能不全MM患者中应用地舒单抗的推荐。[17]
地舒单抗[2]是抗核因子-κB受体激活剂配体(receptor activator of nuclear factor κB ligand,RANKL)单抗药物,不经过肾脏代谢,降低了肾毒性[12]。由此可见,RANKL-核因子-κB受体激活剂(receptor activator of nuclear factor κB,RANK)信号传导通路作为骨重塑的一个重要调控系统,已然成为治疗MBD的新靶点[12]。RANKL是一种跨膜蛋白[18],通过蛋白水解裂解后成为分泌蛋白而成为配体,在淋巴结、胸腺、脾脏和骨髓等多种组织中表达[19]。RANK是跨膜蛋白受体,属于肿瘤坏死受体超家族成员,最初仅在破骨细胞前体细胞、成熟破骨细胞和树突状细胞上检测到其表达,后来研究发现RANK的表达也十分广泛,如在具有高潜力骨转移的乳腺癌和前列腺癌中亦被检出[20]。RANKL-RANK信号传导通路在早期即被证明是破骨细胞分化的一个强有力的驱动因素。本文就 RANKL-RANK信号传导通路如何参与MBD发病机制及其靶向治疗相关临床研究的新进展进行综述。
RANKL-RANK信号传导通路主要参与MBD破骨细胞活化
骨骼通过小梁骨表面的破骨细胞和成骨细胞之间的动态平衡活动,持续经历着成骨与溶骨不断更新、重塑过程[21]。现有研究提示,MBD中骨形成与溶解的动态平衡被打破,破骨细胞的分化增多、活性增加,骨重吸收增加;成骨细胞形成新骨受到抑制,从而导致溶骨性损伤[22]。其中,RANKL-RANK信号传导通路是诱导MBD破骨细胞成熟和激活的主要信号通路[9,22],在MM发生、发展中可被直接激活或间接活化。
MM直接激活RANKL-RANK信号传导通路促进破骨细胞活性(1)MM的骨髓微环境中肿瘤细胞、骨髓基质细胞等RANKL表达增多,与破骨前体细胞(如造血干细胞、单核巨噬细胞、未成熟破骨细胞等)表面RANK受体结合,激活下游通路(图1)。具体来说,成熟破骨细胞黏附于骨表面后,通过MM骨髓微环境中增加的RANKL等形成复合物,激活破骨细胞中包括Syk在内的Src依赖性通路,增强破骨细胞活性;同时RANKL可以从局部肿瘤环境中扩散,促进了破骨细胞的广泛激活,最终,骨重吸收增加,引起溶骨性损伤,继而形成MBD[22- 23]。(2)过度刺激的破骨细胞也有助于推动进一步的肿瘤进展[16],MM与MBD形成了一个互相促进的恶性循环[24]。有文献指出,在人源化严重免疫缺陷小鼠MM模型中,控制RANK-Fc可以降低肿瘤负荷和促进MM细胞因子如IL-6的产生[25]。(3)RANKL在MM进展过程中逐渐上调,RANKL-RANK信号传导通路也持续激活[25]。在小鼠骨髓瘤模型的实验中,RANK基因直至8周(疾病后期)开始上调表达。

BMSC:骨髓基质细胞;RANKL:核因子κB受体激活剂配体;RANK:核因子κB受体激活剂;OPG:骨保护素;IL- 6:白细胞介素- 16;PTHrp:甲状旁腺激素相关肽
MM间接活化RANKL-RANK信号传导通路促进破骨细胞活性RANKL作为配体,除了与RANK结合,还可以竞争性结合骨保护素(osteoprotegerin,OPG);OPG除在成骨细胞表达外,还在许多组织,如心脏、肾脏、肺脏和骨等表达[26]。一般来说,RANKL的上调与OPG的下调呈负相关;因此,RANKL/OPG比值被认为是骨量形成的主要决定因素[27];换言之,该比值升高有利于破骨细胞的促溶骨功能[28]。MM通过下调OPG,促进了RANKL-RANK信号传导通路介导的破骨细胞活化效应:(1)MM细胞通过抑制骨髓基质细胞、成骨细胞表达OPG,降低骨微环境中的OPG 水平,减弱OPG对 RANKL 与 RANK相互结合的阻断,骨髓微环境中有利于破骨细胞形成和活化的 RANKL与OPG 比值增加,间接活化RANK-RANKL信号传导通路[29]。(2)MM细胞表面高表达肝素硫酸蛋白多糖syndecan- 1,可与OPG结合使其被内化、被降解,减弱OPG的作用[30]。
活化RANKL-RANK信号传导通路的上游途径不同,是其参与MBD、骨质疏松、实体肿瘤骨转移的主要差异:(1)MM骨髓瘤细胞、成骨细胞、骨髓基质细胞等细胞的RANKL过表达,激活RANKL-RANK信号传导通路参与MBD发生、发展[30]。(2)绝经后骨质疏松,也称为Ⅰ型原发性骨质疏松症。绝经后,雌激素缺乏会导致骨微环境中RANKL水平增加[31],卵泡促激素也增加,后者通过增强T细胞活化促进RANKL诱导的破骨细胞激活和骨损失[32]。(3)老年性骨质疏松属于Ⅱ型原发性骨质疏松症[32],人体进入老龄化阶段后处于氧化应激状态,产生的炎性因子诱导成骨细胞RANKL过表达[33]。(4)实体肿瘤骨转移多为溶骨、成骨并存的混合性病变[34]:有些实体肿瘤与MM类似,肿瘤细胞可分泌细胞因子刺激成骨细胞、基质细胞表达RANKL,激活RANKL-RANK通路,促进破骨细胞活性而形成溶骨病变[34];有些实体肿瘤则与MM不同,如前列腺癌骨转移以成骨细胞活性增强为主要特征[35]。
抗RANKL单抗药物治疗MBD的临床进展
抗RANKL单抗药物治疗MBD的临床试验进展靶向RANKL-RANK信号传导通路的一种新型RANKL抑制剂,即RANKL的全人化单克隆IgG2抗体类大分子药物——地舒单抗,已在海外及我国获批上市,目前已纳入中国多发性骨髓瘤诊治指南(2022年修订)。2011年,费城Joan Karnell癌症中心发表了地舒单抗对比唑来膦酸防治晚期实体瘤骨转移(除外乳腺癌和前列腺癌)、MM骨相关事件(skeletal-related events,SRE)的双盲、随机对照、Ⅲ期临床研究结果[36],共纳入1779例患者,MM仅占总样本的10%,研究设计未针对MM进行预后危险分层。2018年,麻省总医院[12]纳入1718例新诊断MM患者进行了一项国际、双盲、随机、对照Ⅲ期研究,对比地舒单抗、唑来膦酸防治MBD的疗效,实验组每 4周皮下注射地舒单抗 120 mg 联合静脉注射安慰剂,对照组每 4周静脉注射唑来膦酸 4 mg 联合皮下注射安慰剂;结果表明:地舒单抗发生首次SRE时间与唑来膦酸相当,但首次SRE数量和SRE总数量均低于唑来膦酸;同时,地舒单抗组中位无进展生存(progression-free survival,PFS)优于唑来膦酸组,分别为46.1、35.4个月(HR=0.82,P=0.036);此外,地舒单抗组肾脏相关不良事件(10%比17%)、急性期相关不良反应,如常见的发热、关节痛等(5%比9%)发生率均低于唑来膦酸组;但需要注意的是,地舒单抗组低钙血症发生率高于唑来膦酸组(17%比12%)。2020年,台湾大学医院[37]对其中的196 例亚洲患者(地舒单抗,n=103;唑来膦酸,n=93)进行了亚组分析,结果表现:地舒单抗组SRE发生率呈现降低趋势,但并无统计学差异;肾毒性相关不良反应更低(8.8% [9/102]比21.7% [20/92])。来自亚洲亚组分析的结果提示对于初诊合并溶骨性病变的MM患者地舒单抗与唑来膦酸基本等效,同时地舒单抗也适用于亚洲MM患者MBD防治的选择之一(表1)。
同期,麻省总医院通过整合三期临床试验的数据来建立XGEVA全球经济模型,对比分析了地舒单抗、唑来膦酸防治MBD的成本效益,结论支持:从经济效益角度,无论对于患者、付款方还是社会,地舒单抗更有优势[38]。该模型包括关于疾病进展、药物的使用、严重不良事件等多个方面的评估,以增量成本效益比率(incremental cost-effectiveness ratio,ICER)来评估成本-效益,具体公式如下:通过地舒单抗与唑来膦酸总成本的差值(ΔC),除以二者之间医疗结果差值(ΔE)来计算,即ICER=ΔC/ΔE。本文设置了支付意愿(willingness-to-pay,WTP)阈值为15万美元,反映了社会愿意为额外获得的质量调整寿命年(quality-adjusted life-year,QALY)支付的最大金额:从社会角度来看,地舒单抗的付费成本为547 589美元、QALY为3.400,唑来膦酸的付费成本为521 260美元,QALY为3.156;与唑来膦酸相比,使用地舒单抗增加了26 329美元的成本ΔC和0.2439的QALY获益ΔE,ICER为107 939美元/QALY;从付款方角度来看,与唑来膦酸相比,地舒单抗组增加了29 409美元的成本ΔC和0.2439的QALY获益ΔE,ICER为120 569美元/QALY;均低于15万美元/QALY社会的支付意愿阈值。结合地舒单抗没有肾毒性的特点,地舒单抗成为防治MBD的一种高成本效益选择。
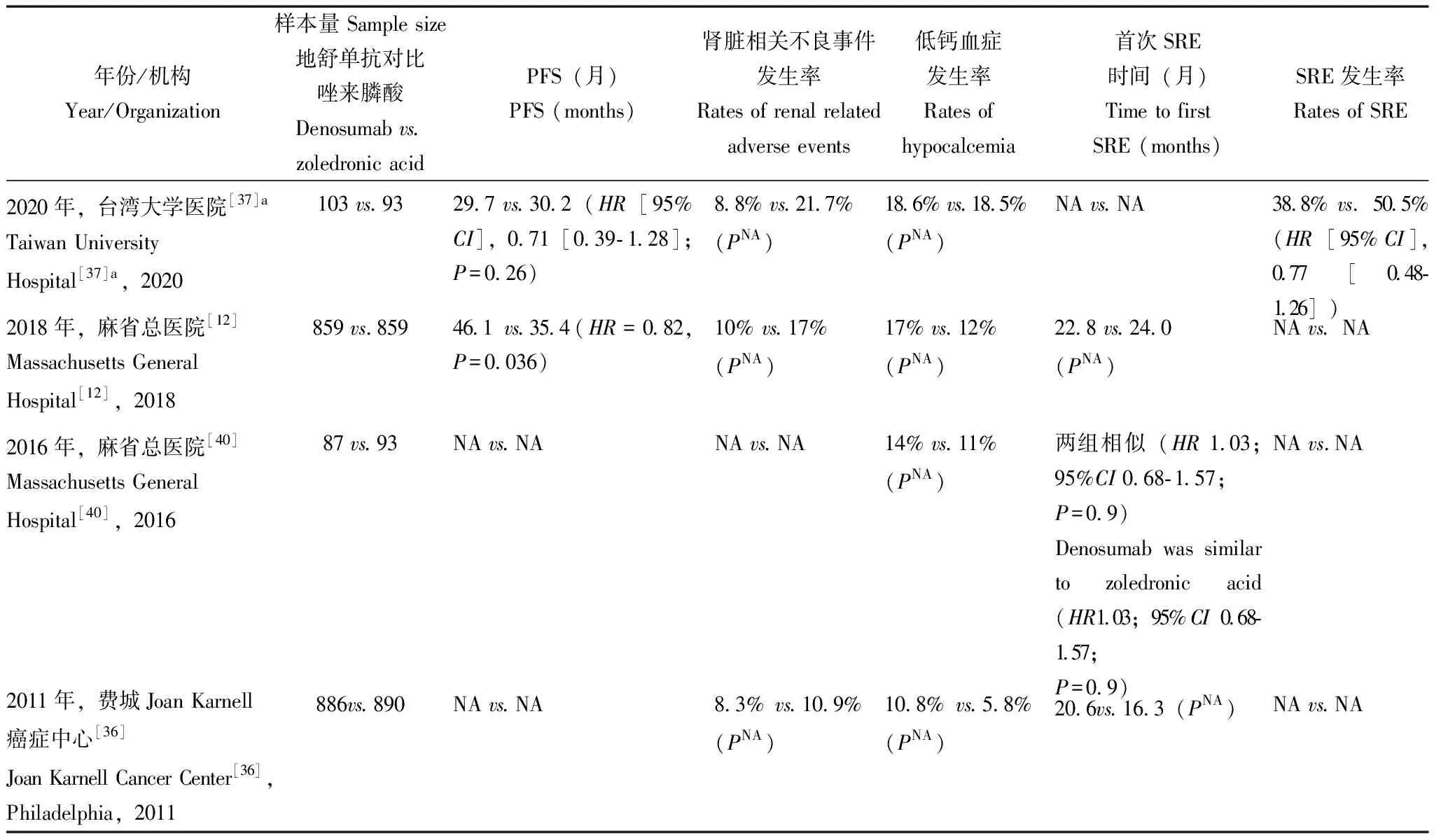
表1 地舒单抗对比唑来膦酸治疗骨髓瘤骨病的临床研究汇总表
抗RANKL单抗药物治疗MBD的真实世界评估2019年,地舒单抗于我国上市,首轮获批适应证为:不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤。2020年11月20日,地舒单抗注射液在中国用于预防实体瘤骨转移和MM中骨相关事件的新适应证上市申请已获得国家药品监督管理局的批准。《中国多发性骨髓瘤诊治指南(2022年修订)》新增了肾功能不全MM患者中应用地舒单抗的推荐[17]。2016年,日本岐阜大学医学院血液中心对11例使用地舒单抗治疗的MM患者进行了真实世界经验分享:该患者群体中位年龄69岁(54~76岁),注射的中位数为15次(1~27次),其中男性7例,新诊断MM 7例,4例最初使用唑来膦酸,后来改用地舒单抗,8例给予口服钙预防低钙血症。治疗期间无SRE发生;9例第1个疗程血钙下降程度最为明显;2例在怀疑颌骨骨坏死(osteonecrosis of the jaw,ONJ)后停用了地舒单抗,但其中1例通过活检确诊为鳞状细胞癌;因此,研究者建议对于使用地舒单抗的MM患者,密切监测血清钙浓度和预防性口服补钙是必要的,发生ONJ必要时需通过病理学检查进行鉴别诊断[39]。
总 结
RANKL-RANK信号传导通路为 MBD 的治疗提供了新的靶点,通过有效防治MBD,增加MBD患者的治疗依从性与信心,提高其生活质量和改善生存预后。本文旨在通过综述RANKL-RANK信号传导通路激活破骨细胞,参与MBD发生的过程以及RANKL抑制剂在MBD临床治疗的发展,为我国MBD靶向治疗的真实世界研究提供参考。
