广藿香酮对人宫颈癌SiHa细胞增殖、凋亡、迁移和侵袭作用的研究
2022-09-01刘经健冉凤英杨光义梅全喜李婷婷陈琴华
刘经健,冉凤英,杨光义,武 伦,杨 洋,朱 婧,陈 琳,梅全喜,李婷婷,陈琴华*
0 引言
宫颈癌是原发于子宫颈的恶性肿瘤,在全世界恶性肿瘤发病率和死亡率中居第4位[1]。随着社会的发展,我国的宫颈癌患者发病呈现年轻化,并且发病率呈上升趋势[2]。临床对于宫颈癌的治疗以手术和放疗为主,辅以化疗、中医治疗等综合治疗[3]。传统中药在提高宫颈癌患者生活质量,延长其生存期中具有独特的优势[4],发掘具有抑癌活性的中药成分显得尤为重要。
广藿香是唇形科刺蕊草属植物,别名刺蕊草、霍香,为“十大南药”之一。广藿香酮具有抗菌、抗病毒和抗炎等多种生物活性作用[5-7]。近年来研究发现,广藿香酮对前列腺癌、胆囊癌、结肠癌具有抑制作用[8-10],但其对宫颈癌的研究未见报道。故本研究选用宫颈癌SiHa细胞,通过不同浓度广藿香酮干预后,检测细胞增殖、凋亡、迁移、侵袭情况,探讨广藿香酮在体外的抗宫颈癌作用,以期为广藿香酮临床治疗宫颈癌提供理论基础。
1 材料
1.1 药品与试剂 广藿香酮购自上海陶素生化科技有限公司,纯度≥98%。DMEM培养液购自美国Gibco公司,胎牛血清购自北京赛澳美细胞技术有限公司,CCK-8试剂盒购自上海陶素生化科技有限公司,Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自杭州联科生物技术有限公司,RIPA裂解液(强)和BCA蛋白浓度测定试剂盒(增强型)均购自江苏碧云天公司,SDS-PAGE试剂盒购自上海BBI生命科学有限公司,ECL试剂购自美国Millipore公司,兔抗人Bax、Bcl-2、MMP-2、MMP-9购自美国Immunoway公司,β-actin单克隆抗体以及辣根过氧化物酶标记的山羊抗兔IgG购自武汉安特捷生物技术有限公司。
1.2 主要仪器 3111型CO2培养箱(美国Thermo公司);MQX-200型全波长酶标仪(美国Bio-Tek公司);Calibur型流式细胞仪(美国BD公司);IX71型倒置荧光显微镜(日本Olympus公司);UVP INC型凝胶成像系统(中国Gene公司)。
1.3 细胞株 人宫颈癌SiHa细胞购自武汉普诺赛生命科技有限公司。
2 方法
2.1 药物的配制与保存 将广藿香酮溶于二甲基亚砜(Dimethyl sulfoxide,DMSO)中配制成120 mg/ml母液,再依次用DMSO配制成所需浓度,分装后-20 ℃保存备用,使用前用培养液稀释1 000倍至所需给药浓度,DMSO终浓度≤0.1%。
2.2 细胞培养 人宫颈癌SiHa细胞购自武汉普诺赛生命科技有限公司,用含10%胎牛血清培养液、1%青-链霉素双抗的DMEM培养基,于37 ℃、5 % CO2的恒温培养箱中进行培养,当细胞生长密度为80%~90%时,按1∶3传代培养。
2.3 CCK-8检测细胞增殖 将处于对数生长期的SiHa细胞消化离心,接种于96孔培养板中,每孔100 μl体积(2×103/孔),培养箱中培养24 h后加药处理。实验组分为6个组,分别加入100 μl含有浓度为20、40、60、80、100和120 μg/ml广藿香酮的完全培养液,对照组加入100 μl含有0.1% DMSO的完全培养液,每组设5个复孔。在培养24、48 h时,每孔加入10 μl CCK-8溶液,在细胞培养箱中继续培养2 h后振荡混匀,酶标仪测定在450 nm波长处各孔的OD值,计算细胞存活率。细胞存活率(%)=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
2.4 流式细胞术检测细胞凋亡率 将处于对数生长期的SiHa细胞消化离心,接种于6孔培养板中,每孔2 ml体积(1×105/孔),培养箱中培养24 h后加药处理。实验组分为3个组,分别加入2 ml含有40、80和120 μg/ml广藿香酮的完全培养液,对照组加入2 ml含有0.1%DMSO的完全培养液,每组设3个复孔。培养48 h时,应用Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒处理各组细胞。消化收集细胞,预冷的PBS清洗细胞2次,500 μl体积的1×Binding Buffer重悬细胞,每管加入5 μl Annexin V-FITC和10 μl PI,轻柔涡旋混匀后,室温避光孵育5 min,用流式细胞仪检测细胞的凋亡率。
2.5 划痕实验检测细胞迁移 SiHa细胞接种于6孔板上,每孔2 ml体积(3×105/孔),24 h后用200 μl灭菌一次性吸头做直线划痕,用PBS洗涤细胞3次后,加入含1%胎牛血清和广藿香酮(0、40、80、120 μg/ml)的DMEM培养液,于细胞划痕后的0、48 h观察并照相记录。通过Image J软件进行愈合率的计算,划痕愈合率=(初始划痕面积-现存划痕面积)/初始划痕面积×100%。
2.6 Transwell实验检测细胞侵袭 将基质胶加入Transwell小室中,置于细胞培养箱中培养1 h,待基质胶凝固后吸去残液。SiHa细胞胰酶消化后用含0.1% 胎牛血清的培养液重悬细胞,计数并调节细胞浓度至2×105/ml。Transwell小室放入24孔板中,上室加入200 μl的细胞悬液,下室加入600 μl含10%胎牛血清的培养基。继续培养48 h后弃培养基,小室于甲醛后0.1%结晶紫染液染色,PBS清洗后,棉签轻轻擦净小室上层未迁移过去的细胞,在显微镜下拍照记录穿膜细胞数量。
2.7 Western blot检测相关蛋白的表达 SiHa细胞接种于6孔板上,每孔2 ml体积(1×105/孔),培养箱中培养24 h后加药处理。继续培养48 h时,用预冷的PBS洗涤细胞2次,加入RIPA裂解液(强)提取总蛋白,BCA蛋白浓度测定试剂盒(增强型)进行蛋白质定量,取蛋白质20 μg/孔,10% SDS-PAGE 凝胶电泳分离,湿转至 PVDF膜;TBST洗涤后用5%脱脂奶粉室温封闭1 h,分别加入兔抗人Bax、Bcl-2、MMP-2、MMP-9(1∶1 000)和β-actin单克隆抗体(1∶2 000),室温反应1 h,TBST洗涤3次,每次10 min;加入辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000)于室温孵育1 h,TBST洗涤3次,每次10 min;等体积ECL发光剂A、B液混匀,并孵育于暗室曝光,凝胶成像系统拍照记录图像。
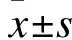
3 结果
3.1 广藿香酮对SiHa细胞增殖的影响 CCK-8显示广藿香酮对SiHa细胞的增殖有显著的抑制作用,且呈浓度依赖性和时间依赖性(P<0.05,P<0.01),不同浓度广藿香酮(0、20、40、60、80、100和120 μg/ml)作用于SiHa细胞24 h、48 h时细胞的存活率如图1所示。

图1 广藿香酮对SiHa细胞增殖的影响(n=5)
3.2 广藿香酮对SiHa细胞凋亡率的影响 如图2所示,不同浓度广藿香酮(0、40、80、120 μg/ml)作用SiHa细胞48 h时,SiHa细胞凋亡率随药物浓度的增加而增高,与对照组相比差异有统计学意义(P<0.01),表明广藿香酮能促进SiHa细胞的凋亡。

图2 广藿香酮对HepG2细胞凋亡率的影响(n=3)
3.3 划痕实验检测细胞迁移 如图3所示,不同浓度广藿香酮(0、40、80、120 μg/ml)作用SiHa细胞48 h时,划痕实验检测发现,SiHa细胞迁移能力随药物浓度的增加而降低,与对照组相比差异有统计学意义(P<0.01),表明广藿香酮能抑制SiHa细胞的迁移。

图3 划痕实验检测细胞迁移(n=3,200×)
3.4 Transwell实验检测细胞侵袭 如图4所示,不同浓度广藿香酮(0、40、80、120 μg/ml)作用SiHa细胞48 h时,Transwell实验检测发现,随着广藿香酮浓度的增加,穿过小室的细胞数量也随之减少,表明了广藿香酮能显著抑制SiHa细胞体外侵袭能力(P<0.01)。
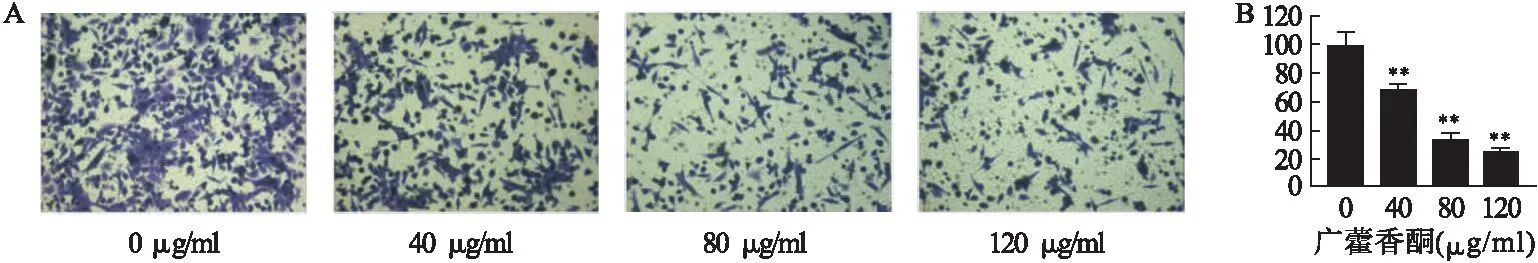
图4 Transwell实验检测细胞侵袭(n=3,200×)
3.5 广藿香酮影响SiHa细胞Bax、Bcl-2、MMP-2、MMP-9蛋白的表达 Western blot检测不同浓度广藿香酮(0、40、80、120 μg/ml)作用SiHa细胞48 h时Bax、Bcl-2、MMP-2、MMP-9的表达情况,如图5所示,随着广藿香酮浓度的增加,Bax蛋白水平显著上调(P<0.01),Bcl-2、MMP-2、MMP-9蛋白水平下调(P<0.01)。

图5 广藿香酮对SiHa细胞Bax、Bcl-2、MMP-2、MMP-9表达的影响(n=3)
4 讨论
近年文献报道,植物中一些成分具有抗肿瘤活性,如吉马酮能抑制宫颈癌Hela细胞增殖和迁移侵袭,促进其凋亡[11]。广藿香作为一种应用极其广泛的中草药,不仅是藿香正气水、抗病毒口服液和小儿感冒冲剂等众多有名中成药的主要成分,在医药、化妆品、园林、香料等领域也有广泛的应用。Cao等[10]通过结直肠癌HCT116细胞在体外研究了广藿香酮的抗肿瘤活性,发现广藿香酮的抗结直肠癌活性依赖于上调LC3-Ⅱ、cleaved caspase-7和caspase-3的表达诱导自噬和凋亡,降低AKT/mTOR的磷酸化。在体内,150 mg/kg广藿香酮能够抑制免疫缺陷小鼠HCT116肿瘤生长,抑制率为43.3%,并能降低Ki67的表达。
细胞凋亡是导致组织损伤的程序性细胞死亡生理过程。对于大多数常用的抗癌药物来说,激活凋亡通路以杀死癌细胞是主要的抗癌机制[12]。研究表明,中药诱导细胞凋亡是发挥其抗肿瘤活性的重要途径。如白藜芦醇通过线粒体和p53信号通路抑制人宫颈癌细胞增殖并促进凋亡[13]。细胞凋亡主要分为内源性途径(线粒体途径)和外源性途径(死亡受体途径)[14],其中B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)蛋白家族在线粒体凋亡途径中起着关键作用。Bcl-2蛋白家族通过调节线粒体膜通透性参与细胞凋亡,主要包括以Bcl-2为成员的抗凋亡蛋白和以Bax为成员的促凋亡蛋白,Bcl-2/Bax比例可以反映细胞凋亡的情况[15]。Bcl-2能够通过抑制封闭细胞核的运转和细胞内钙离子含量的上升发挥抗凋亡作用[16],也可与Bax形成同源二聚体或异源二聚体,分别起抑制或促进凋亡的作用[17]。Bax是受Bcl-2调节的促凋亡蛋白,能够通过诱导线粒体渗透性改变、激活凋亡蛋白、释放细胞色素发挥促凋亡作用[18],而激活的Bax也可直接或间接地钝化抑制凋亡的Bcl-2蛋白[19]。本研究发现,广藿香酮可能通过下调Bcl-2的表达,并上调Bax的表达以促进SiHa细胞凋亡。
肿瘤细胞的转移被认为是恶性肿瘤的最主要生物学特征之一,是恶性肿瘤发生和发展过程中的危险阶段,是导致肿瘤患者死亡的重要原因[20]。基质金属蛋白酶(Matrix metalloproteinase,MMPs)是一类能特异性地降解细胞外基质的锌依赖酶家族,通过破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭和转移中起着至关重要的作用[21]。MMP-2和MMP-9是MMPs家族的2个最重要的成员,也是目前研究较为透彻的与肿瘤转移关系最为密切的细胞外基质降解酶。MMP-2和MMP-9主要通过降解细胞外基质中的Ⅳ型胶原,参与血管生长因子的形成,促进肿瘤血管新生,在肿瘤侵袭和转移中发挥重要作用[22]。本研究首次探讨了广藿香酮抗肿瘤细胞迁移侵袭的作用,证实了广藿香酮能显著抑制SiHa细胞的迁移侵袭,这一作用可能与通过下调MMP-2和MMP-9的表达有关。
综上所述,本研究发现广藿香酮在体外能显著抑制宫颈癌SiHa细胞的增殖,可能通过下调 Bcl-2/Bax蛋白的表达促进SiHa细胞凋亡,通过下调MMP-2和MMP-9的表达抑制SiHa细胞的迁移侵袭,这为广藿香酮作为临床治疗宫颈癌的药物提供了一定的理论依据。但本研究未进行体内研究,对具体的作用机制研究也不够深入,这也将是我们下一步实验需要探讨的方向。
