脂肪源性干细胞来源外泌体在特发性肺纤维化中作用机制的研究进展*
2022-09-01汪望佳李翅翅
汪望佳,王 敏,李翅翅,张 丹△
(1温州医科大学附属第一医院呼吸与危重症医学科,浙江温州 325000;2温州医科大学附属第一医院整形外科,浙江温州 325000)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种持续进展的间质性肺病,患者通常以进行性呼吸困难和干咳为主要临床症状,临床确诊后中位生存期仅为3~5 年[1]。IPF 的病因尚不明确,但研究证实持续的炎症反应及上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程与IPF 的发生发展关系密切,应用激素、免疫抑制剂及抗EMT过程的药物在临床上发挥了一定的治疗效果,然而这些药物的使用存在其局限性。目前最有效的治疗手段仍是肺移植,却受限于转诊时机的确定和移植后的低存活率。因此进一步研究IPF 的发生发展机制并寻求新的治疗靶点具有重大的临床意义。
脂肪源性干细胞(adipose-derived stem cells,ADSCs)是近年来再生医学等领域的研究重点,该细胞不仅可通过增殖、归巢和定向分化作用直接参与受损组织的修复,还可通过旁分泌功能间接参与调节免疫反应及氧化应激等病理生理过程[2]。相对于干细胞直接定向分化作用而言,旁分泌功能被证明具有作用范围广和免疫异质性小等优势。其中最受关注的是携带各种生物活性成分的外泌体,作为细胞间信息传递的重要媒介已被证实是干细胞发挥调节功能的关键旁分泌物质[3]。本文就ADSCs 来源的外泌体(ADSCs-derived exosomes,ADSCs-Exo)在治疗IPF中的研究进展展开综述,讨论其潜在的作用机制及应用前景。
1 外泌体的生物学结构及功能
外泌体是一类在大小和生物功能等方面具有高度特异性的膜性囊泡,直径约30~100 nm[4]。外泌体来源于细胞膜内吞形成的早期内体,逐步成熟为富含管腔状囊泡的多囊体(multivesicular body,MVB)也就是外泌体前体。MVB主要通过内体分选转运复合体(endosomal sorting complex required for transport,ESCRT)机制形成。ESCRT 是一组胞质蛋白复合物,其中ESCRT-0 识别和结合早期内体表面泛素化标记的特异性受体,在ESCRT-I和ESCRT-II协同诱导下,内体膜包裹特异性物质形成出芽小泡,随后ESCRTIII 剪切分离囊泡和内体膜形成MVB,最后辅助蛋白VPS4(vacuolar protein sorting 4)分离并进入ESCRT再循环[5]。MVB 有两个去向,大部分经溶酶体途径被降解,少数与细胞膜融合并向胞外释放外泌体从而发挥作用[6]。见图1。
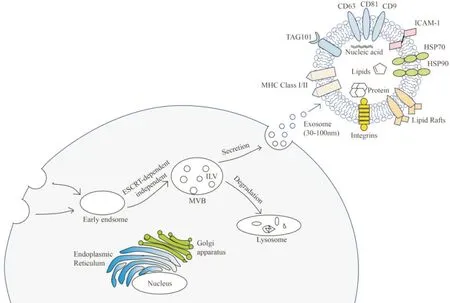
Figure 1.The biological structure,formation and secretion process of exosomes.图1 外泌体的生物学结构、形成和释放过程
随着对外泌体研究的逐渐深入,研究者对其功能有了更多的认识。在发现初期,大多数研究者认为外泌体是细胞分泌的废弃物,细胞通过外泌体将胞内一些多余的代谢物排出到胞外以维持细胞内环境的稳态。随着研究的进展,研究者们发现外泌体不仅可通过运输蛋白质、核酸及脂质等生物活性物质进行细胞间的相互调节,还可作为稳定的药物载体进行疾病治疗,并与多种疾病诊断及预后判断密切相关[7]。
2 ADSCs-Exo通过调节EMT 过程干预IPF 的发生发展
EMT 是正常胚胎发育和组织重建的生理过程,但其异常发生与肿瘤形成和纤维化过程相关[8]。EMT 的特征包括上皮钙黏素(E-cadherin)表达减少,以及波形蛋白(vimentin)、I 型胶原和IV 型胶原等间充质标志物表达增加[9]。最近的研究表明,组织损伤后肺上皮细胞和细胞外基质之间的通讯失调在IPF发生发展中扮演着重要角色,EMT通过激活与此过程相关的信号通路来促进纤维化[10]。与此一致的是,小鼠模型实验以及一些IPF患者标本检测也同样显示了EMT 在IPF 中的重要作用[11]。目前ADSCs-Exo 对EMT 调控机制的研究尚不多,主要集中于转化生长因子β(transforming growth factor-β,TGF-β)及Wnt/β-catenin 信号通路,已证实这两条信号通路在EMT过程中发挥重要的正向调节作用。
2.1 ADSCs-Exo 通过调控TGF-β/Smad 相关信号通路影响EMT过程 在博来霉素诱导的肺纤维化小鼠中,敲除Smad3或转染TGF-β 拮抗剂Smad7,可有效抑制肺纤维化程度及EMT 水平,由此表明TGF-β/Smad通路正向调控EMT过程[12]。Yao等[13]将间充质干细胞外泌体与经TGF-β1 诱导的上皮细胞共培养后发现,外泌体促进E-cadherin 表达,而降低vimentin、TGF-β1 和Smad2 表达,提示外泌体可抑制上皮细胞表型向间充质表型转换,其具体机制可能是通过其活性物质直接或间接抑制TGF-β/Smad 信号通路以逆转EMT 过程。进一步的研究发现,外泌体中的微小RNA(microRNAs,miRNAs)在EMT 过程中起着关键作用,可作为胞外穿梭RNA 介导TGF-β/Smad信号通路以抑制EMT过程。Gao等[14]证实了ADSCs-Exo 可通过转运let-7d-5p 抑制I 型和IV 型胶原形成及TGF-β 和TGF-β 受体1(TGF-β receptor 1,TGFβR1)表达,从而延缓PM2.5诱导的EMT 和肺纤维化进程。此外,目前研究也在ADSCs-Exo 中发现了一系列靶向TGF-β/Smad 信号通路的特异性miRNAs,如靶向下调TGF-β 的miR-19b[15]、靶向下调TGF-β1的miR-21[16]、靶向下调TGF-β2 的miR-200[17]等。上述miRNAs 已被证明在IPF 患者及实验性肺纤维化小鼠细胞及组织中表达水平下调,而通过诱导这些miRNAs 表达可以抑制EMT 进而缓解甚至逆转肺纤维化进程[18]。另一方面,ADSCs-Exo 可通过调控Smad 非依赖的TGF-β 信号通路抑制EMT 形成。研究者们发现ADSCs-Exo 可释放大量的肝细胞生长因子(hepatocyte growth factor,HGF)和前列腺素E2(prostaglandin E2,PGE2),这两种细胞因子通过阻断TGF-β 活化抑制成纤维细胞的增殖,并以PI3K/Akt依赖的方式抑制EMT[19]。ADSCs-Exo 也可通过降低TGF-β 的表达,靶向调控ZEB1(zinc finger E-box binding homeobox 1)/miR-200 信号通路,从而抑制和逆转EMT过程[20]。
2.2 ADSCs-Exo 通过调控Wnt/β-catenin 通路信号调节EMT 过程 相关文献报道,Wnt/β-catenin 信号在IPF中异常激活,降低该信号通路活化水平可以部分恢复上皮表型并抑制肺纤维化的进展,提示Wnt/β-catenin 介导的EMT 在IPF 中发挥了关键作用[21]。Shao 等[22]发现,ADSCs-Exo 中含有Wnt/β-catenin 信号通路的拮抗剂分泌型糖蛋白Dickkopf-1(DKK-1),可以有效阻断电离辐射诱导的EMT进而限制放射性肺纤维化的发生。Rong 等[23]的研究表明,人骨髓间充质干细胞来源的外泌体可以下调Wnt 信号通路中的β-catenin 及WISP1(Wnt1-inducible signaling pathway protein 1)的表达,对WISP1 表达的抑制作用尤为显著,由此不仅延缓EMT进程,而且降低细胞外基质沉积以抑制纤维化。另有研究发现,人脐带间充质干细胞来源的外泌体可通过诱导Yes 相关蛋白(Yes-associated protein,YAP)磷酸化而抑制Wnt/βcatenin信号转导,从而下调α-平滑肌肌动蛋白及I型和III 型胶原的表达[24]。YAP 信号是Hippo 信号通路的核心成分,可阻止β-catenin 核转位并降低βcatenin 稳定性进而抑制Wnt 信号,Hippo 和Wnt 信号通路之间相互调控共同参与EMT 过程[25]。另外,Wnt 和TGF-β 信号通路之间也互相调节、互相影响,Wnt 已被证明与TGF-β 信号通路通过协同作用共同诱导EMT 过程,这些复杂的调节网络在IPF 发病机制中起着重要作用[26]。Tsukasa 等[27]通过气管内注射人支气管上皮细胞来源的外泌体减轻了博来霉素诱导的肺纤维化发展,并发现外泌体中某些高表达的miRNAs(miR-200a 和miR-26a)通过调节TGF-β-Wnt 的协同作用发挥抗纤维化作用。因此,靶向调控TGF-β 和Wnt 的相互调节节点可能是治疗IPF 的有效策略之一。
EMT 是正常生长发育和伤口愈合的重要生理过程,但失调的EMT过程促进组织纤维化和肿瘤形成。EMT 的稳态通过多种信号通路调控,ADSCs-Exo 通过调控其中一个及多个信号通路影响EMT 过程(总结见表1),进一步研究ADSCs-Exo 在EMT 进程中的调控机制有望发现治疗IPF的新方法。
3 ADSCs-Exo调节免疫反应影响IPF的发生发展
异常的免疫反应是促进IPF 发生发展的重要病因。动物及人类相关研究结果表明,先天性和获得性免疫过程参与了IPF形成的整个阶段,并可能决定疾病进展的速度[28]。研究者发现,在确诊的IPF患者肺组织中,纤维化病灶中存留大量的CD4+T 细胞及嗜酸性粒细胞,并且在该类患者血清及支气管肺泡灌洗液中可检测到高水平的自身抗体及各种趋化因子[29]。ADSCs-Exo 具有减轻炎症及免疫反应的作用,已被广泛应用于自身免疫性疾病的研究及治疗中,但在IPF 中的治疗作用及机制仍处于探索阶段,从现有的研究来看,ADSCs-Exo 免疫调节功能可能对IPF发生发展有着至关重要的调节作用[30]。
3.1 ADSCs-Exo通过调控T细胞免疫应答维持免疫稳态 研究者们将缺乏CD28(一种T 细胞完全活化所必需的细胞表面共刺激分子)的小鼠用博来霉素处理后,发现其肺纤维化程度较野生型小鼠明显减轻;进一步将CD28+T 细胞转移至CD28-/-小鼠体内,可恢复小鼠对博来霉素的纤维化反应,表明T 细胞对IPF 形成起驱动作用[31]。然而T 细胞种类繁多,各亚群及其分泌的细胞因子可能于不同层面影响IPF的形成。目前的研究主要集中在调节性T细胞(regulatory T cells,Treg)与辅助性T 细胞17(T helper 17 cells,Th17)。IPF 患者存在Treg/Th17 比例下调,研究证明Treg 减少了成纤维细胞的交联、聚集,抑制了炎症反应;与此相反,Th17 通过分泌白细胞介素17A(interleukin-17A,IL-17A)促进成纤维细胞增殖分化和炎症介质的产生,并降低成纤维细胞对Treg 免疫调节的反应[32]。因此T 细胞亚群的动态平衡对IPF发生发展至关重要,ADSCs-Exo可通过对T细胞亚群的调控发挥其在IPF 中的调节作用。Blazquez 等[33]发现,ADSCs-Exo 可抑制T 细胞的功能,包括减少干扰素γ(interferon-γ,IFN-γ)的分泌以抑制T 细胞的激活,以及阻碍抗CD3/CD2/CD28 抗体介导的T 细胞向效应-记忆细胞表型的分化。同时,Blazquez 等[33]猜测,由于缺乏MHC-II类分子和共刺激分子,ADSCs-Exo 对T 细胞可能有不依赖于抗原提呈的直接抑制作用。此外,Bolandi 等[34]发现,ADSCs-Exo 通过携带并转移miR-10a 促进T 细胞向Treg 转化,并抑制其向Th17分化。ADSCs-Exo含有的众多miRNAs 中,不仅上文提及的miR-10a,其它miRNAs 如miR-21、miR-20和miR-93也相继被证明可提高Treg与Th17比例,它们可能是通过调节STAT3、STAT5 或TGF-β 通路实现的[35-36]。另有研究表明,ADSCs-Exo 中含有肿瘤坏死因子刺激基因6(tumor necrosis factor-stimulated gene 6,TSG-6)、吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)和程序性死亡配体1(programmed death ligand 1,PD-L1)三种负反馈免疫调节分子,可通过控制T 细胞增殖和提高Treg 的数量及活性而抑制免疫反应[37]。
3.2 ADSCs-Exo 通过诱导巨噬细胞向M2 型极化调节免疫反应 巨噬细胞作为非特异性免疫的重要组成部分,具有多样性和可塑性特征,在环境刺激或不同的生理病理条件下可通过M1(促炎)/M2(抗炎)表型转换参与炎症调控及组织修复过程[38]。有文献报道M2 型巨噬细胞不仅通过分泌IL-10 发挥抗炎作用,同时分泌基质金属蛋白酶并通过细胞内途径降解胶原参与细胞外基质重塑[39]。在矽肺和肺损伤模型小鼠中,研究者们也发现M2型巨噬细胞数量的增加可延缓肺纤维化发展。Heo 等[39]将ADSCs-Exo 和巨噬细胞共培养后检测后者的表型变化,发现外泌体下调了M1 型标志物TNF-α 和iNOS 表达,并使M2型标志物Arg-1、IL-10 和CCL22 表达上调,表明ADSCs-Exo 可促进巨噬细胞向M2 型极化。同样,Shang 等[40]在ADSCs 和巨噬细胞的共培养中验证了外泌体从ADSCs到巨噬细胞的单向转移并诱导其向M2 型极化,进一步的研究发现缺乏p-STAT3 的ADSCs-Exo 不能诱导巨噬细胞高表达Arg-1,而巨噬细胞中STAT3的敲除对ADSCs-Exo 触发的Arg-1 高表达无明显影响,表明ADSCs-Exo 通过携带的p-STAT3 激活Arg-1 进而诱导巨噬细胞向M2 型极化。此外,相关研究表明,ADSCs-Exo 在心肌梗死模型中可通过激活S1P/SK1/S1PR1 及AKT1/AKT2 信号通路来促进M2型巨噬细胞极化,从而减轻心肌梗死后炎症及纤维化反应[41-42]。ADSCs-Exo 也可通过释放某些参与免疫调节反应的miRNAs 进而调节巨噬细胞向M2 型极化,如靶向上调PI3K/Akt 信号的miR-21[43]、靶向下调TLR4/NF-κB 信号的miR-181c[44]、同时靶向调节2条信号通路的miR-182[45]等。PI3K/Akt和TLR4/NF-κB 信号通路是巨噬细胞极化机制中研究最广泛的,两者之间的相互作用机制复杂,ADSCs-Exo 如何通过转运miRNAs 调节这2 条信号通路的平衡尚需进行深入研究。
先天性和获得性免疫反应参与了IPF 形成的各个阶段,在其发病机制中占据重要地位。ADSCs-Exo通过控制T细胞增殖分化、Treg细胞活性和巨噬细胞极化发挥免疫调节作用(总结见表1),有望成为IPF潜在的治疗药物。

表1 ADSCs-Exo携带的蛋白及RNAs在调节IPF中的作用机制Table 1.The mechanism of ADSCs-Exo-secreted proteins or RNAs in mediating idiopathic pulmonary fibrosis
4 小结和前景
IPF 病理过程复杂,目前尚缺乏有效的防治措施,发病率和病死率仍呈升高趋势。本文中,我们介绍了目前ADSCs-Exo 在IPF 治疗方面的一些主要国内外研究成果。我们发现,尽管ADSCs-Exo 在治疗IPF中的研究尚处于起步阶段,但目前仅有的研究结果显示其对IPF 具有潜在的临床治疗作用及价值。然而将外泌体用于治疗IPF仍存在诸多挑战。首先,外泌体提取方式、保存条件、给药途径及剂量方面尚无标准化,此方面有待深入的研究;其次,目前的研究多集中于ADSCs-Exo 中miRNAs 的探讨,对其分泌的蛋白质、脂质和其他非编码RNA 的生物潜能知之甚少;最后,ADSCs-Exo 应用于IPF 治疗的研究尚处于动物实验阶段,需进一步探究其临床治疗的安全性及可行性。随着未来研究的不断深入,肺纤维化的发病机制和ADSCs-Exo 对肺纤维化的调控作用及其机制将被逐渐阐明,ADSCs-Exo 有望成为未来临床治疗IPF的重要手段。
