齐墩果酸通过Nrf2抑制铁死亡并减轻重症急性胰腺炎大鼠肝损伤*
2022-09-01常东鸽霍刘斌程晓丹潘晓立吴慧丽
李 建,常东鸽,霍刘斌,程晓丹,潘晓立,吴慧丽
(郑州大学附属郑州中心医院1急诊科,2消化内科,河南郑州 450001)
急性胰腺炎是一种临床常见胰腺炎性疾病,伴随腹痛和血清淀粉酶(amylase,AMY)浓度升高,一般预后良好,然而少数可能发展为重症急性胰腺炎(severe acute pancreatitis,SAP),易引起多器官损伤,导致死亡[1]。肝损伤是SAP常见器官损伤之一,且肝衰竭是导致死亡的重要因素[2],目前仍缺乏有效防治措施,因此分析SAP 肝损伤的机制可能有利于寻找治疗策略。
SAP 发生时,机体炎症和氧化应激反应爆发,攻击各组织器官,引起细胞凋亡、坏死,造成器官结构和功能损伤[3]。铁死亡为2012 年发现的细胞死亡的形式,依赖脂质过氧化和铁积累[4]。研究证明,铁死亡参与非酒精性脂肪性肝损伤[5]、缺血再灌注肺损伤[6]、SAP 肾损伤[7]等病理过程,通过抑制铁死亡可减轻上述损伤。核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)抗氧化轴为调节细胞抗氧化、死亡和存活的重要通路,激活Nrf2 通路可改善SAP 肝或肾损伤[8-9]。另外,Nrf2 活化后可通过影响谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)等表达调节铁死亡过程,实现对非酒精性肝损伤[5]和缺血再灌注肺损伤[6]等的治疗。然而铁死亡在SAP肝损伤中的作用尚不清楚。
齐墩果酸(oleanolic acid,OLA)是提取自木犀科植物的天然萜类化合物,具有抗氧化、抗病原物、抗炎、抗糖尿病及保肝等作用,已被用作保肝药物多年[10]。在胆汁淤积急性肝损伤大鼠中的研究表明,OLA 可促进肝脏对胆酸的代谢能力,减轻肝损伤[11]。本实验拟建立SAP 大鼠模型,探讨铁死亡与SAP 大鼠肝损伤的关系,并分析OLA 对SAP 大鼠肝损伤过程中铁死亡和Nrf2-抗铁死亡轴的影响。
材料和方法
1 动物
40 只雄性8 周龄SD 大鼠,SPF 级,体重(300±10)g,购自北京维通利华公司,许可证号:SCXK(京)-2016-0011。均饲养于(24±1)℃、50%±5%湿度、12 h光/暗循环的动物房中,保持水和食物充足。
2 主要试剂和仪器
OLA 购自西安力邦制药公司;铁死亡抑制剂ferrostatin-1(FER1)和Nrf2 抑制剂brusatol(BRU)购自MCE;总胆汁酸(total bile acid,TBA)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)及AMY试剂盒购自安图生物工程有限公司;总蛋白提取试剂盒、核蛋白提取试剂盒、HE 试剂盒及丙二醛(malondialdehyde,MDA)比色试剂盒购自上海生工生物公司;DCFH-DA 活性氧(reactive oxygen species,ROS)和总谷胱甘肽(total glutathione,t-GSH)试剂盒购自上海碧云天生物技术公司;抗GAPDH、Nrf2、histone H3、谷胱甘肽合成酶(glutathione synthetase,GSS)和GPX4 抗体,羊抗兔Ⅱ抗,铁检测试剂盒,4-羟基壬烯醛(4-hydroxynonenal,4-HNE)试剂盒和TUNEL 凋亡试剂盒购自Abcam;cleaved caspase-3、HO-1 和铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1;即AIFM2)抗体均购自Affinity。酶标仪购自Thermo;荧光和普通显微镜购自Leica;荧光定量PCR 仪和电泳转膜仪器购自Bio-Rad。
3 主要方法
3.1 SAP 模型的建立 大鼠术前12 h 禁食,自由饮水。经腹部皮下注射1%戊巴比妥钠(40 mg/kg)麻醉后行开腹手术,参照文献[7],经十二指肠逆行用微量注射泵将5%牛磺胆酸钠(1 mg/kg)以0.1 mL/min 匀速泵入胰胆管,持续10 min,移开注射泵并逐层缝合腹部伤口。假手术(sham)组行开腹手术后,仅触碰胰胆管部位。
3.2 动物分组及给药 将大鼠采用随机数字法分组为sham 组、SAP 组、OLA+SAP 组、FER1+SAP 组和OLA+BRU+SAP 组,每 组8 只。OLA+SAP 组在注 射牛磺胆钠酸后0.5、3 和6 h 先腹腔注射生理盐水,再立即给予60 mg/kg OLA 灌胃[12];FER1+SAP 组在注射牛磺胆钠酸后0.5、3 和6 h 先腹腔注射2 mg/kg FER1[13],再立即给予生理盐水灌胃;OLA+BRU+SAP组在给予OLA 前腹腔注射2 mg/kg BRU[5];sham 组和SAP组同步灌胃和腹腔注射生理盐水。
3.3 样本采集 造模后6 h(即末次给药后)经尾静脉取血,4 ℃离心分离血清。造模后12 h(即末次给药后6 h),处死大鼠取腹主动脉血,4 ℃离心分离血清;随后分离胰脏及肝脏,冲净后将肝脏分为3 份,一份置于-80 ℃冻存;一份与胰脏一起用4%多聚甲醛浸没固定,分别制备5µm 厚的胰脏和肝脏石蜡切片;一份制备新鲜肝脏组织匀浆液。
3.4 HE 和TUNEL 染色 用HE 试剂盒分别对3.3中胰脏和肝脏石蜡切片染色,普通显微镜下观察胰脏和肝脏形态变化。另外用TUNEL 试剂盒染色后观察肝细胞死亡情况,荧光显微镜下拍照,ImageJ 软件分析肝细胞凋亡率。凋亡率(%)=(凋亡肝细胞TUNEL+数量/视野下总肝细胞DAPI+数量)×100%。
3.5 血清指标测定 用自动分析仪联合ALT、AST、TBA、ALB 及AMY 试剂盒测定3.3 中血清的各指标水平。
3.6 肝组织MDA、ROS、4-HNE、t-GSH 水平及铁含量测定 取3.3 中新鲜肝脏组织匀浆液,离心取上清,测定蛋白浓度后,用酶标仪联合MDA、ROS、4-HNE、t-GSH及铁检测试剂盒,测定各指标水平。
3.7 Western blot 检测 分别使用总蛋白和核蛋白提取试剂盒从3.3 中冷冻肝组织中提取总蛋白和核蛋白,并定量。取30µg蛋白通过凝胶电泳分离并转印到PVDF 膜上,将膜用5%脱脂奶粉封闭,用Ⅰ抗(GAPDH、Nrf2、histone H3、cleaved caspase-3、HO-1、GSS、GPX4和FSP1)稀释液(GAPDH 为1∶2 000,其他均为1∶1 000)孵育过夜,再用羊抗兔Ⅱ抗稀释液(1∶2 000)孵育60 min,最后用ECL 发光液避光孵育5 min。将膜置于蛋白凝胶成像仪中拍照并分析蛋白条带灰度。
4 统计学处理
实验数据用平均数±标准差(mean±SD)描述并使用GraphPad Prism 8.0 软件进行分析。用单因素方差分析行多组间比较,用SNK-q检验行两两比较。以P<0.05时为差异有统计学意义。
结果
1 各组大鼠血清生化指标的比较
造模后6 和12 h,相较于sham 组,SAP 组血清ALT、AST、TBA、AMY 水平升高(P<0.05),ALB 水平降低(P<0.05);造模后6 h,相较于SAP组,OLA+SAP组、FER1+SAP 组血清AMY 水平降低(P<0.05);造模后6 h,相较于OLA+SAP 组,FER1+SAP 组、OLA+BRU+SAP 组血清AMY 水平升高(P<0.05);造模后12 h,相较于SAP组,OLA+SAP组、FER1+SAP组血清ALT、AST、TBA、AMY 水平降低(P<0.05),ALB 水平升高(P<0.05);造模后12 h,相较于OLA+SAP 组,FER1+SAP 组、OLA+BRU+SAP 组血清ALT、AST、TBA、AMY 水平升高(P<0.05),ALB 水平降低(P<0.05),见表1。

表1 各组ALT、AST、TBA、ALB及AMY水平的比较Table 1.Comparison of ALT,AST,TBA,ALB and AMY levels in the 5 groups(Mean±SD. n=8)
2 各组大鼠胰腺及肝组织形态的比较
sham组胰腺及肝细胞胞膜、胞核结构完整,排列整齐,均未见炎性细胞;SAP 组胰腺及肝叶间隙增大,细胞排列不规则且细胞肿胀变形,可见较多炎性细胞;OLA+SAP 组、FER1+SAP 组胰腺及肝损伤明显缓解,且OLA+SAP 组改善效果优于FER1+SAP 组;OLA+BRU+SAP组较OLA+SAP组加重,见图1。
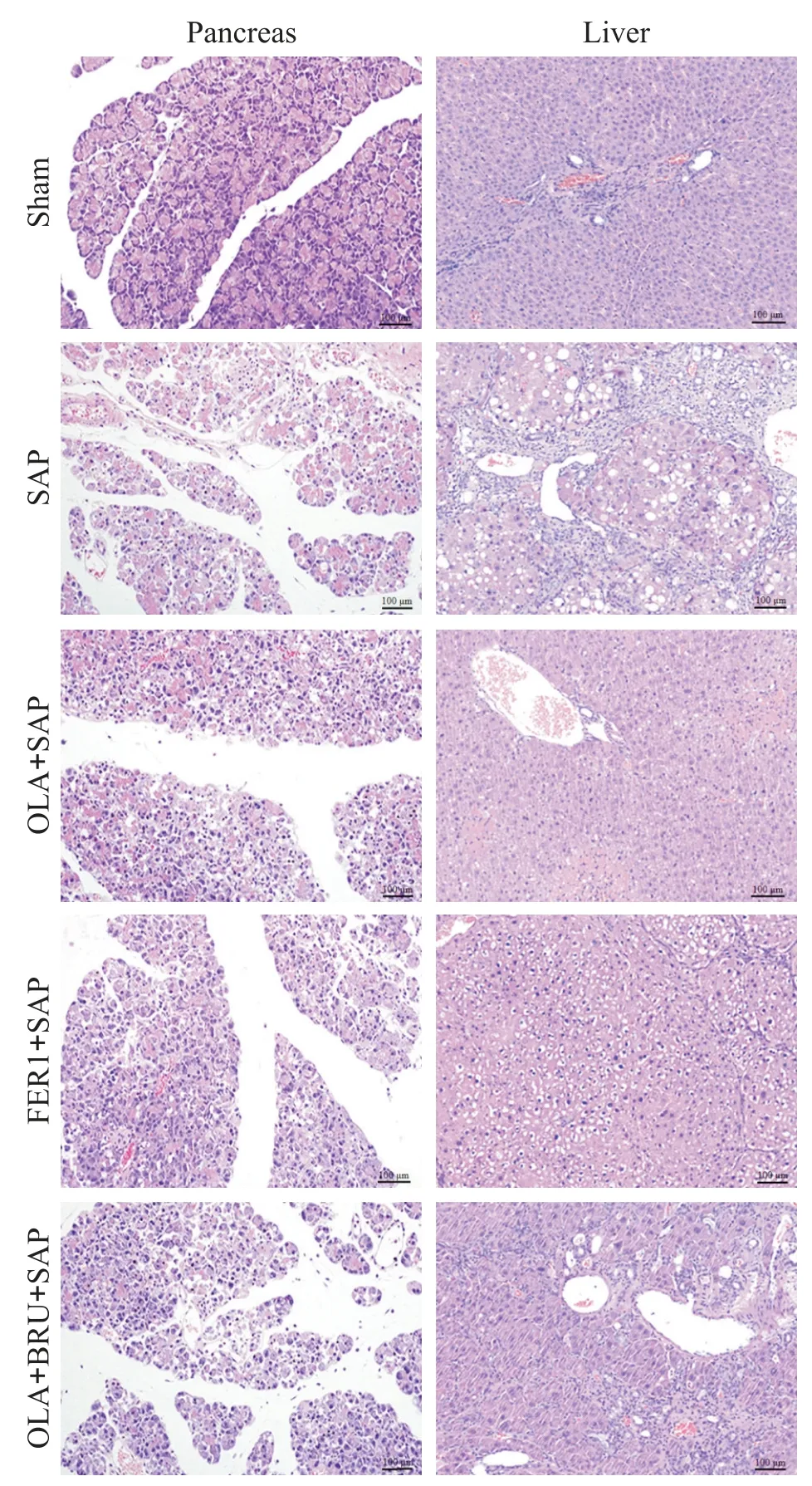
Figure 1.Morphological changes of pancreatic and liver tissues in the 5 groups(HE staining,scale bar=100µm).图1 各组胰腺和肝组织形态的比较
3 各组大鼠肝细胞凋亡的比较
相较于sham 组,SAP 组cleaved caspase-3 蛋白水平和肝细胞凋亡率显著增加(P<0.05);相较于SAP组,OLA+SAP 组和FER1+SAP 组cleaved caspase-3 蛋白水平和肝细胞凋亡率显著降低(P<0.05);相较于OLA+SAP 组,FER1+SAP 组 和OLA+BRU+SAP 组cleaved caspase-3 蛋白水平和肝细胞凋亡率显著增高(P<0.05),见图2、3。

Figure 2.TUNEL assay was used to detect hepatocyte apoptosis.The scale bar=50 µm.Mean±SD. n=8.*P<0.05 vs sham group;#P<0.05 vs SAP group;△P<0.05 vs OLA+SAP group.图2 TUNEL染色检测肝细胞凋亡
4 各组大鼠肝组织中氧化应激指标的比较

Figure 3.Comparison of liver cleaved caspase-3 protein level in the 5 groups.Mean±SD. n=8.*P<0.05 vs sham group;#P<0.05 vs SAP group;△P<0.05 vs OLA+SAP group.图3 各组肝脏cleaved caspase-3的比较
相较于sham 组,SAP 组肝组织中ROS、MDA 和4-HNE水平显著增高(P<0.05),t-GSH水平显著降低(P<0.05);相较于SAP组,OLA+SAP 组和FER1+SAP组肝组织中ROS、MDA 和4-HNE 水平显著降低(P<0.05),t-GSH 水平显著增高(P<0.05);相较于OLA+SAP 组,OLA+BRU+SAP 组肝组织中ROS、MDA 和4-HNE 水平显著增高(P<0.05),t-GSH 水平显著降低(P<0.05),见表2。
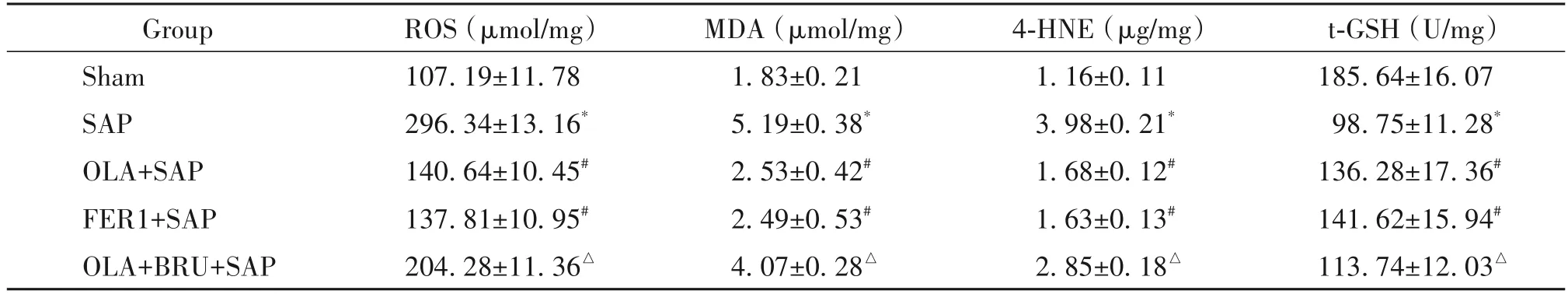
表2 各组ROS、MDA、4-HNE及t-GSH水平的比较Table 2.Comparison of ROS,MDA,4-HNE and t-GSH levels in the 5 groups(Mean±SD. n=8)
5 各组大鼠肝组织中铁含量的比较
相较于sham 组,SAP 组肝组织中铁含量显著增加(P<0.05);相较于SAP 组,OLA+SAP 组、FER1+SAP 组肝组织中铁含量显著减少(P<0.05);相较于OLA+SAP 组,FER1+SAP 组、OLA+BRU+SAP 组肝组织中铁含量显著增加(P<0.05),见图4。
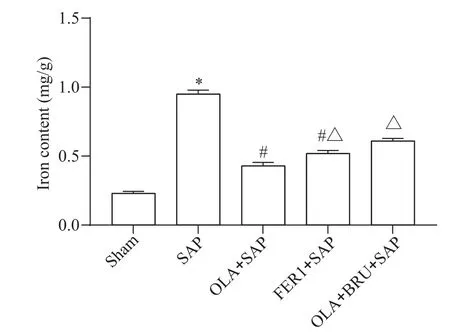
Figure 4.Comparison of iron content in the 5 groups.Mean±SD.n=8.*P<0.05 vs sham group;#P<0.05 vs SAP group;△P<0.05 vs OLA+SAP group.图4 各组铁含量比较
6 各组大鼠肝组织中Nrf2-抗铁死亡轴相关蛋白表达的比较
相较于sham 组,SAP 组核蛋白及总蛋白中Nrf2水平,总蛋白中HO-1、GSS、GPX4 和FSP1 水平显著降 低(P<0.05);相较于SAP 组,OLA+SAP 组 和FER1+SAP 组核蛋白及总蛋白中Nrf2 水平,总蛋白中HO-1、GSS、GPX4 和FSP1 水平显 著增加(P<0.05);相较于OLA+SAP 组,FER1+SAP 组和OLA+BRU+SAP 组核蛋白及总蛋白中Nrf2 水平,总蛋白中HO-1、GSS、GPX4 和FSP1 水平显著降低(P<0.05),见图5。
讨 论
SAP 肝损伤涉及炎症和过氧化等共同作用。OLA 在抑制肝脏炎症和脂肪累积[14]、抑制肝纤维化[15]、提高脂肪代谢[16]及改善肝脏氧化应激和胆汁代谢[17]的效果已被证实,这是其作为保肝药物的基础。研究显示,OLA 可改善肝纤维化大鼠的肝功能血清指标,减轻肝中炎症和细胞坏死[15]。本研究中SAP 大鼠经OLA 治疗12 h 后,胰腺和肝形态损伤均减轻,且血清ALT、AST、TBA 及AMY 水平降低,ALB水平升高。胰腺或肝细胞出现损伤后,细胞内AMY、ALT 和AST 等代谢酶释放入血,且肝细胞代谢胆红素及合成ALB 等蛋白的能力降低,表现为血清水平异常[17]。本研究在SAP 大鼠中也观察到与人类胰腺和肝细胞损伤类似的血清指标变化,提示OLA 可改善SAP 大鼠肝脏合成代谢能力,保护胰腺和肝细胞结构完整,对SAP肝损伤也有治疗作用。

Figure 5.Comparison of the expression of Nrf2-antiferroptosis axis-related proteins in the 5 groups.Mean±SD. n=8.*P<0.05 vs sham group;#P<0.05 vs SAP group;△P<0.05 vs OLA+SAP group.图5 各组Nrf2-抗铁死亡轴相关蛋白表达的比较
过度氧化应激是急性炎症性疾病中细胞损伤的重要原因,研究显示,氧化应激和相关ROS的累积在AP 的胰腺腺泡细胞损伤中起主要作用[18]。过量的ROS 可对核酸和脂质等进行氧化修饰破坏它们的功能,如果细胞内Fe2+水平升高,则可能发生铁死亡[19]。通常情况下,机体内循环铁主要与转铁蛋白结合并以Fe3+形式存在,当机体铁稳态失衡时,Fe3+通过细胞膜上的转铁蛋白受体进入细胞,被还原为具有活性的Fe2+,这些Fe2+进一步将脂质过氧化物转化为ROS,引起细胞铁死亡[20]。因此,ROS、脂质过氧化物和Fe2+的产生及累积是诱导铁死亡的基础。本研究在SAP 大鼠肝脏中检测到细胞死亡率、铁离子含量、ROS、MDA 和4-HNE 水平增高,t-GSH 水平降低,且铁死亡抑制剂FER1 可减轻SAP 大鼠肝中脂质过氧化程度、铁累积及细胞死亡,说明铁死亡参与SAP 肝损伤过程。研究显示,抑制氧化应激可抑制急性肝衰竭铁死亡,可以降低病理损伤,改善肝功能[21]。本研究中,OLA 治疗可明显增加SAP 大鼠t-GSH 水平,减少细胞死亡率、铁离子含量及ROS、MDA和4-HNE水平,提示OLA 可减少铁死亡所需的脂质氧化物和铁累积,具有抑制铁死亡的活性。
铁死亡是依赖于铁的脂质过氧化性细胞死亡,GSH、HO-1、GPX4 及FPS 等抗氧化分子或酶共同组成抗铁死亡轴,抵抗铁死亡。GSS 为合成GSH 所必需的酶,而GPX4 可与GSH 共同作用,将脂质过氧化物还原为无细胞毒性的脂质醇,是铁死亡的重要调节因子,当GSH合成受阻时,GPX4的活性下降,细胞抗氧化能力下降,导致ROS 积累,促进铁死亡[22-23]。FSP为铁死亡抑制蛋白,可通过促进辅酶Q10再生增强机体对脂质过氧化自由基的还原能力,和GPX 途径平行发挥作用[13,24]。Nrf2 通路是细胞内源性抗氧化机制,可以被氧化刺激入核活化,诱导下游信号分子HO-1、GSS 和GPX4 等的表达,以发挥抗氧化应激反应[25]。此外,Nrf2 通路的激活已被证实可阻碍铁死亡[25],而铁死亡是炎症性疾病的治疗靶点[26]。本研究中,OLA 可显著增加SAP 大鼠肝组织核蛋白及总蛋白中Nrf2 水平,总蛋白中HO-1、GSS、GPX4 及FSP1水平,提示OLA 可促进大鼠肝中Nrf2-抗铁死亡轴活化。进一步研究显示,Nrf2 抑制剂BRU 可减弱OLA 对SAP 肝损伤的作用及对氧化应激、铁死亡的抵抗作用,提示Nrf2-抗铁死亡轴在OLA 保护SAP 大鼠肝损伤中发挥作用。
综上所述,铁死亡参与SAP 大鼠肝损伤过程,OLA 可通过激活Nrf2-抗铁死亡轴抵抗细胞铁死亡,减轻SAP 大鼠肝损伤。另外,SAP 肝损伤还涉及肌醇需求酶1α 介导的内质网相关凋亡通路[27]、TLR4/NF-κB p65 介导的炎症通路[28],结合本研究内容,推测OLA可能通过多途径发挥对SAP肝损伤的保护。
